Артериовенозная мальформация матки: Артериовенозные мальформации матки
Артериовенозные мальформации матки
Введение
Артериовенозная мальформация (АВМ) матки — это дисплазия сосудов в виде коммуникации маточных вен с ветвями артерий разного калибра из бассейнов внутренних подвздошный артерий [1].
АВМ матки является редковстречаемым заболеванием, точная распространенность неизвестна. За 90 лет наблюдений в мировой литературе представлено менее 150 случаев. Впервые такая патология была описана G. Dubreuil и E. Loubat [2] в 1926 г. как «aneurysme cirsoide de l’uterus».
Исследование, проведенное P. O’Brien и соавт. [3], показало, что число случаев АВМ составило 4,5% при 464 ультразвуковых исследованиях органов малого таза, проведенных по поводу маточного кровотечения.
Эта сосудистая патология представляет собой сплетение аномальных артериовенозных соустий, при котором нормальное капиллярное сообщение между артериями и венами отсутствует.
Классификация и клинические проявления
АВМ матки может быть врожденной или приобретенной [4]. Врожденная форма встречается очень редко и является результатом нарушения дифференцировки эмбриональных сосудов [5] вследствие воздействия неблагоприятных факторов в первые 2 мес беременности: ионизирующего излучения, вирусных инфекций, тератогенных, наркотических препаратов, вредных привычек и др. Главной особенностью врожденной патологии является большое количество питающих артерий таза (не только маточных артерий) и дренируюших вен [6]. Они часто проникают в окружающие ткани за пределы матки и могут образовывать сложную коллатеральную сосудистую сеть. Кроме того, эти врожденные поражения могут расти по мере прогрессирования беременности [7]. Для врожденных АВМ матки характерна дисплазия сосудов: отсутствие всех типичных слоев и обилие в стенках глиальных и коллагеновых волокон, аномальная пролиферация. По данным литературы, дисплазии относятся к высокодифференцированным сосудистым образованиям и не малигнизируются [6].
Врожденная форма встречается очень редко и является результатом нарушения дифференцировки эмбриональных сосудов [5] вследствие воздействия неблагоприятных факторов в первые 2 мес беременности: ионизирующего излучения, вирусных инфекций, тератогенных, наркотических препаратов, вредных привычек и др. Главной особенностью врожденной патологии является большое количество питающих артерий таза (не только маточных артерий) и дренируюших вен [6]. Они часто проникают в окружающие ткани за пределы матки и могут образовывать сложную коллатеральную сосудистую сеть. Кроме того, эти врожденные поражения могут расти по мере прогрессирования беременности [7]. Для врожденных АВМ матки характерна дисплазия сосудов: отсутствие всех типичных слоев и обилие в стенках глиальных и коллагеновых волокон, аномальная пролиферация. По данным литературы, дисплазии относятся к высокодифференцированным сосудистым образованиям и не малигнизируются [6].
Приобретенные АВМ матки диагностируются значительно чаще и представляют собой артериовенозные шунты между интрамуральными артериальными ветвями маточной артерии и венозными сплетениями внутри матки [3, 8, 9]. Эта патология возникает в результате травматического повреждения эндо- и миометрия (многочисленные выскабливания стенок полости матки, оперативные вмешательства на матке: кесарево сечение, консервативная миомэктомия и т.д.). В последние годы появляется все больше сообщений о приобретенных маточных сосудистых поражениях после родов, искусственного и самопроизвольного аборта, неразвивающейся беременности. Реже причинами являются аденомиоз, трофобластические заболевания (хорионэпителиома, пузырный занос, хориокарцинома) [10, 11]. В последнем случае аномалии возникают из-за инволюции кровеносных сосудов на фоне активной пролиферации цито- и синцитиотрофобласта. В результате локальные отеки и деструкция ворсин хориона формируют полости и соустья в миометрии в виде «цистерн» [12, 13]. В числе более редких причин — рак эндометрия, инфекции.
Эта патология возникает в результате травматического повреждения эндо- и миометрия (многочисленные выскабливания стенок полости матки, оперативные вмешательства на матке: кесарево сечение, консервативная миомэктомия и т.д.). В последние годы появляется все больше сообщений о приобретенных маточных сосудистых поражениях после родов, искусственного и самопроизвольного аборта, неразвивающейся беременности. Реже причинами являются аденомиоз, трофобластические заболевания (хорионэпителиома, пузырный занос, хориокарцинома) [10, 11]. В последнем случае аномалии возникают из-за инволюции кровеносных сосудов на фоне активной пролиферации цито- и синцитиотрофобласта. В результате локальные отеки и деструкция ворсин хориона формируют полости и соустья в миометрии в виде «цистерн» [12, 13]. В числе более редких причин — рак эндометрия, инфекции.
Некоторые авторы отдельно выделяют такой термин, как «артериовенозные фистулы», которые представляют собой единственное соединение между артерией и веной без участия внематочных артерий.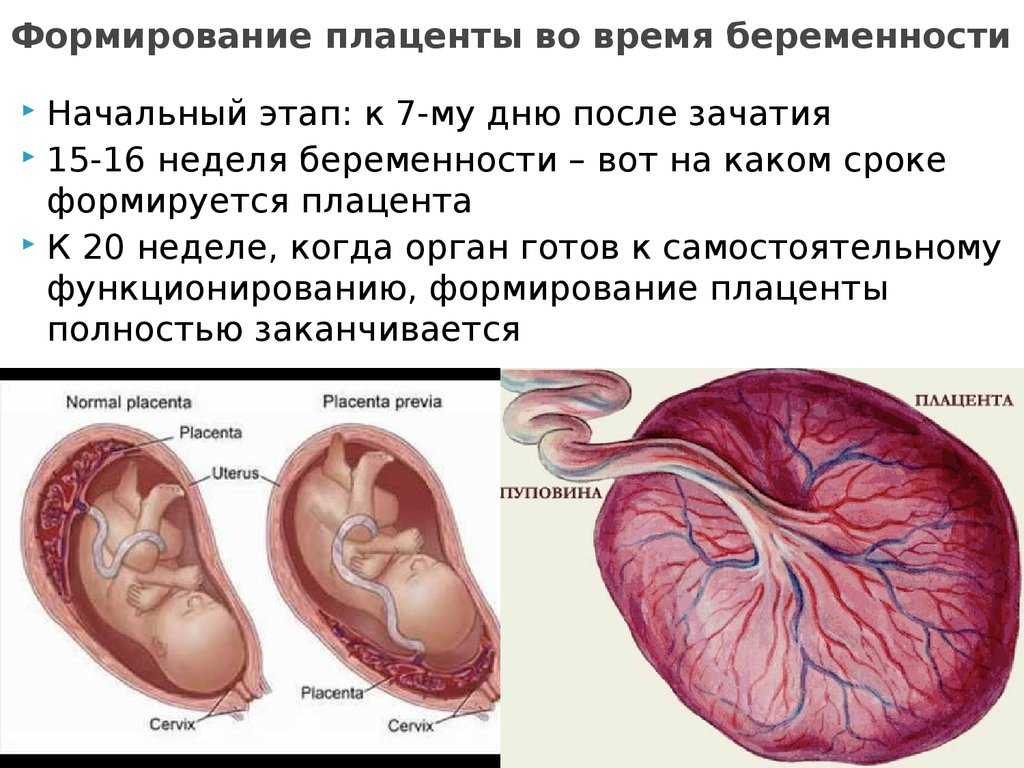 Размеры фистул значительно меньше [6]. Они возникают в результате травматического повреждения соприкасающихся между собой вен и артерий. Привести к этому могут ранения, повреждения кровеносных сосудов при хирургическом вмешательстве или пункционной биопсии.
Размеры фистул значительно меньше [6]. Они возникают в результате травматического повреждения соприкасающихся между собой вен и артерий. Привести к этому могут ранения, повреждения кровеносных сосудов при хирургическом вмешательстве или пункционной биопсии.
АВМ описана в литературе в самых разных возрастных категориях [14]. У детей описаны единичные случаи — у мертворожденной девочки [5], у девочки 6 мес [15].
Мальформации сосудов представляют собой большую опасность, поскольку могут служить причиной массивных кровотечений, угрожающих жизни пациентки [16—18]. Вовремя не обнаруженная АВМ матки может привести к катастрофической потере крови при хирургических манипуляциях, а также при беременности и родах. К клиническим проявлениям также относятся боли в нижней части живота, диспареуния, анемия [19, 20]. Почти 30% больных необходимо переливание крови. Кроме того, наличие патологических артериовенозных соустий в стенке матки нередко становится причиной невынашивания беременности, гибели эмбриона и других патологических состояний [21, 22]. В некоторых случаях тяжелые АВМ могут привести к сердечно-сосудистым последствиям с симптомами одышки, усталости и сердечной декомпенсации [6]. Y. Zhu и соавт. [23] в своем исследовании (62 пациентки с диагнозом приобретенная АВМ матки) наблюдали следующие клинические проявления: 46 (79,3%) пациенток с нерегулярными маточными кровотечениями, 7 (12,1%) — с меноррагией, 5 (8,6%) — с обильным кровотечением во время выскабливания. У 33 (53,2%) из 62 пациенток была выявлена геморрагическая анемия со средним уровнем Hb 97,7±28,2 г/л. У 9 (14,5%) пациенток наблюдался геморрагический шок; 25 (40,3%) пациенткам было выполнено переливание крови.
В некоторых случаях тяжелые АВМ могут привести к сердечно-сосудистым последствиям с симптомами одышки, усталости и сердечной декомпенсации [6]. Y. Zhu и соавт. [23] в своем исследовании (62 пациентки с диагнозом приобретенная АВМ матки) наблюдали следующие клинические проявления: 46 (79,3%) пациенток с нерегулярными маточными кровотечениями, 7 (12,1%) — с меноррагией, 5 (8,6%) — с обильным кровотечением во время выскабливания. У 33 (53,2%) из 62 пациенток была выявлена геморрагическая анемия со средним уровнем Hb 97,7±28,2 г/л. У 9 (14,5%) пациенток наблюдался геморрагический шок; 25 (40,3%) пациенткам было выполнено переливание крови.
Средний период между инициирующим фактором (кесарево сечение, кюретаж, трофобластическая болезнь в анамнезе и другие акушерско-гинекологические ситуации) и началом маточного кровотечения составил 28,5 сут.
Авторы также отметили, что у 4 пациенток без клинических проявлений была обнаружена АВМ матки методом УЗИ с цветовым допплеровским картированием (ЦДК).
Врожденные мальформации чаще всего проявляются в период полового созревания или после родов и абортов [24]. Кровотечения могут возникать в случае, если тонкая стенка аномальных сосудов разрушается либо естественным образом после менструации, либо искусственно в результате травмы миометрия.
Диагностика
«Золотым стандартом» диагностики АВМ матки является ангиография. Она может выявить двустороннюю гипертрофию маточных артерий, которые питают извилистую, гипертрофированную сосудистую массу, а также ранний дренаж в увеличенные, гипертрофированные вены во время артериальной фазы. Этот инвазивный метод позволяет подтвердить диагноз и идентифицировать основные питающие сосуды, что необходимо знать в случае применения эмболизации маточных артерий в качестве варианта лечения [4, 15]. Магнитно-резонансная томография (МРТ) с контрастированием обеспечивает детальную визуализацию анатомии и взаимосвязи АВМ матки с окружающими структурами [21, 25], позволяет оценить питающие сосуды. Основными недостатками МРТ являются ее высокая стоимость, ограниченная доступность в некоторых медицинских учреждениях и странах.
Основными недостатками МРТ являются ее высокая стоимость, ограниченная доступность в некоторых медицинских учреждениях и странах.
Гистероскопия также используется для диагностики АВМ [26]. Этот метод может быть полезным для диагностики мальформаций, локализующихся непосредственно под эндометрием.
В настоящее время ультразвуковое исследование (УЗИ) становится предпочтительным диагностическим инструментом для АВМ матки ввиду неинвазивности, экономической выгодности метода, отсутствия необходимости подготовки. С помощью УЗИ сосудистая мальформация матки выявляется уже на первом этапе обследования пациентки.
При исследовании в B-режиме АВМ матки представляет собой конгломерат кистозных анэхогенных включений всевозможных форм и диаметров, разделенных тонкими гиперэхогенными линиями, четко отграниченный от неизмененного миометрия. Размеры мальформации могут быть разными: от небольших до поражения практически всех стенок матки. Гетерогенная структура возникает из-за чрезмерно расширенных артериовенозных шунтов [24, 27]. При цветовом допплеровском картировании (ЦДК) отмечается гиперваскуляризация патологического участка с мозаичным турбулентным кровотоком [28].
При цветовом допплеровском картировании (ЦДК) отмечается гиперваскуляризация патологического участка с мозаичным турбулентным кровотоком [28].
Допплерометрия служит существенным дополнением к сонографии и ЦДК. Интерпретация допплеровских кривых скоростей кровотока и индексов резистентности должна проводиться с учетом характера ультразвукового изображения в В-режиме и клинической ситуации. Такой подход практически полностью заменил инвазивные методы на этапе первичной диагностики и мониторинга заболевания [18, 24].
При мальформации определяется увеличение линейной и объемной скоростей кровотока, увеличение диастолической составляющей, снижение индекса резистентности. Систолическая и диастолическая скорости бывают в 4—6 раз выше, а индекс резистентности ниже, чем в нормальных сосудах миометрия [6, 24]. В литературе описан анализ пикового систолического кровотока (ПСК), индекса резистентности (ИР), индекса пульсации (ИП) [23, 29] при АВМ матки.
Оценка риска развития кровотечений весьма относительна, и по данным литературы может основываться только на оценке близости артериовенозных сообщений к базальному слою эндометрия [24].
Лечение
Существуют разные вариации лечения этой патологии — от органосохраняющей [29] до радикальной (экстирпация матки).
Единого мнения о лучшем методе лечения АВМ матки нет. Текущие медицинские и хирургические возможности основаны на опыте врачей и опубликованных отчетах об анализе случаев. Лечение зависит от выраженности кровотечения: в случаях легкой и умеренной кровопотери, разрешения эпизода кровотечения, или если кровотечение является длительным, но невыраженным (т.е. когда пациентка гемодинамически стабильна), первичный выбор метода лечения должен быть консервативным в течение максимального периода 3—6 мес [26]. Если регресса АВМ не происходит, используют хирургические методы.
В случае стабильных гемодинамических показателей может применяться медикаментозное лечение. В литературе описана терапия эстрогенами и прогестинами, 15-метилпростагландином F2α, пероральными контрацептивами. L. Montanari и A.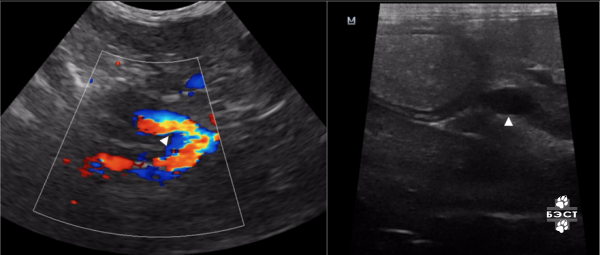 Alfei [22] сообщили о пациентке с АВМ матки, которую лечили внутривенно конъюгированными эстрогенами и пероральным малеатом метилэргометрина. Кроме того, имелись сообщения об использовании агониста гонадотропин-рилизинг гормона [30] и даназола [31] для лечения АВМ.
Alfei [22] сообщили о пациентке с АВМ матки, которую лечили внутривенно конъюгированными эстрогенами и пероральным малеатом метилэргометрина. Кроме того, имелись сообщения об использовании агониста гонадотропин-рилизинг гормона [30] и даназола [31] для лечения АВМ.
Эмболизация маточных артерий (ЭМА) является предпочтительным видом лечения при мальформациях матки, особенно у молодых женщин, которые хотят сохранить фертильность. О первой процедуре ЭМА сообщили L. Forssman и соавт. [32], и впоследствии этот метод получил широкое распространение.
W. Poppe и соавт. [33] задокументировали нормальное течение беременности у пациентки, ранее перенесшей ЭМА. P. O’Brien и соавт. [3] сообщили, что нормальный менструальный цикл возобновился через 2 мес у всех 11 женщин после эмболизации, и 5 из них впоследствии забеременели.
Y. Zhu и соавт. [23] также высказали мнение, что ЭМА не ухудшает фертильность. Были обследованы 62 пациентки в период с 1-го января 2004 г. по 31-е января 2017 г. Всем была выполнена ангиография и подтверждена мальформация. Согласно полученным результатам разрешение АВМ матки после первой процедуры эмболизации маточных артерий произошло в 71% наблюдений (44 из 62). У 18 (29%) из 62 пациенток наблюдались рецидивы маточного кровотечения, в связи с чем была выполнена повторная ЭМА в усредненный временной интервал — через 4 мес. Еще одной (1,6%) пациентке потребовалась третья эмболизация, и еще одна (1,6%) нуждалась в четвертой эмболизации с целью купирования кровотечения.
по 31-е января 2017 г. Всем была выполнена ангиография и подтверждена мальформация. Согласно полученным результатам разрешение АВМ матки после первой процедуры эмболизации маточных артерий произошло в 71% наблюдений (44 из 62). У 18 (29%) из 62 пациенток наблюдались рецидивы маточного кровотечения, в связи с чем была выполнена повторная ЭМА в усредненный временной интервал — через 4 мес. Еще одной (1,6%) пациентке потребовалась третья эмболизация, и еще одна (1,6%) нуждалась в четвертой эмболизации с целью купирования кровотечения.
В итоге у 10 пациенток были успешные беременности после первой или второй эмболизации. Рождены 9 здоровых детей, 7 из них — путем кесарева сечения, 2 — в результате естественных родов. Одна пациентка на момент завершения исследования находилась на 8-й неделе беременности. У некоторых пациенток уже была выполнена репродуктивная функция, и они выбрали контрацепцию; вполне возможно, что поэтому способность к деторождению сохранялась у большего числа обследуемых. Средний интервал между проведением эмболизации и наступлением беременности составил 26,5 мес (диапазон 13—60 мес).
Средний интервал между проведением эмболизации и наступлением беременности составил 26,5 мес (диапазон 13—60 мес).
Авторами сделан вывод, что эмболизация маточных артерий — это безопасный и эффективный метод лечения пациенток с АВМ матки, который следует использовать в качестве начальной и основной терапии для женщин детородного возраста, желающих сохранить фертильность.
Другие хирургические методы лечения при мальформации матки, о которых в литературе сообщается менее часто, включают коагуляцию АВМ под гистероскопическим контролем, хирургическое удаление АВМ матки, лапароскопическую биполярную коагуляцию маточных сосудов [34], перевязку маточных артерий [35]. В настоящее время гистерэктомия показана только тем женщинам, которые не нуждаются в сохранении фертильности и имеют ограниченный доступ к медицинским учреждениям [36].
По результатам исследований, большая часть АВМ матки разрешается самостоятельно, без медикаментозного и хирургического лечения [19, 23, 37, 38].
D. Timmerman и соавт. [19] показали, что с помощью измерения пикового систолического кровотока матки мальформации можно подразделять на безопасные и потенциально опасные. Так, сосудистые мальформации со значением ПСК ≥0,83 м/с были расценены как потенциально опасные, ПСК <0,83 м/с — как менее опасные, а ПСК <0,39 м/с — как безопасные. В исследование были включены 30 пациенток с АВМ матки. С помощью ЦДК и допплерометрии выявлен низко- и высокоскоростной кровотоки. Средние значения для ПИ, ИР, ПСК и усредненной по времени максимальной скорости составили 0,50, 0,38, 0,63 и 0,46 м/с соответственно. Более чем в 2/3 наблюдений в данном исследовании осуществлено консервативное ведение АВМ. У 8 (27%) пациенток в конечном итоге была выполнена ЭМА. Значения ПСК 0,83 м/с или больше были связаны с более высокой вероятностью такого дальнейшего лечения, как ЭМА, в то время как мальформации с ПСК <0,39 м/с не требовали эмболизации.
Таким образом, авторы предложили консервативное лечение всем пациенткам с допплеровскими показателями в предполагаемой «безопасной» зоне.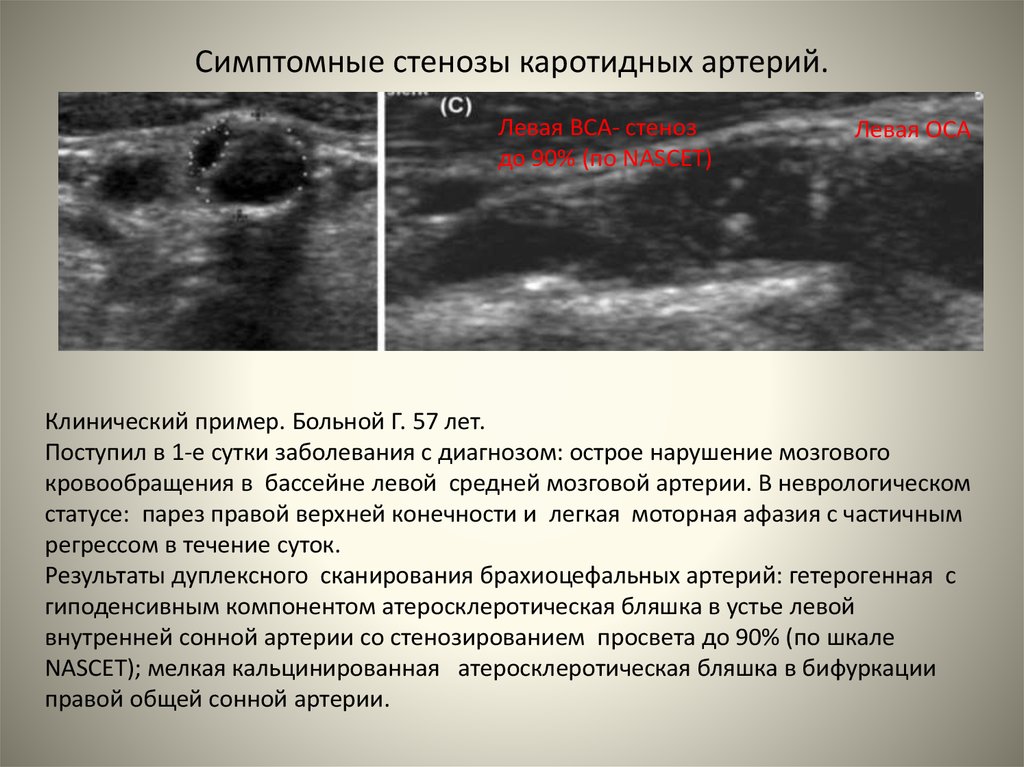 АВМ со значениями ПСК менее 0,83 м/с и более 0,39 м/с, по мнению авторов, должны быть помечены как «потенциально опасные». Пациентки должны быть проинформированы о том, что делать в случае выраженного кровотечения. Например, может быть рекомендовано временно не выезжать в районы без высокоспециализированных лечебных учреждений, поскольку сильное кровотечение, требующее быстрого вмешательства и/или переливания крови, может начаться внезапно.
АВМ со значениями ПСК менее 0,83 м/с и более 0,39 м/с, по мнению авторов, должны быть помечены как «потенциально опасные». Пациентки должны быть проинформированы о том, что делать в случае выраженного кровотечения. Например, может быть рекомендовано временно не выезжать в районы без высокоспециализированных лечебных учреждений, поскольку сильное кровотечение, требующее быстрого вмешательства и/или переливания крови, может начаться внезапно.
Однако авторы отмечают, что эти значения должны интерпретироваться с осторожностью. У 5 пациенток без выраженного кровотечения были выявлены сосудистые мальформации с высокими значениями ПСК, которые затем разрешались спонтанно без какой-либо терапии.
I. Timor-Tritsch и соавт. [14] поставили целью своего исследования оценить роль трансвагинального УЗИ в диагностике и лечении приобретенной АВМ матки. Диагностическим критерием была визуализация выраженной сосудистой сети в миометрии с ПСК ≥20 см/с. Авторы использовали узкое пробное окно (2 мм) и измерения проводили на 5—10 различных участках внутри мальформации, учитывая разнокалиберный характер сосудов внутри патологического очага с разной ПСК в них. В исследование включалось самое высокое значение систолической скорости кровотока. Обследованы 27 пациенток с АВМ матки. Ультразвуковое сканирование проводилось каждые 2 нед до разрешения мальформации. Лечение было разнообразным и включало только выжидательный метод у 48% (n=13/27) пациенток с эпизодическим ультразвуковым сканированием и определением сывороточного хорионического гонадотропина до разрешения, ЭМА у 29,6% (n=8/27), введение метотрексата у 22,2% (6/27), гистерэктомию у 7,4% (2/27) и выскабливание стенок полости матки у 3,7% (1/27). Для пациенток с выжидательной тактикой ведения интервал времени от инициирующего фактора (в данном исследовании — это искусственные и самопроизвольные аборты, кесарево сечение, пузырный занос) до диагностики АВМ составлял 2—10 нед (в среднем 5,5 нед), от диагностики мальформации до разрешения при УЗИ, определяемого как ПСК меньше 10 cм/с, — 2—8 нед (в среднем 4,5 нед). Время от завершения беременности до разрешения АВМ составляло 2—15 нед.
В исследование включалось самое высокое значение систолической скорости кровотока. Обследованы 27 пациенток с АВМ матки. Ультразвуковое сканирование проводилось каждые 2 нед до разрешения мальформации. Лечение было разнообразным и включало только выжидательный метод у 48% (n=13/27) пациенток с эпизодическим ультразвуковым сканированием и определением сывороточного хорионического гонадотропина до разрешения, ЭМА у 29,6% (n=8/27), введение метотрексата у 22,2% (6/27), гистерэктомию у 7,4% (2/27) и выскабливание стенок полости матки у 3,7% (1/27). Для пациенток с выжидательной тактикой ведения интервал времени от инициирующего фактора (в данном исследовании — это искусственные и самопроизвольные аборты, кесарево сечение, пузырный занос) до диагностики АВМ составлял 2—10 нед (в среднем 5,5 нед), от диагностики мальформации до разрешения при УЗИ, определяемого как ПСК меньше 10 cм/с, — 2—8 нед (в среднем 4,5 нед). Время от завершения беременности до разрешения АВМ составляло 2—15 нед. ПСК у 18 пациенток, не подвергшихся ЭМА, составил 59,5 см/с. У пациенток, которым была выполнена эмболизация, ПСК составил 85,2 см/с. У 7 из 8 пациенток, пролеченных методом ЭМА, мальформация разрешилась.
ПСК у 18 пациенток, не подвергшихся ЭМА, составил 59,5 см/с. У пациенток, которым была выполнена эмболизация, ПСК составил 85,2 см/с. У 7 из 8 пациенток, пролеченных методом ЭМА, мальформация разрешилась.
Из вышесказанного авторы заключают, что в большинстве случаев АВМ разрешаются спонтанно. Некоторые из них могут потребовать лечения, такого как эмболизация маточных артерий или гистерэктомия.
АВМ чаще наблюдается у женщин репродуктивного возраста с фактом беременности в анамнезе [14].
Следует соблюдать осторожность при диагностике АВМ матки и задержке плацентарной ткани, остатков плодного яйца (в иностранной литературе обозначаемых как products of conception — POC). Сохраняющиеся POC могут приводить к появлению гиперваскулярных образований с турбулентным течением на цветовых допплеровских изображениях не только в полости эндометрия, но и в субэндометриальной области, и в миометрии. Наличие трофобластической ткани в миометрии или субэндометриальной области может быть объяснено вторжением плацентарной ткани в эти зоны через поврежденный эндометрий во время выскабливания [6].
Ряд авторов считают, что ангиография в данном случае должна рассматриваться как «золотой стандарт» диагностики [39, 40].
A. Kamaya и соавт. [41] оценили васкуляризацию при присутствующих в полости матки POC. Остатки плодного яйца без васкуляризации были отнесены к типу 0; минимальная васкуляризация — к 1-му типу; умеренная васкуляризация расценивалась как 2-й тип, а выраженная васкуляризация — как 3-й тип. Среди 28 пациенток у 5 (18%) был тип 0; у 6 (21%) — 1-й тип; у 12 (43%) был 2-й тип, а у 5 (18%) — 3-й сосудистый тип. Их средний ПСК был 36,1 см/с с диапазоном 10—108 см/с. Сосудистый тип 0 не исключал наличия остатков, хотя 3-й тип наблюдался только в случаях их выявления. Данное исследование показывает, что АВМ следует диагностировать только в том случае, если исключены остатки плодного яйца.
У D. Timmerman и соавт. [19] другая точка зрения. По их мнению, обнаружение типичного сосудистого образования с высоким ПСК достаточно для установления диагноза с подтверждением наличия POC или без него.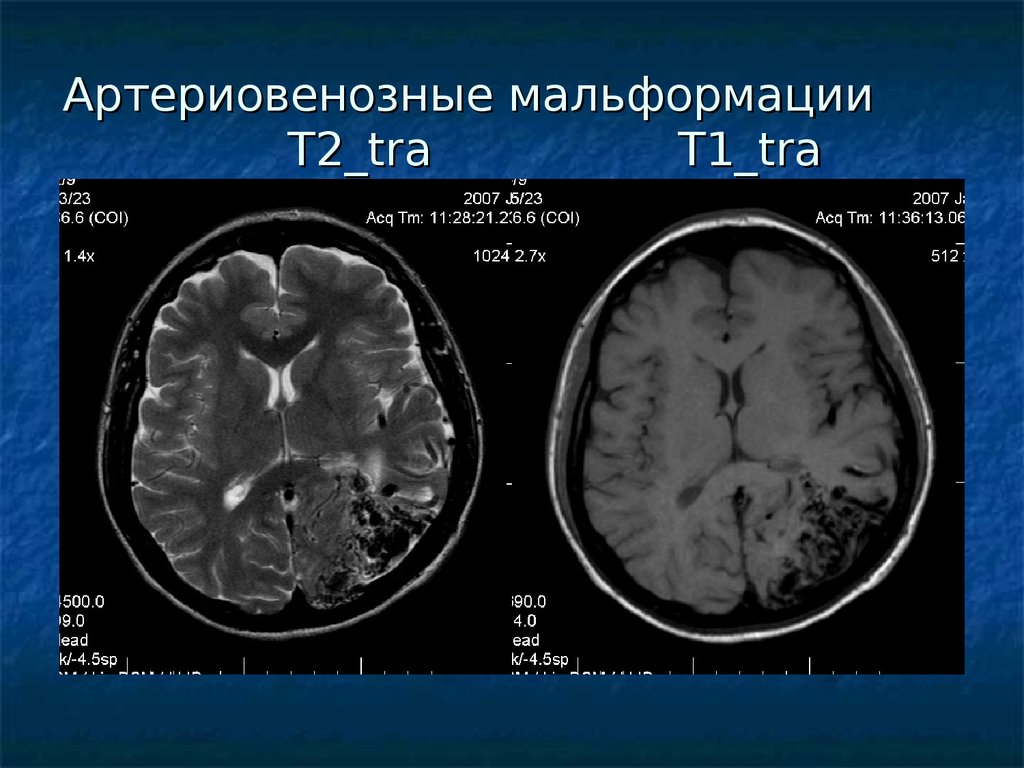 Кроме того, авторы уверены, что остатки могут быть исключены с помощью трансвагинального УЗИ с оценкой толщины, эхогенности эндометрия и применения ЦДК. Авторы считают, что в случае сочетания POC и мальформации перед выполнением эвакуации остатков следует пролечить АВМ путем эмболизации или с помощью консервативной терапии. Тем не менее авторы отмечают, что только рандомизированное исследование у таких пациенток могло бы доказать, что эмболизация до кюретажа лучше, чем только кюретаж с экстренной вторичной эмболизацией в случае необходимости.
Кроме того, авторы уверены, что остатки могут быть исключены с помощью трансвагинального УЗИ с оценкой толщины, эхогенности эндометрия и применения ЦДК. Авторы считают, что в случае сочетания POC и мальформации перед выполнением эвакуации остатков следует пролечить АВМ путем эмболизации или с помощью консервативной терапии. Тем не менее авторы отмечают, что только рандомизированное исследование у таких пациенток могло бы доказать, что эмболизация до кюретажа лучше, чем только кюретаж с экстренной вторичной эмболизацией в случае необходимости.
В исследовании D. Timmerman и соавт. [19] почти все пациентки с диагнозом АВМ матки выявлены в случаях самопроизвольных абортов (чаще всего с последующим кюретажем), искусственных абортов, кесарева сечения, пузырного заноса. При этом более чем в 2/3 наблюдений имелось спонтанное разрешение. В связи с этим авторы делают выводы, что многие случаи мальформаций матки представляют собой субинволюцию плацентарного русла, которая характеризуется отсутствием облитерации кровеносных сосудов после аборта или родов.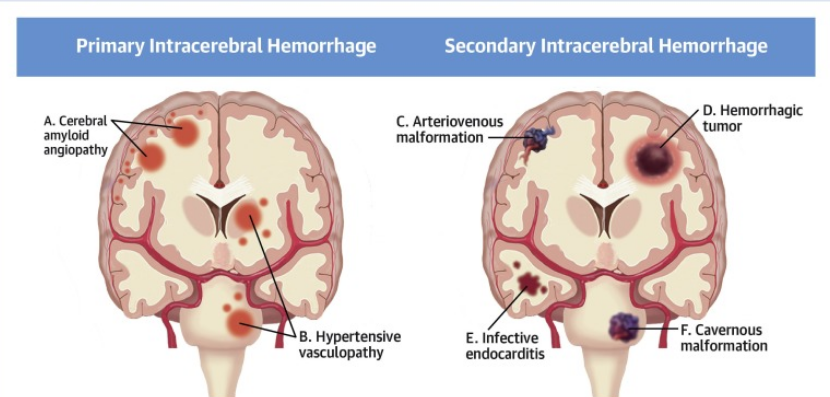 Ранее авторы оценивали васкуляризацию миометрия в исследованиях нормальной послеродовой матки [42, 43]. В исследование были включены 93 пациентки после родов, которым были выполнены УЗИ с ЦДК на 3-й день и через 6 нед после неосложненных родов. Была проведена допплерометрия в областях усиленной васкуляризации миометрия и обеих маточных артериях. Зоны усиленного кровотока визуализировались у 50,5% пациенток на 3-й день и у 3,9% через 6 нед после родов. Ни у одной пациентки не было патологического кровотечения и необходимости в лечении. Таким образом, по мнению авторов, большинство случаев усиленной васкуляризации после родов являются промежуточными стадиями инволюции плацентарного русла и не вызывают аномальной послеродовой кровопотери. Такие сосудистые эффекты распространены в послеродовом периоде, в большинстве случаев исчезают самопроизвольно и не требуют терапии.
Ранее авторы оценивали васкуляризацию миометрия в исследованиях нормальной послеродовой матки [42, 43]. В исследование были включены 93 пациентки после родов, которым были выполнены УЗИ с ЦДК на 3-й день и через 6 нед после неосложненных родов. Была проведена допплерометрия в областях усиленной васкуляризации миометрия и обеих маточных артериях. Зоны усиленного кровотока визуализировались у 50,5% пациенток на 3-й день и у 3,9% через 6 нед после родов. Ни у одной пациентки не было патологического кровотечения и необходимости в лечении. Таким образом, по мнению авторов, большинство случаев усиленной васкуляризации после родов являются промежуточными стадиями инволюции плацентарного русла и не вызывают аномальной послеродовой кровопотери. Такие сосудистые эффекты распространены в послеродовом периоде, в большинстве случаев исчезают самопроизвольно и не требуют терапии.
Кроме того, есть особенности диагностики АВМ после абортов, и в таких случаях необходимо учитывать некоторые моменты. При нормальной беременности из-за расширения сосудов и снижения сопротивления в спиральных артериях наблюдается гиперваскуляризация с турбулентным кровотоком (которое также называют перитрофобластическим кровотоком), особенно в той части миометрия, где произошла имплантация [44]. Подобные сосудистые эффекты миометрия также можно наблюдать при очень раннем сроке гестации, до появления видимого на УЗИ плодного яйца или после недавнего самопроизвольного или искусственного аборта без остатков плодового яйца в полости матки. Гиперваскулярность и турбулентность в миометрии во время беременности не исчезают сразу после самопроизвольного или искусственного аборта [45]. Гиперваскулярность постепенно регрессирует и затем исчезает в течение нескольких дней. Этот период регрессии продлевается в присутствии оставшихся POC или пузырного заноса [46].
При нормальной беременности из-за расширения сосудов и снижения сопротивления в спиральных артериях наблюдается гиперваскуляризация с турбулентным кровотоком (которое также называют перитрофобластическим кровотоком), особенно в той части миометрия, где произошла имплантация [44]. Подобные сосудистые эффекты миометрия также можно наблюдать при очень раннем сроке гестации, до появления видимого на УЗИ плодного яйца или после недавнего самопроизвольного или искусственного аборта без остатков плодового яйца в полости матки. Гиперваскулярность и турбулентность в миометрии во время беременности не исчезают сразу после самопроизвольного или искусственного аборта [45]. Гиперваскулярность постепенно регрессирует и затем исчезает в течение нескольких дней. Этот период регрессии продлевается в присутствии оставшихся POC или пузырного заноса [46].
В исследовании, проведенном E. Wiebe и P. Switzer [47], мальформация матки была диагностирована на основе данных B-режима и цветового допплера у 7 пациенток с длительным кровотечением после медицинского аборта, которым выжидательно еженедельно проводился мониторинг уровней ХГЧ в сыворотке крови. Интересно отметить, что уровень ХГЧ был повышен во всех случаях, что, возможно, связано с наличием остаточной трофобластической ткани в матке. Когда уровни ХГЧ вернулись к норме, все сосудистые образования матки исчезли спонтанно. Ни у одной из женщин остатков плодного яйца выявлено не было.
Интересно отметить, что уровень ХГЧ был повышен во всех случаях, что, возможно, связано с наличием остаточной трофобластической ткани в матке. Когда уровни ХГЧ вернулись к норме, все сосудистые образования матки исчезли спонтанно. Ни у одной из женщин остатков плодного яйца выявлено не было.
S. Rufener и соавт. [48] провели сонографическую оценку послеродовых и послеабортных поражений матки, которые были расценены как АВМ. Их работа показала, что в итоге при морфологическом исследовании ни в одном из наблюдений диагноз АВМ не подтвердился. Окончательный диагноз звучал как остатки POC (n=26), полип эндометрия (n=1), хронический эндометрит (n=1).
Заключение
Таким образом, благодаря современному ультразвуковому оборудованию и высокой квалификации специалистов, АВМ матки можно выявить уже на первом этапе обследования пациенток. В связи с этим сосудистые поражения матки в настоящее время диагностируются чаще, чем считалось ранее. Пациентки с меноррагией и отсроченным вторичным кровотечением после хирургического вмешательства, после родов или аборта должны быть обследованы для выявления возможных АВМ. Мальформацию необходимо исключить до выполнения кюретажа или аспирации.
Пациентки с меноррагией и отсроченным вторичным кровотечением после хирургического вмешательства, после родов или аборта должны быть обследованы для выявления возможных АВМ. Мальформацию необходимо исключить до выполнения кюретажа или аспирации.
Интерпретация характерного ультразвукового изображения АВМ в В-режиме должна проводиться с учетом допплерометрических показателей (ПСК, индексы сопротивления), клинических проявлений, гемодинамического статуса. Такой подход позволяет выделять пациенток с различными уровнями риска и выбирать соответствующее лечение [19]. Если гемодинамика пациентки стабильна, то консервативное ведение следует рассматривать в качестве основного метода, поскольку большинство мальформаций имеет тенденцию к самопроизвольному разрешению [49].
Необходимо соблюдать осторожность при диагностике АВМ после родов или аборта: у всех пациенток должна быть оценена вероятность задержки плацентарной ткани или остатков плодного яйца при динамическом измерении уровней β-ХГЧ. Это позволяет избежать необходимости подвергать пациенток ненужной инвазивной ангиографии и ЭМА. Методом выбора хирургического способа лечения мальформаций, по данным литературы, является эмболизация маточных артерий. Этот метод позволяет предотвратить потенциально опасное для жизни кровотечение и сохранить фертильность.
Это позволяет избежать необходимости подвергать пациенток ненужной инвазивной ангиографии и ЭМА. Методом выбора хирургического способа лечения мальформаций, по данным литературы, является эмболизация маточных артерий. Этот метод позволяет предотвратить потенциально опасное для жизни кровотечение и сохранить фертильность.
Участие авторов:
Концепция и дизайн исследования — М.А. Чечнева, Т.А. Марьянова
Сбор и обработка материала — Т.А. Марьянова
Написание текста — М.А. Чечнева, Т.А. Марьянова
Редактирование — С.Н. Буянова
Авторы заявляют об отсутствии конфликта интересов.
Participation of authors:
Concept and design of the study — M.A. Chechneva, T.A. Mar´yanova
Data collection and processing — T.A. Mar´yanova
Text writing — M.A. Chechneva, T. A. Mar´yanova
A. Mar´yanova
Editing — S.N. Buyanova
Authors declare lack of the conflicts of interests.
#БудниГКБ15 ТОЧНЫЙ ДИАГНОЗ И ОРГАНОСОХРАНЯЮЩЕЕ ЛЕЧЕНИЕ -Наши новости
Справочные телефоныОбратная связь
RU
EN
ES
- RU
- EN
- ES
Городская клиническая больница №15 им О.М. Филатова
Департамент здравоохранения города Москвы
«Ваше здоровье – наш ежедневный труд»
ГКБ №15
-
Клиника-
Новости- Наши новости
- Интересный медицинский случай
- Важные объявления
- СМИ о нас
- Питание
- Филатовский вестник
- О нас
- ГКБ №15 – 40 лет
- Руководство
- Фотогалерея
- Отзывы и благодарности
- Вопрос-ответ
- Вакансии
- Нормативная база
- Научная база
- Вышестоящие организации
- Молодежный совет
-
-
Отделения- Стационарные отделения
- Служба крови
- Роддом на Вешняковской
- Роддом на Самаркандском бульваре
- Женская консультация
- Консультативно-диагностический центр
- Лаборатории, параклиники
- Межокружное отделение рассеянного склероза (МОРС)
- Патологоанатомическое отделение
- Специалисты
- Правила внутреннего трудового распорядка и Положение о защите персональных данных
- Стационары кратковременного пребывания
-
Посетителям-
Полезная информация- Полезная информация о правильном питании
- Подарочные комплекты детских принадлежностей
- Календарь беременности
- Лекарственное обеспечение
- Методические рекомендации для молодых родителей
- Памятка для пациентов при пожаре
- Факторы риска неинфекционных заболеваний
- Правила госпитализации
- Проект «Москва – столица здоровья»
- Порядок подготовки к диагностическим исследованиям
- Порядок оказания высокотехнологичной медицинской помощи
- Программа госгарантий в рамках ОМС
- Сотрудничество со страховыми организациями по ОМС и ДМС
- Правила внутреннего распорядка
- Памятка для посетителей отделений реанимации и анестезиологии
- Независимая оценка качества оказания услуг
- Правила въезда и парковки
- Противодействие коррупции
-
- Работникам
- Международный медицинский туризм
- Контакты
-
Платные услуги
- Об отделении
- Консультативно-диагностический центр
- Стационар
- Женские консультации
- Роддом
- Добровольное медицинское страхование
- Прейскурант
© ГКБ № 15 им. О. М. Филатова
О. М. Филатова
Все права защищены
Главная → Наши новости → #БудниГКБ15 ТОЧНЫЙ ДИАГНОЗ И ОРГАНОСОХРАНЯЮЩЕЕ ЛЕЧЕНИЕ
#БудниГКБ15 ТОЧНЫЙ ДИАГНОЗ И ОРГАНОСОХРАНЯЮЩЕЕ ЛЕЧЕНИЕ
Артериовенозная мальформация матки (АВМ) является редким, потенциально опасным для жизни пациенток состоянием. АВМ — это дисплазия сосудов в виде «переплетения» маточных вен с ветвями артерий разного калибра. Часто клинически проявляется аномальным маточным кровотечением. Но диагностировать такую патологию достаточно трудно. Для этого нужно не только современное ультразвуковое оборудование, но и хорошая подготовка специалистов по функциональной диагностике.
В Городскую клиническую больницу № 15 имени О.М. Филатова во 2 гинекологическое отделение поступила пациентка Г., 23 лет с жалобами на обильное маточное кровотечение. Чтобы остановить его, гинекологи провели раздельное выскабливание слизистой оболочки матки. Тем не менее, кровотечение продолжалось. Поэтому провели гистероскопии: первая — патологии в полости матки и цервикальном канале не выявила. Повторная все-таки обнаружила участок с множеством зияющих капилляров с активным кровотечением из них при снижении давления нагнетаемой жидкости. В последующем трансвагинальное УЗИ малого таза и допплеровское картирование за шейкой матки слева обнаружили зону повышенного сосудистого сплетения с расширением вен и артерий. Так был установлен правильный диагноз.
Поэтому провели гистероскопии: первая — патологии в полости матки и цервикальном канале не выявила. Повторная все-таки обнаружила участок с множеством зияющих капилляров с активным кровотечением из них при снижении давления нагнетаемой жидкости. В последующем трансвагинальное УЗИ малого таза и допплеровское картирование за шейкой матки слева обнаружили зону повышенного сосудистого сплетения с расширением вен и артерий. Так был установлен правильный диагноз.
Заведующим отделением рентгенхирургических методов лечения Шухратом Джуракуловым после этого была произведена суперселективная эмболизация афферентных ветвей маточных артерий. После этого кровотечение прекратилось. Органосохраняющее лечение позволило не только сохранить матку, но и менструальную функцию и фертильность молодой женщины.
Диагностика и лечение артериовенозных мальформаций матки и таза
Тазовые и маточные артериовенозные мальформации (АВМ) могут вызывать аномальные и потенциально опасные для жизни вагинальные кровотечения. Хотя они считаются относительно редкими, и в литературе описано менее 150 случаев, истинная частота АВМ матки может быть выше. Проспективное исследование 959 пациенток выявило сонографически очевидные АВМ матки у 5,2% женщин после дилатации и выскабливания и у 0,22% женщин после родов; однако только одна (0,1%) АВМ в исследуемой популяции была признана клинически значимой. 1 Тазовые АВМ и маточные АВМ являются отдельными образованиями с разной этиологией, проявлениями и лечением.
Хотя они считаются относительно редкими, и в литературе описано менее 150 случаев, истинная частота АВМ матки может быть выше. Проспективное исследование 959 пациенток выявило сонографически очевидные АВМ матки у 5,2% женщин после дилатации и выскабливания и у 0,22% женщин после родов; однако только одна (0,1%) АВМ в исследуемой популяции была признана клинически значимой. 1 Тазовые АВМ и маточные АВМ являются отдельными образованиями с разной этиологией, проявлениями и лечением.
ЭТИОЛОГИЯ
Как тазовые, так и маточные АВМ возникают в результате одного или нескольких участков аномального прямого сообщения между артерией и веной без промежуточного капиллярного русла. Последующее отклонение кровотока по градиенту давления в венозную систему приводит к повышению давления и высокой скорости потока, а также к заметному расширению сосудов в венозной системе. Тазовые АВМ обычно представляют собой спорадические врожденные аномалии. Как и при АВМ, возникающих в других частях тела, артериовенозные сообщения при тазовых АВМ могут сильно различаться по размеру, количеству и местоположению. Считается, что эти аномалии развития являются результатом аномальной пролиферации эндотелиальных клеток и замедленного ремоделирования сосудов во время ангиогенеза плода. 2 Приобретенные тазовые артериовенозные сообщения также могут возникать в результате травмы или хирургического вмешательства, хотя они обычно называются фистулами и часто бывают проще, с меньшим количеством артериовенозных сообщений, чем при врожденных пороках развития.
Считается, что эти аномалии развития являются результатом аномальной пролиферации эндотелиальных клеток и замедленного ремоделирования сосудов во время ангиогенеза плода. 2 Приобретенные тазовые артериовенозные сообщения также могут возникать в результате травмы или хирургического вмешательства, хотя они обычно называются фистулами и часто бывают проще, с меньшим количеством артериовенозных сообщений, чем при врожденных пороках развития.
Хотя тазовые АВМ могут распространяться на матку, их следует отличать от маточных АВМ, при которых артериовенозные сообщения существуют полностью внутри матки. Считается, что большинство АВМ матки являются приобретенными и могут быть более точно названы свищами, а не истинными пороками развития. Эти приобретенные АВМ матки часто демонстрируют более сложные и многочисленные артериовенозные сообщения, чем типичные артериовенозные свищи, и больше похожи на врожденные АВМ, что может быть связано с богатой васкуляризацией и густой сетью анастомозов внутри матки.
Факторов риска для приобретенных АВМ матки множество, и они охватывают почти всю патофизиологию матки, а также нормальные физиологические изменения во время беременности. АВМ матки были описаны после нормально протекающей беременности, инструментария матки (дилатация и выскабливание, другие операции), гестационного трофобластического заболевания и рака матки и шейки матки. Воздействие диэтилстильбестрола на матерей было связано с развитием цервикальных АВМ у подвергшихся воздействию потомства. 3
КЛИНИЧЕСКАЯ КАРТИНА
Большинство симптоматических АВМ таза и матки проявляются аномальными вагинальными кровотечениями, варьирующими от частых мажущих выделений до катастрофических кровотечений; меноррагия, метроррагия, менометроррагия и посткоитальное кровотечение были описаны как симптомы. Тазовая боль или давление, в том числе невропатическая боль, такая как ишиас, также могут быть симптомом. Тазовые АВМ могут проявляться другими признаками повышенного венозного давления, такими как варикозное расширение вен вульвы или, в тяжелых случаях, венозный застой нижних конечностей. Сообщалось о гематурии, затрудненном мочеиспускании и гемоспермии как о симптомах у пациентов мужского пола с АВМ таза. 4 Шунты слева направо с высоким потоком также являются известной причиной сердечной недостаточности с высоким выбросом.
Сообщалось о гематурии, затрудненном мочеиспускании и гемоспермии как о симптомах у пациентов мужского пола с АВМ таза. 4 Шунты слева направо с высоким потоком также являются известной причиной сердечной недостаточности с высоким выбросом.
Все большее число бессимптомных АВМ матки и таза диагностируется случайно по мере роста использования методов визуализации.
Рис. 1. Цветная допплерография матки в сагиттальном направлении, демонстрирующая заметное увеличение кровотока с наложением изображений, преимущественно в миометрии.
ВИЗУАЛИЗАЦИЯ
УЗИ органов малого таза часто является первоначальным скрининговым исследованием, которое проводится при подозрении на АВМ малого таза или матки и должно включать использование цветного допплера с измерением скорости потока. Сонографические данные в оттенках серого могут быть неспецифическими и могут включать утолщение и неоднородность миометрия, интрамуральное или эндометриальное образование, трубчатые пространства в стенке матки и расширенные параметральные сосуды. Цветную доплеровскую оценку следует использовать для документирования наличия множественных расширенных сосудов матки и/или таза с интенсивным сигналом, наложением изображений и видимым изменением направления потока, указывающим на турбулентный высокоскоростной поток (рис. 1). Спектральная допплерография, демонстрирующая повышенную скорость кровотока в сосудах с низким сопротивлением, указывает на наличие артериовенозного сообщения. Индексы сопротивления часто будут между 0,25 и 0,55. 5
Цветную доплеровскую оценку следует использовать для документирования наличия множественных расширенных сосудов матки и/или таза с интенсивным сигналом, наложением изображений и видимым изменением направления потока, указывающим на турбулентный высокоскоростной поток (рис. 1). Спектральная допплерография, демонстрирующая повышенную скорость кровотока в сосудах с низким сопротивлением, указывает на наличие артериовенозного сообщения. Индексы сопротивления часто будут между 0,25 и 0,55. 5
Пиковая систолическая скорость (ПСС) внутри АВМ может помочь предсказать ее естественное течение и, таким образом, определить тактику лечения. PSV ≤ 40 см/с идентифицирует АВМ, которые могут регрессировать без вмешательства и могут лечиться выжидательно с периодическим сонографическим контролем у пациентов со стабильным гемоглобином. PSV > 60 см/с указывает на более опасную АВМ с низкой вероятностью спонтанной регрессии и потенциальным риском значительного кровотечения даже у стабильного в настоящее время пациента; эти высокоскоростные АВМ следует лечить оперативно. АВМ с ПСВ от 40 до 60 см/с можно лечить с помощью ультразвукового наблюдения с короткими интервалами у пациентов без чрезмерного кровотечения, поскольку они могут регрессировать или сохраняться. 6
АВМ с ПСВ от 40 до 60 см/с можно лечить с помощью ультразвукового наблюдения с короткими интервалами у пациентов без чрезмерного кровотечения, поскольку они могут регрессировать или сохраняться. 6
Рис. 2. Коронарное проекционное изображение максимальной интенсивности, полученное при динамической МРА с контрастным усилением, демонстрирующее раннее заполнение многочисленных расширенных вен в матке и тазу с первичным дренированием через расширенную левую яичниковую вену в левую почечную вену.
КТ или МРТ можно использовать для лучшего определения анатомии АВМ малого таза или матки, выявления пораженных органов и структур, а также помощи в предоперационном планировании. Типичные признаки включают увеличение матки с очаговой массой или без нее, нарушение зон соединения матки на МРТ и многочисленные увеличенные сосуды миометрия и параметрия. Раннее заполнение этих расширенных венозных структур за счет быстрого артериального шунтирования является характерной чертой АВМ. Хотя эти патологические изменения в динамике кровотока могут быть идентифицированы при КТА с оптимальным болюсным введением и синхронизацией сканирования, они могут быть более последовательно зафиксированы при динамической МРА с контрастным усилением (рис. 2). Другие преимущества МРТ включают лучшую характеристику органов малого таза и отсутствие ионизирующего излучения; последнее может представлять особый интерес для женщин репродуктивного возраста. По этим причинам динамическая МРА с контрастным усилением может быть предпочтительным методом визуализации для поперечного изображения АВМ таза и матки. Лучшее пространственное разрешение КТ может помочь в локализации и характеристике артериовенозных коммуникаций, если МРТ не дает адекватных характеристик.
Хотя эти патологические изменения в динамике кровотока могут быть идентифицированы при КТА с оптимальным болюсным введением и синхронизацией сканирования, они могут быть более последовательно зафиксированы при динамической МРА с контрастным усилением (рис. 2). Другие преимущества МРТ включают лучшую характеристику органов малого таза и отсутствие ионизирующего излучения; последнее может представлять особый интерес для женщин репродуктивного возраста. По этим причинам динамическая МРА с контрастным усилением может быть предпочтительным методом визуализации для поперечного изображения АВМ таза и матки. Лучшее пространственное разрешение КТ может помочь в локализации и характеристике артериовенозных коммуникаций, если МРТ не дает адекватных характеристик.
Цифровая субтракционная ангиография (ЦСА) остается золотым стандартом диагностики АВМ матки и таза. Диагностический DSA необходим для планирования лечения и обеспечивает непревзойденный уровень детализации при выявлении и локализации артериовенозных коммуникаций. Определяющей чертой АВМ на DSA является быстрое раннее заполнение многочисленных расширенных вен, выходящих из очага или гнезда аномальных сосудов после артериальной инъекции контраста (рис. 3 и рис. 4). Благодаря достижениям в области неинвазивной визуализации многие интервенционисты используют эти визуализирующие исследования для большей части предоперационного планирования и выполняют начальную диагностическую DSA для подтверждения и уточнения плана лечения в рамках той же процедуры, что и запланированная эндоваскулярная терапия. Тем не менее, неинвазивная визуализация не всегда дает адекватную информацию для планирования этих сложных методов лечения; в этих случаях диагностический DSA может быть выполнен до дня лечения.
Определяющей чертой АВМ на DSA является быстрое раннее заполнение многочисленных расширенных вен, выходящих из очага или гнезда аномальных сосудов после артериальной инъекции контраста (рис. 3 и рис. 4). Благодаря достижениям в области неинвазивной визуализации многие интервенционисты используют эти визуализирующие исследования для большей части предоперационного планирования и выполняют начальную диагностическую DSA для подтверждения и уточнения плана лечения в рамках той же процедуры, что и запланированная эндоваскулярная терапия. Тем не менее, неинвазивная визуализация не всегда дает адекватную информацию для планирования этих сложных методов лечения; в этих случаях диагностический DSA может быть выполнен до дня лечения.
Рисунок 3. Тазовая артериограмма, демонстрирующая расширенную правую маточную артерию с правосторонним маточным очагом, что предполагает раннее венозное наполнение. Расширение артерий связано с повышенным потоком через этот сосуд в отстойник низкого давления артериовенозного сообщения (А). Немного задержанное изображение той же тазовой артериограммы, подтверждающее ранний венозный отток из правой части матки через правую внутреннюю подвздошную и правую яичниковую вены (В).
Немного задержанное изображение той же тазовой артериограммы, подтверждающее ранний венозный отток из правой части матки через правую внутреннюю подвздошную и правую яичниковую вены (В).
Рис. 4. Ангиограмма после инъекции правой внутренней подвздошной артерии демонстрирует одновременное помутнение контрастом дистальных внутриматочных артериальных ветвей и расширенных дренирующих вен, что указывает на активное артериовенозное шунтирование.
ВАРИАНТЫ ЛЕЧЕНИЯ И РЕЗУЛЬТАТЫ
Эндоваскулярное лечение
Несмотря на то, что в настоящее время эмболизация матки чаще используется для лечения симптоматической миомы матки, она впервые была описана как метод лечения АВМ матки. 7 Forssman и соавт. описали введение Gelfoam (Pfizer, Inc.) в маточную артерию через лапаротомию, после чего пациентка, получавшая лечение, забеременела и успешно родила здорового ребенка. 7 Согласно литературным данным, чрескатетерная эмболизация имеет высокие показатели успеха при лечении АВМ таза и матки. Одна серия из 42 пациенток, которым была выполнена эмболизация гелем пены по поводу постакушерских АВМ матки, продемонстрировала успешное окончательное эндоваскулярное лечение у 88% пациенток, а оставшимся 12% потребовалась гистерэктомия; 13 из этих пациенток забеременели, что привело к 80% успешных родов с восемью срочными родами, двумя самопроизвольными абортами и тремя плановыми прерываниями беременности. 8 Другое исследование 15 пациенток с АВМ матки продемонстрировало эффективность эндоваскулярного лечения в 93% случаев, при этом только одной пациентке потребовалась гистерэктомия. Эмболизация проводилась с использованием Gelfoam, клея, поливинилового спирта (ПВС), спиралей и комбинации этих эмболизирующих агентов, и шести пациентам потребовалось более одной процедуры эмболизации. 9 Систематический обзор 40 исследований, включавших 54 пациента с приобретенными АВМ матки, перенесших транскатетерную эмболизацию, показал первичный успех в 61% и вторичный показатель успеха в 91%.
Одна серия из 42 пациенток, которым была выполнена эмболизация гелем пены по поводу постакушерских АВМ матки, продемонстрировала успешное окончательное эндоваскулярное лечение у 88% пациенток, а оставшимся 12% потребовалась гистерэктомия; 13 из этих пациенток забеременели, что привело к 80% успешных родов с восемью срочными родами, двумя самопроизвольными абортами и тремя плановыми прерываниями беременности. 8 Другое исследование 15 пациенток с АВМ матки продемонстрировало эффективность эндоваскулярного лечения в 93% случаев, при этом только одной пациентке потребовалась гистерэктомия. Эмболизация проводилась с использованием Gelfoam, клея, поливинилового спирта (ПВС), спиралей и комбинации этих эмболизирующих агентов, и шести пациентам потребовалось более одной процедуры эмболизации. 9 Систематический обзор 40 исследований, включавших 54 пациента с приобретенными АВМ матки, перенесших транскатетерную эмболизацию, показал первичный успех в 61% и вторичный показатель успеха в 91%. 10
10
Рис. 5. Тазовая артериограмма после эмболизации демонстрирует отсутствие остаточного артериовенозного шунтирования или гиперваскуляризации правой матки с н-бутилцианоакрилатным клеем, формирующим ветви правой маточной артерии, и постоянный кровоток в матку через другие ветви правой маточной артерии и левую маточную артерию.
Учитывая высокие показатели клинического успеха, эндоваскулярная терапия часто является рекомендуемой начальной терапией АВМ матки и таза, требующих лечения. Успешно использовались различные эмболизирующие агенты, в том числе ПВС и другие эмболизирующие агенты в виде частиц, жидкие эмболизирующие агенты, включая н-бутилцианоакрилатный клей и Onyx (Medtronic), Gelfoam и катушки, и они часто используются в комбинации. Также было описано успешное использование этанола, либо отдельно, либо в сочетании с эмболическими агентами; однако это более точно называется склерозантом, чем эмболическим агентом. Целью эмболизации обычно является устранение аномальных артериовенозных сообщений при сохранении перфузии в матку (рис. 5). Как отмечалось ранее, у многих пациенток после эндоваскулярного лечения АВМ матки и таза сообщалось об успешном наступлении беременности.
5). Как отмечалось ранее, у многих пациенток после эндоваскулярного лечения АВМ матки и таза сообщалось об успешном наступлении беременности.
Методика лечения. Начальное эндоваскулярное лечение АВМ матки чаще всего выполняется через трансартериальный доступ, как правило, путем эмболизации ветвей одной или обеих маточных артерий. Одной только трансартериальной эмболизации может быть достаточно для окончательного лечения АВМ, и при необходимости ее можно проводить более одного раза для нацеливания на дополнительные артериальные ветви. Однако в некоторых случаях артериовенозные сообщения не могут быть адекватно перекрыты трансартериальным доступом. Хотя ангиограмма сразу после эмболизации может свидетельствовать об успешном лечении АВМ, она будет сохраняться или появится рецидив, если одно или несколько артериовенозных сообщений останутся открытыми. Постоянный градиент давления приведет к отклонению артериального потока в венозный отстойник с низким давлением даже через мельчайшие коллатеральные сосуды. В этой ситуации может потребоваться другой подход или доступ.
В этой ситуации может потребоваться другой подход или доступ.
Трансвенозная эмболизация или склеротерапия могут быть выполнены через бедренный или яремный доступ. Ретроградный трансвенозный доступ может создавать проблемы при лечении АВМ со стойким высоким потоком. Риски включают нецелевую доставку эмболического материала в легочные артерии и погружение катетера доставки в жидкие эмболизирующие агенты. Очаг или проксимальный венозный отток АВМ также можно пунктировать непосредственно под ультразвуковым контролем чрескожно или трансвагинально с последующей эмболизацией или склеротерапией. Таким образом, этот подход требует осторожного постепенного лечения, особенно во время склеротерапии, чтобы предотвратить повреждение тканей из-за рефлюкса в капиллярное русло. Артериальный доступ для ангиографии рекомендуется даже при трансвенозных и прямых пункционных процедурах, чтобы облегчить оценку анатомии, контролировать ход лечения и определить конечную точку лечения. Начальная трансартериальная эмболизация, чаще всего проводимая в предшествующем лечении, а не одновременно, дает преимущество замедления кровотока и уменьшения размера остаточных артериовенозных сообщений. Это снижает риск осложнений, связанных с высоким потоком (например, нецелевая легочная эмболизация, погружение катетера в жидкий эмболизирующий агент), но увеличивает риск повреждения тканей из-за ретроградного потока лечебного агента. В результате трансартериальная эмболизация остается основой эндоваскулярного лечения первой линии АВМ матки, тогда как трансвенозный и прямой пункционный доступы служат дополнительными мерами при рефрактерных артериовенозных сообщениях.
Это снижает риск осложнений, связанных с высоким потоком (например, нецелевая легочная эмболизация, погружение катетера в жидкий эмболизирующий агент), но увеличивает риск повреждения тканей из-за ретроградного потока лечебного агента. В результате трансартериальная эмболизация остается основой эндоваскулярного лечения первой линии АВМ матки, тогда как трансвенозный и прямой пункционный доступы служат дополнительными мерами при рефрактерных артериовенозных сообщениях.
Хирургическое лечение
Гистерэктомия является радикальной хирургической терапией АВМ матки и может выполняться как в качестве первой линии, так и после неэффективности эмболотерапии; однако это не всегда может быть желательно в качестве лечения первой линии не только из-за ожидаемых недостатков более инвазивной процедуры, но и из-за желания многих пациентов сохранить фертильность. В одной большой серии средняя продолжительность пребывания в стационаре после гистерэктомии варьировала от 5,5 до 7 дней для лапароскопической и открытой абдоминальной гистерэктомии соответственно. 11 Осложнения после гистерэктомии включают инфекцию у 13 % пациенток, венозную тромбоэмболию у 1–12 % пациенток, травмы мочеполовой системы у 0,75–1,5 % пациенток, реже травмы желудочно-кишечного тракта, геморрагические осложнения, невропатия и расхождение влагалищной манжеты. 12
11 Осложнения после гистерэктомии включают инфекцию у 13 % пациенток, венозную тромбоэмболию у 1–12 % пациенток, травмы мочеполовой системы у 0,75–1,5 % пациенток, реже травмы желудочно-кишечного тракта, геморрагические осложнения, невропатия и расхождение влагалищной манжеты. 12
Хирургическое лечение врожденных артериовенозных клапанов таза часто бывает более сложным из-за обычно сложной сети артериовенозных сообщений и тесной связи аномальных сосудов с критическими структурами таза. По этим причинам хирургическое вмешательство при АВМ таза выполняется не так часто, как при АВМ матки.
Консервативное лечение
В сообщениях о клинических случаях описано использование агонистов гонадотропин-рилизинг-гормона (ГнРГ) для лечения АВМ матки у стабильных пациенток. В одном случае АВМ полностью разрешилась через 6 месяцев терапии агонистами ГнРГ (с последующей успешной беременностью), 13 , а в другом случае 6 месяцев терапии ГнРГ уменьшили размер АВМ, которая впоследствии была эмболизирована для радикальной терапии. 14
14
Высокоинтенсивный сфокусированный ультразвук под контролем УЗИ применялся в одном случае для лечения приобретенной АВМ матки у стабильной пациентки; потребовалось две обработки. 15
Многие АВМ матки проходят спонтанно и могут не требовать лечения, если состояние пациентки остается стабильным. Поскольку более широкое использование методов визуализации приводит к более частому выявлению легких или бессимптомных АВМ матки, доля диагностированных АВМ матки, которые можно безопасно лечить с помощью только наблюдения и последующей визуализации, вероятно, будет расти. В двух небольших группах из семи и 12 пациенток с бессимптомными или слабосимптомными АВМ матки сосудистая аномалия полностью исчезла у всех пациенток без вмешательства. 16,17
Недавнее проспективное исследование 75 пациенток было направлено на выявление факторов, предсказывающих развитие АВМ матки, связанных с беременностью, которые можно безопасно лечить консервативно. Низкая скорость кровотока в АВМ (PSV < 52 см/с) и нормальный исходный гемоглобин были среди факторов, связанных с пациентами, которым не потребовалось вмешательства. В исследовании 60% пациентов успешно лечились консервативно. 18
Низкая скорость кровотока в АВМ (PSV < 52 см/с) и нормальный исходный гемоглобин были среди факторов, связанных с пациентами, которым не потребовалось вмешательства. В исследовании 60% пациентов успешно лечились консервативно. 18
ЗАКЛЮЧЕНИЕ
АВМ матки и таза являются редкой причиной чрезмерного и потенциально катастрофического вагинального кровотечения; тем не менее, бессимптомные или слабосимптомные АВМ матки могут быть более распространенными, чем считалось ранее, поскольку выявляемость увеличивается при использовании рутинной визуализации. АВМ матки чаще бывают приобретенными, тогда как АВМ таза классически являются врожденными, с посттравматическими артериовенозными сообщениями таза, которые чаще называют фистулами. Хотя DSA является золотым стандартом диагностики, УЗИ с цветовой и спектральной допплерографией, КТА и МРА могут помочь в определении характеристик этих поражений, а также в планировании лечения. Эндоваскулярное лечение с транскатетерной эмболизацией является основой терапии как маточных, так и тазовых АВМ. АВМ матки, рефрактерные к эндоваскулярным вмешательствам, могут быть окончательно вылечены с помощью гистерэктомии, в то время как хирургическое лечение АВМ таза представляет большую проблему. Появляется все больше данных, свидетельствующих о том, что консервативное лечение может быть целесообразным для многих пациенток с АВМ матки, особенно с бессимптомными поражениями и/или низким кровотоком. По-прежнему рекомендуется тщательное клиническое наблюдение и визуализация, поскольку факторы, которые предсказывают спонтанное разрешение этих АВМ, должны быть лучше выяснены.
АВМ матки, рефрактерные к эндоваскулярным вмешательствам, могут быть окончательно вылечены с помощью гистерэктомии, в то время как хирургическое лечение АВМ таза представляет большую проблему. Появляется все больше данных, свидетельствующих о том, что консервативное лечение может быть целесообразным для многих пациенток с АВМ матки, особенно с бессимптомными поражениями и/или низким кровотоком. По-прежнему рекомендуется тщательное клиническое наблюдение и визуализация, поскольку факторы, которые предсказывают спонтанное разрешение этих АВМ, должны быть лучше выяснены.
1. Yazawa H, Soeda S, Hiraiwa T, et al. Проспективная оценка частоты развития мальформаций сосудов матки после абортов или родов. J Миним инвазивный гинекол. 2013;20:360-367.
2. Mahmoud M, Allinson KR, Zhai Z, et al. Патогенез артериовенозных мальформаций при отсутствии эндоглина.
Цирк Рез. 2010;106:1425-1433.
3. Фоллен М.М., Фокс Х.Е., Левин РУ. Порок развития шейных сосудов как причина дородового и интранатального кровотечения у трех потомков, подвергшихся воздействию диэтилстильбестрола. Am J Obstet Gynecol. 1985;153:890-891.
Am J Obstet Gynecol. 1985;153:890-891.
4. Manabe Y, Uegaki M, Asazuma A. Два случая врожденной тазовой артериовенозной мальформации у мужчин [на японском языке]. Хиньокика Киё. 2011;57:25-28.
5. Huang W, Muradali D, Thurston WA, et al. Артериовенозные мальформации матки: особенности шкалы серого и допплеровского УЗИ с корреляцией МРТ. Радиология. 1998; 206:115-123.
6. Timor-Tritsch IE, Haynes MC, Monteagudo A, et al. Ультразвуковая диагностика и лечение приобретенной усиленной васкуляризации матки/артериовенозных мальформаций. Am J Obstet Gynecol. 2016;214:731.e1-731.e10.
7. Форсман Л., Лундберг Дж., Шерстен Т. Консервативное лечение маточных артериовенозных свищей. Acta Obstet Gynecol Scand. 1982;61:85-87.
8. Wang Z, Chen J, Shi H, et al. Эффективность и безопасность эмболизации при ятрогенных травматических мальформациях сосудов матки. Клин Радиол. 2012;67:541-545.
9. Гай С., Раджан Д.К., Аш М.Р. и др. Эффективность эмболизации при травматических сосудистых мальформациях матки. J Vasc Interv Radiol. 2003; 14:1401-1408.
J Vasc Interv Radiol. 2003; 14:1401-1408.
10. Юн Д.Дж., Джонс М., Аль Таани Дж. и др. Систематический обзор приобретенных артериовенозных мальформаций матки: патофизиология, диагностика и транскатетерное лечение. Представитель AJP 2016; 6:e6-e14.
11. Ким С.М., Пак Э.К., Чон И.С. и др. Абдоминальная, многопортовая и однопортовая тотальная лапароскопическая гистерэктомия: сравнение одиннадцатилетних тенденций осложнений хирургических исходов 936 случаев. Акушерство Arch Gynec. 2015; 291:1313-1319.
12. Кларк-Пирсон Д.Л., Геллер Э.Дж. Осложнения гистерэктомии. Акушерство Гинекол. 2013;121:654-673.
13. Нонака Т., Яхата Т., Кашима К., Танака К. Разрешение артериовенозной мальформации матки и успешная беременность после лечения агонистом гонадотропин-высвобождающего гормона. Акушерство Гинекол. 2011;117:452-455.
14. Морикава М., Ямада Т., Ямада Х., Минаками Х. Влияние агониста гонадотропин-рилизинг-гормона на артериовенозную мальформацию матки. Акушерство Гинекол. 2006; 108:751-753.
2006; 108:751-753.
15. Yan X, Zhao C, Tian C, et al. Высокоинтенсивная сфокусированная ультразвуковая абляция под ультразвуковым контролем для лечения артериовенозной мальформации матки. БЖОГ. 2017;124(доп.3):93-96.
16. Wiebe ER, Switzer P. Артериовенозные мальформации матки, связанные с медикаментозным абортом. Int J Obstet Gynecol. 2000;71:155-158.
17. Дегани С., Лейбовиц З., Шапиро И., Охель Г. Выжидательная тактика при высокоскоростном артериовенозном шунтировании матки, связанном с беременностью, диагностированном после аборта. Int J Obstet Gynecol. 2009;106:46-49.
18. Lee TY, Kim SH, Lee HJ, et al. Ультрасонографические показания к консервативному лечению артериовенозных мальформаций матки, связанных с беременностью. Акта Радиол. 2014;55:1145-1152.
Дивья Сридхар, доктор медицины
Доцент кафедры радиологии
Директор ординатуры и стажировки по интервенционной радиологии
NYU Langone Health
New York, New York
divya. [email protected]
[email protected]
Раскрытие информации: нет.
Роберт Л. Фогельзанг, доктор медицинских наук
Профессор радиологии
Северо-Западный университет Медицинская школа им. Файнберга
Чикаго, Иллинойс
[email protected]
Раскрытие информации: нет.
Успешное лечение артериовенозной мальформации матки вследствие травмы матки
На этой странице
Аннотация0005
Артериовенозная мальформация матки (АВМ) определяется как аномальное и нефункциональное соединение между маточными артериями и венами. Хотя у пациенток обычно наблюдается вагинальное кровотечение, у некоторых пациенток в некоторых случаях могут возникнуть опасные для жизни массивные кровотечения. Выбор лечения зависит от симптомов, возраста, желания будущей фертильности, локализации и размера поражения; однако эмболизация маточной артерии является методом первого выбора при симптоматической АВМ у пациенток репродуктивного возраста с надеждой на будущую фертильность. Мы сообщаем о случае приобретенной АВМ (после Д/К) с обширным поражением, которое было успешно вылечено с помощью двусторонней эмболизации маточных артерий (ЭМА).
Мы сообщаем о случае приобретенной АВМ (после Д/К) с обширным поражением, которое было успешно вылечено с помощью двусторонней эмболизации маточных артерий (ЭМА).
1. Введение
Артериовенозная мальформация матки (АВМ) определяется как аномальное и нефункциональное соединение между маточными артериями и венами. Это могут быть как врожденные, так и приобретенные пороки (травматические) поражения. Врожденные АВМ являются крайне редкими состояниями, тогда как частота встречаемости приобретенных АВМ в настоящее время увеличивается [1–3]. Приобретенные АВМ часто связаны с предшествующими хирургическими вмешательствами на матке (дилатация и выскабливание (Д/К)), терапевтическим абортом, раком шейки матки или эндометрия, трофобластическими заболеваниями, прямой травмой матки и чаще возникают у женщин репродуктивного возраста [4]. Типичным симптомом является вагинальное кровотечение; однако у некоторых пациентов может наблюдаться массивное кровотечение, угрожающее жизни.
Мы сообщаем о случае приобретенной АВМ (после D/C) с обширным поражением, которое было успешно вылечено с помощью ЭМА.
2. Случай
35-летняя пациентка, беременность 2, пара 1, аборт 1, перенесла Д/К на 9 неделе из-за замершей беременности примерно за две недели до этого в другом центре (рис. 1). Пациенту была проведена повторная процедура Д/К при контрольном посещении через неделю после первоначального вмешательства в другом центре с подозрением на гематому; однако процедура была прекращена из-за кровотечения, и пациент был направлен в нашу больницу. При поступлении гемоглобин составлял 11,2 г/дл, Htc — 35,1%, ХГЧ — 3518 мМЕ/мл. Признаков активного вагинального кровотечения не было. Трансвагинальное УЗИ (ТВУЗГ) выявило 60 60 56 мм (103 см 3 ) гиперэхогенное и неоднородное объемное образование, расположенное на передней стенке матки и распространяющееся латерально слева. Скопление жидкости в полости эндометрия минимальное. Придатки с обеих сторон выглядели нормально. Ультразвуковая допплерография выявила заметные венозные сосудистые сигналы (рис. 1). Больной госпитализирован с диагнозом артериовенозная мальформация. Была проведена консультация с интервенционным радиологом, и пациенту была назначена ЭМА. Двустороннюю ЭМА выполняли смесью гистоакрил-липиодол. Изображения пациента до и после эмболизации представлены на рис. 2. Осложнений после процедуры не возникло. Пациент был выписан через два дня после процедуры; ее уровень ХГЧ снизился до 1766 мМЕ/мл. Контрольное допплеровское УЗИ, проведенное через месяц, показало отсутствие кровотока и размер образования 61 46 52 мм (77 см 3 ) и с усадкой (рис. 3). Уровень ХГЧ был <0,5 мМЕ/мл.
Была проведена консультация с интервенционным радиологом, и пациенту была назначена ЭМА. Двустороннюю ЭМА выполняли смесью гистоакрил-липиодол. Изображения пациента до и после эмболизации представлены на рис. 2. Осложнений после процедуры не возникло. Пациент был выписан через два дня после процедуры; ее уровень ХГЧ снизился до 1766 мМЕ/мл. Контрольное допплеровское УЗИ, проведенное через месяц, показало отсутствие кровотока и размер образования 61 46 52 мм (77 см 3 ) и с усадкой (рис. 3). Уровень ХГЧ был <0,5 мМЕ/мл.
3. Обсуждение
АВМ матки занимают важное место в гинекологической практике из-за риска массивного кровотечения, которое может быть опасным для жизни у некоторых пациенток. Это могут быть как врожденные, так и приобретенные (травматические) поражения. Приобретенные пороки развития могут быть связаны с предшествующей травмой матки (предшествующая операция на малом тазу и выскабливание), патологическими состояниями, связанными с беременностью, инфекциями и лечением гестационной трофобластической болезни. Считается, что врожденные АВМ возникают в результате задержки эмбриологического развития сосудов, что приводит к аномальной дифференцировке капилляров и аномальному сообщению между артериями и венами [5]. Кроме того, врожденные АВМ могут иметь несколько сосудистых соединений и могут проникать в окружающие структуры. Важно правильно диагностировать АВМ матки и своевременно начать соответствующее лечение, поскольку АВМ матки часто вызывает опасные для жизни массивные и непрекращающиеся вагинальные кровотечения. В данном случае в короткие сроки (около трех недель) развилась АВМ матки, вторичная по отношению к перенесенной травме матки (D/C).
Считается, что врожденные АВМ возникают в результате задержки эмбриологического развития сосудов, что приводит к аномальной дифференцировке капилляров и аномальному сообщению между артериями и венами [5]. Кроме того, врожденные АВМ могут иметь несколько сосудистых соединений и могут проникать в окружающие структуры. Важно правильно диагностировать АВМ матки и своевременно начать соответствующее лечение, поскольку АВМ матки часто вызывает опасные для жизни массивные и непрекращающиеся вагинальные кровотечения. В данном случае в короткие сроки (около трех недель) развилась АВМ матки, вторичная по отношению к перенесенной травме матки (D/C).
В современной практике АВМ легко диагностируется с помощью цветной допплерографии [6]. Но при дифференциальной диагностике следует помнить о задержке продуктов зачатия (RPOC) и гестационных трофобластических заболеваниях (GTD), поскольку в этих случаях также может наблюдаться гиперваскуляризация с турбулентным течением. Уровни BHCG могут быть полезны в диагностике. У этого пациента не было повышения уровня ХГЧ, которое можно было бы ожидать при ГТД. Тем не менее, трофобластическая опухоль плацентарного участка (PSTT) не продуцирует высокие уровни ХГЧ и вместо этого продуцирует человеческий плацентарный лактоген (hPL) [7].
У этого пациента не было повышения уровня ХГЧ, которое можно было бы ожидать при ГТД. Тем не менее, трофобластическая опухоль плацентарного участка (PSTT) не продуцирует высокие уровни ХГЧ и вместо этого продуцирует человеческий плацентарный лактоген (hPL) [7].
Однако уровни hPL у этого пациента не измерялись, потому что GTD и PSTT не учитывались при дифференциальной диагностике. Значения ХГЧ в представленном случае снижались, и предположительно это было связано с абортом. Если диагноз все еще не определен; МР-ангиография является полезным диагностическим инструментом для выяснения связи АВМ с соседними органами и дифференциации этих поражений от гестационных трофобластических заболеваний [1].
Лечение меняется в зависимости от возраста, желания будущей фертильности, локализации и размера поражения. Основой лечения АВМ матки является гистерэктомия или эмболизация маточных артерий. Тем не менее, эмболизация маточных артерий (ЭМА) остается методом первого выбора у женщин репродуктивного возраста, имеющих надежду на будущую фертильность [8]. Вопрос о том, безопасна ли эта процедура для женщин, желающих иметь фертильность в будущем, остается спорным; однако женщины, забеременевшие после ЭМА, подвержены риску неправильного предлежания, кесарева сечения, преждевременных родов и послеродового кровотечения [9].].
Вопрос о том, безопасна ли эта процедура для женщин, желающих иметь фертильность в будущем, остается спорным; однако женщины, забеременевшие после ЭМА, подвержены риску неправильного предлежания, кесарева сечения, преждевременных родов и послеродового кровотечения [9].].
Некоторые исследования показали, что консервативный подход подходит для бессимптомных пациентов [10, 11]. В некоторых сообщениях упоминается использование метилэргоновина малеата, аналогов гонадотропин-рилизинг-гормона и даназола при лечении пациентов с легким кровотечением [12-14]. В настоящее время нет четкого соглашения о лечении бессимптомных АВМ матки.
В заключение, АВМ являются редкими и опасными клиническими формами; их управление сложно и требует высокого уровня подозрительности. Обычно эти поражения присутствуют у молодых женщин, у которых в анамнезе были самопроизвольные аборты. У пациентки, представленной в этом отчете, была АВМ, которая развилась вторично после предыдущей операции на матке и подверглась повторному вмешательству во время контрольного визита с подозрением на гематому и сохранение продуктов зачатия; однако это последнее вмешательство привело к обильному кровотечению. Следует иметь в виду, что у пациенток может развиться АВМ после опорожнения матки по поводу невынашивания беременности, и возможность АВМ необходимо учитывать при дифференциальной диагностике.
Следует иметь в виду, что у пациенток может развиться АВМ после опорожнения матки по поводу невынашивания беременности, и возможность АВМ необходимо учитывать при дифференциальной диагностике.
Раскрытие информации
Авторы не имеют никакого отношения к компаниям и продуктам, упомянутым в этом исследовании.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов и финансовой поддержки.
Ссылки
P. O’Brien, A. Neyastani, A.R. Buckley, S.D. Chang и G.M. Legiehn, «Артериовенозные пороки развития матки: от диагностики к лечению», Journal of Ultrasound in Medicine , vol. 25, нет. 11, стр. 1387–139.2, 2006.
Посмотреть по адресу:
Google Scholar
R. Halperin, D. Schneider, R. Maymon, A. Peer, M. Pansky и A. Herman, «Артериовенозная мальформация после выскабливания матки: a отчет о 3 случаях», The Journal of Reproductive Medicine , vol.
 52, нет. 5, pp. 445–449, 2007.
52, нет. 5, pp. 445–449, 2007.Посмотреть по адресу:
Google Scholar
М. Кура, Н. Мартинес, А. Кура, Т. Дж. Далсасо и Ф. Эльмери, «Артериовенозные мальформации матки, Acta Radiologica , vol. 50, нет. 7, стр. 823–829, 2009.
Посмотреть по адресу:
Сайт издателя | Google Scholar
R. M. Grivell, K. M. Reid, and A. Mellor, «Артериовенозные мальформации матки: обзор современной литературы», Obstetrical & Gynecological Survey , vol. 60, нет. 11, стр. 761–767, 2005.
Посмотреть по адресу:
Сайт издателя | Google Scholar
P. Polat, S. Suma, M. Kantarcý, F. Alper и A. Levent, «Цветовой допплеровский ультразвук в оценке сосудистых аномалий матки», Рентгенография , том. 22, нет. 1, стр.
 47–53, 2002 г.
47–53, 2002 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
T. Ghi, S. Giunchi, C. Rossi et al., «Трехмерная энергетическая допплерография в диагностике артериовенозной мальформации матки», Journal of Ultrasound in Medicine , vol. 24, нет. 5, pp. 727–731, 2005.
Посмотреть по адресу:
Google Scholar
А. Гиллеспи и Б. Хэнкок, «Тробобластная опухоль плацентарной площадки», в Гестационная трофобластическая болезнь , Б. Хэнкок, М. Секл, Р. Берковиц и Л. Коул, ред., 3-е издание, стр. 420–429, Международное общество по изучению трофобластических заболеваний, 2009 г.
Посмотреть на :
Google Scholar
S. Soeda, H. Kyozuka, S. Suzuki, S. Yasuda, Y. Nomura и K. Fujimori, «Эмболизация маточных артерий при маточных артериовенозных мальформациях связана с плацентарными аномалиями в последующем.
 беременность: сообщается о двух случаях» Fukushima Journal of Medical Science , vol. 60, нет. 1, стр. 86–90, 2014 г.
беременность: сообщается о двух случаях» Fukushima Journal of Medical Science , vol. 60, нет. 1, стр. 86–90, 2014 г.Посмотреть по адресу:
Сайт издателя | Google Scholar
Дж. Голдберг, Л. Перейра и В. Бергелла, «Беременность после эмболизации маточных артерий», Акушерство и гинекология , том. 100, нет. 5, стр. 869–872, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Т. Ван ден Бош, Д. Ван Шубрук, К. Лу, Дж. Де Брабантер, С. Ван Хаффель и Д. Тиммерман, «Цветная допплеровская и полутоновая ультразвуковая оценка послеродовой матки, Ультразвук в акушерстве и гинекологии , том. 20, нет. 6, стр. 586–591, 2002.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Д.
 Ван Шубрук, Т. Ван Ден Бош, К. Шарпе, К. Лу, С. Ван Хаффель и Д. Тиммерман, «Проспективная оценка кровотока в миометрии и маточных артериях в послеродовом периоде». , Ультразвук в акушерстве и гинекологии , том. 23, нет. 4, стр. 378–381, 2004 г.
Ван Шубрук, Т. Ван Ден Бош, К. Шарпе, К. Лу, С. Ван Хаффель и Д. Тиммерман, «Проспективная оценка кровотока в миометрии и маточных артериях в послеродовом периоде». , Ультразвук в акушерстве и гинекологии , том. 23, нет. 4, стр. 378–381, 2004 г.Посмотреть по адресу:
Сайт издателя | Академия Google
И. Онояма, М. Фукухара, А. Окума, Ю. Ватанабэ и Г.-И. Накамура, «Успешная беременность после неинвазивного лечения артериовенозной мальформации матки», Acta Obstetricia et Gynecologica Scandinavica , vol. 80, нет. 12, стр. 1148–1149, 2001.
Посмотреть по адресу:
Сайт издателя | Google Scholar
Такеучи К., Ямада Т., Иваса М. и Маруо Т., «Успешное лечение даназолом после неудачной эмболизации артериовенозной мальформации матки», Акушерство и гинекология , том. 102, нет. 4, стр.

