Перитониты у детей: Перитонит у детей: симптомы заболевания, методы диагностики и лечения — Медицинский центр Adonis в Киеве
ПЕРИТОНИТЫ У ДЕТЕЙ
ПЕРИТОНИТЫ У ДЕТЕЙ, АППЕНДИКУЛЯРНЫЙ ПЕРИТОНИТ, АППЕНДИКУЛЯРНЫЙ ИНФИЛЬТРАТ
Причинные патологические процессы при перитоните у детей
| 1 |
| 2 |
| 3 | |
|
|
|
|
|
| |
| Острый |
| Интрагенитальная |
| Осложнение | |
аппендицит | патология у девочек | абдоминальных | ||||
| Острая |
| Ущемленная грыжа | операций | ||
непроходимость |
|
| ||||
| Сепсис |
| Гнойный | |||
кишечника |
| |||||
паранефрит | ||||||
новорожденного | ||||||
| Закрытая травма | |||||
|
| |||||
|
|
| Ишемический | |||
живота с |
| Острый |
| |||
некроз кишечника | ||||||
повреждением | деструктивный | |||||
|
| |||||
полого органа, | панкреатит |
|
| |||
поджелудочной |
|
|
|
| ||
железы |
|
|
|
| ||
Вколонках таблицы указаны наиболее частые (1), относительно редкие
(2)и крайне редкие (3) причинные процессы, осложняющиеся перитонитом у детей. Следует лишь подчеркнуть, что перитонит, редко возникающий как осложнение хирургических операций в брюшной полости у детей, протекает крайне неблагоприятно. При остром аппендиците перитонит наблюдается у 6
Следует лишь подчеркнуть, что перитонит, редко возникающий как осложнение хирургических операций в брюшной полости у детей, протекает крайне неблагоприятно. При остром аппендиците перитонит наблюдается у 6
– 25% больных. Но, если у детей старшего возраста частота перитонита составляет 6-9,5%, то в младшей возрастной группе (до 3-х лет) – до 50-52%. Летальность при перитоните у детей составляет 0,3-0,4%. Однако в младшем возрасте – в десятки раз выше (до 3-20% по данным разных авторов). Успешная разработка и использование современных методов хирургического и интенсивного терапевтического лечения в реактивной и токсической фазе перитонита обусловили значительное снижение летальности. Однако в терминальной фазе, а также при послеоперационном перитоните, перитоните новорожденных летальность остается высокой.
ОПРЕДЕЛЕНИЕ ПОНЯТИЯ, КЛАССИФИКАЦИЯ ПЕРИТОНИТА
Сложностями исследований этиологии, патогенетических механизмов перитонита в известной степени объясняется то, что до сих пор удовлетворительного определения этого понятия нет даже в энциклопедических изданиях, являющихся нормативными. В учебной и научной литературе нередко использовался перевод термина на русский язык (перитонит – воспаление брюшины), что нельзя считать определением понятия. Анализ многочисленных публикаций привел нас к следующему рабочему варианту определения:
В учебной и научной литературе нередко использовался перевод термина на русский язык (перитонит – воспаление брюшины), что нельзя считать определением понятия. Анализ многочисленных публикаций привел нас к следующему рабочему варианту определения:
Перитонит – острое воспалительное осложнение (заболевание), возникающее при нарушении местных защитных функций брюшины вследствие патологического воздействия экзоили эндогенных причинных факторов.
Сложность определения понятия «перитонит» обусловила и проблемы в разработке классификации, которая удовлетворяла бы всех специалистов, исследующих и решающих проблемы диагностики и лечения детей при этом заболевании. Попытки создания такой классификации, на наш взгляд, безуспешны. Полная, исчерпывающая классификация перитонита представляется громоздкой, непригодной к практическому использованию. Необходима классификация, содержащая соподчиненные группы классифицируемого понятия, каждая из которых может быть расширена в соответствии с задачами исследователя, содержащая основания для унификации хирургической тактики и программ интенсивной терапии при использовании ясной терминологии и систематизации накопленных научнопрактических данных. Наибольшую распространенность в настоящее время имеют классификации перитонита, предложенные В.С.Маят и В.Д.Федоровым (1970,1973), К.С.Симоняном (1980), С.Л.Либовым (1983).
Наибольшую распространенность в настоящее время имеют классификации перитонита, предложенные В.С.Маят и В.Д.Федоровым (1970,1973), К.С.Симоняном (1980), С.Л.Либовым (1983).
Однако многолетнее использование хирургами классификации В.С.Маят и В.Д.Федорова не изменило ситуации в сопоставимости результатов лечения при перитоните – статистические «неожиданности» по К.С.Симоняну и сегодня не редкость. Каждая из классификаций, характеризует отдельные стороны перитонита, наиболее пристально изучавшиеся авторами.
Наиболее существенными недостатками используемых и опубликованных классификаций считаем нечеткость определений, допускающих произвольное смысловое толкование классификационных понятий этиологии, стадий, фаз процесса, нарушение условий правильного деления объема понятия, использование синонимов для обозначения различных понятий и наличие классификационных терминов, не имеющих смысла по отношению к воспалительному процессу .
Считая перитонит воспалительным процессом, развивающимся на основе общих закономерностей возникновения воспалительного очага и ответных реакций организма, при построении патогенетически обоснованной классификации мы использовали семь классификационных критериев (рубрикаторов), известную терминологию, но при исключении синонимов в определении различных понятий. Перитонит классифицировали по причинам и механизму возникновения, этиологии, клинико-морфологическим признакам воспалительного очага, фазам ответно-компенсаторных реакций организма, осложнениям и исходам .
Перитонит классифицировали по причинам и механизму возникновения, этиологии, клинико-морфологическим признакам воспалительного очага, фазам ответно-компенсаторных реакций организма, осложнениям и исходам .
Классификационная схема «Перитонит» содержит указание на пусковой фактор, причинный орган, что отражается в формулировке клинического диагноза основного заболевания – острый деструктивный аппендицит, холецистит, панкреатит, перфорация язвы желудка, кишечника, острая непроходимость кишечника, септический язвенно-некротический
энтероколит новорожденного (Рис.1) и т.п. Пусковой фактор нетождественен понятию этиологии перитонита как воспалительного процесса.
Рис.1. Перфорация язвы при некротическом энтероколите
По механизму возникновения различают: первичный перитонит,
возникающий при гематогенном либо лимфогенном пути инфицирования
брюшины, | а | также | при | не | установленном | причинном | |
органе. |
| – | следствие | деструктивного, | |||
прогрессирующего воспалительного процесса в органе, стенке брюшной полости, забрюшинном пространстве и распространения на париетальную брюшину. Вторичный перитонит возникает на фоне реактивности организма, измененной предшествующим деструктивным процессом в брюшной полости как осложнение основного заболевания либо интраабдоминального оперативного вмешательства (послеоперационный перитонит).
По этиологии различают асептический и инфекционный (гнойный)
перитонит. Асептический перитонит в процессе своего развития достаточно быстро приобретает характер гнойного. Введение в классификацию оправдано задачами дифференциальной диагностики, так как ферментативный перитонит при панкреатите, серозный — при системных заболеваниях, специфических инфекциях у детей не всегда требует хирургического лечения. При гнойном перитоните бактериологическими исследованиями чаще всего обнаруживают в качестве возбудителя кишечную палочку, неклостридиальные анаэробы (бактероиды, энтерококки), реже – пневмококки, стафилококки, протей, синегнойную палочку, микробные ассоциации.
По морфологическим признакам определяют клинические формы перитонита, характеризующиеся локализацией, преобладающей фазой
местного воспаления, стадией воспалительного | процесса, видом |
экссудата. По расположению клинические формы | отграниченного и |
местного перитонита классифицировались относительно анатомических областей – подвздошный, тазовый, латеральный, мезогастральный,
поддиафрагмальный. По | преобладающей | фазе воспаления различают | |||
отграниченный | и | распространенный | (не | отграниченный) | |
перитонит. Отграниченный | перитонит определяется | наличием | |||
морфологически выраженного пластического процесса, отграничивающего причинный орган от свободной брюшной полости. Существенным для определения хирургической тактики является распознавание стадии
Существенным для определения хирургической тактики является распознавание стадии
отграниченного перитонита: инфильтрат рыхлый, или несформированный
и плотный, или | сформированный; абсцесс | |
изолированный и абсцесс, сообщающийся с | брюшной | полостью |
(дренирующийся). Отграниченный перитонит характеризуется также топографической локализацией инфильтрата или абсцесса.
Не отграниченный, или распространенный перитонит возникает как следствие функциональной недостаточности местной реакции на локальный деструктивный процесс либо в связи с функциональной незрелостью ее механизмов у маленьких детей, либо – с силой патогенных факторов деструктивного процесса в причинном органе, превышающей функциональные резервы систем местной защиты. Местный перитонит как стадия распространенного устанавливается при воспалении брюшины в одной анатомической области, соответствующей расположению причинного органа. Разлитой перитонит характеризуют те же изменения, но обнаруживаемые в областях брюшной полости, смежных с расположением причинного органа. Общий перитонит определяется воспалением брюшины (гиперемия, отек, экссудат) в областях, анатомически не смежных с расположением причинного органа, паралитическим илеусом как проявлением нарушения внутриорганной микроциркуляции в желудочнокишечном тракте и выключения его из процессов жизнеобеспечения. Самопроизвольное дренирование абсцесса в брюшную полость определяется как сочетанная форма перитонита – отграниченного и распространенного. К морфологическим признакам относится и вид экссудата: серозный, гнойный, фибринозный, и смешанные виды – фибринозно-гнойный и др.
Разлитой перитонит характеризуют те же изменения, но обнаруживаемые в областях брюшной полости, смежных с расположением причинного органа. Общий перитонит определяется воспалением брюшины (гиперемия, отек, экссудат) в областях, анатомически не смежных с расположением причинного органа, паралитическим илеусом как проявлением нарушения внутриорганной микроциркуляции в желудочнокишечном тракте и выключения его из процессов жизнеобеспечения. Самопроизвольное дренирование абсцесса в брюшную полость определяется как сочетанная форма перитонита – отграниченного и распространенного. К морфологическим признакам относится и вид экссудата: серозный, гнойный, фибринозный, и смешанные виды – фибринозно-гнойный и др.
Термин «диффузный перитонит» из классификационной схемы исключен. Можно говорить о процессе диффузии как взаимопроникновении структурных элементов физических тел или сред при их соприкосновении, но не следует говорить о «диффузном процессе», характеризуя его распространенность. Также считаем не корректным использование в классификационных схемах терминов «каловый», «желчный», «геморрагический» и т. п. перитонит. Кишечное содержимое, как и газ, кровь, лимфа, желчь, моча по существу не является ни воспалительным экссудатом, ни причиной перитонита.
п. перитонит. Кишечное содержимое, как и газ, кровь, лимфа, желчь, моча по существу не является ни воспалительным экссудатом, ни причиной перитонита.
Комплекс каскадных ответно-компенсаторных реакций организма больного ребенка на возникновение и развитие гнойно-воспалительного процесса в брюшной полости характеризуется фазами адаптационного синдрома – реактивной, токсической и терминальной — обратимой и необратимой. Клинические проявления фаз имеют различную выраженность и продолжительность в зависимости от возраста ребенка, клинической формы, стадии перитонита. Совокупность симптомов и синдромов терминальной фазы перитонита может быть определена как синдром системной воспалительной реакции (по рекомендациям согласительной комиссии, 1991), полиорганной недостаточности. Необратимость терминальной фазы обусловлена устойчивостью (рефрактерностью) к лечебным воздействиям или крайней нестабильностью результатов
интенсивного лечения, направленного на регуляцию, поддержание или замещение функций жизненно важных органов.
Классификация также имеет рубрики: осложнения перитонита и исходы.
КЛИНИЧЕСКАЯ ФИЗИОЛОГИЯ (ПАТОГЕНЕЗ) ПЕРИТОНИТА
Для того чтобы понять диагностическое и прогностическое значение симптомов перитонита, для разработки рациональной (адекватной и патогенетической) программы лечения, врачу необходимо иметь представление о механизме развития перитонита – патогенезе. Так же как знание топографической анатомии делает «зрячими» руки врача при пальпации живота, так и знание современных представлений о клинической физиологии перитонита, позволяя как бы изнутри увидеть происходящее в организме больного ребенка, помогает понять смысл процесса, способствует разработке адекватных диагностической и лечебной программ.
Патогенез перитонита – это патофизиология воспалительного очага в брюшной полости и ответно-компенсаторных реакций организма.
Схематически патогенез | перитонита показан | на Рис. | Воспаление | |||
в причинном | органе, | возникновение | или | воздействие | иного | |
патологического | фактора | являются пусковым | моментом | в механизме | ||
местных и общих реакций.
Нарушение местных тканевых механизмов защиты, изменение взаимоотношений организма ребенка и условно патогенной микрофлоры (первый элемент в патогенезе перитонита) приводит к локальной циркуляторной тканевой гипоксии, возникновению клеточных иммунных реакций в перифокальной зоне париетальной брюшины. Преобладание пролиферативной стадии воспаления брюшины приводит к формированию отграниченного перитонита. С преобладанием экссудативной стадии связано развитие распространенного перитонита. Комплекс воспалительных реакций, направленных на отграничение причинного органа, фиксацию микроорганизмов, резко повышает локальные потребности в энергетических субстратах, кислороде. Вследствие микроциркуляторных нарушений (капилляростаз, вазодилятация, повышение проницаемости сосудистой стенки и др.) потребности не обеспечиваются. Накопление недоокисленных метаболитов, секреторное и цитотоксическое поступление медиаторов воспаления происходит на фоне нарушений функций желудочнокишечного тракта (ЖКТ), голодания. Вследствие субстратно-энергетического дисбаланса, продолжающегося воздействия причинного фактора, компенсаторные системные реакции большой силы и продолжительности истощаются. Последствия же этих реакций приобретают повреждающий характер. При распространенном (не отграниченном) перитоните на фоне снижения иммунологической реактивности, при сохранении высокой резорбтивной способности брюшины и длительной патологической импульсации из очага воспаления, ответно-компенсаторные реакции организма приобретают каскадный характер и способны привести к утрате функциональных резервов органов и систем, повреждению их структуры.
Вследствие микроциркуляторных нарушений (капилляростаз, вазодилятация, повышение проницаемости сосудистой стенки и др.) потребности не обеспечиваются. Накопление недоокисленных метаболитов, секреторное и цитотоксическое поступление медиаторов воспаления происходит на фоне нарушений функций желудочнокишечного тракта (ЖКТ), голодания. Вследствие субстратно-энергетического дисбаланса, продолжающегося воздействия причинного фактора, компенсаторные системные реакции большой силы и продолжительности истощаются. Последствия же этих реакций приобретают повреждающий характер. При распространенном (не отграниченном) перитоните на фоне снижения иммунологической реактивности, при сохранении высокой резорбтивной способности брюшины и длительной патологической импульсации из очага воспаления, ответно-компенсаторные реакции организма приобретают каскадный характер и способны привести к утрате функциональных резервов органов и систем, повреждению их структуры.
Вторым звеном (элементом) в каскаде ответных реакций считают реологические и микроциркуляторные изменения в воспаленной брюшине, приводящие к снижению объема циркулирующей крови (ОЦК) – гиповолемии и повышению вязкости вследствие гемоконцентрации (сгущения). Потери жидкости и ионов Na˙, K˙, Cl’ с рвотными массами, в содержимом паретичного кишечника, в экстравазатах, при повышении перспирационных потерь вследствие гипертермии, тахипноэ при отсутствии естественного пути возмещения
Потери жидкости и ионов Na˙, K˙, Cl’ с рвотными массами, в содержимом паретичного кишечника, в экстравазатах, при повышении перспирационных потерь вследствие гипертермии, тахипноэ при отсутствии естественного пути возмещения
способствуют развитию дегидратации по | изотоническому или реже | — | |
гипотоническому | типу. Гиповолемия, | гемоконцентрация | и |
дегидратация приводят к несоответствию объема циркулирующей крови и емкости сосудистого русла, что наряду с болевой импульсацией стимулирует симпатоадреналовую систему. Гиперкатехоламинемия – один из механизмов, обеспечивающих централизацию кровообращения как единственно возможную защитную реакцию организма при отсутствии естественного
энтерального пути возмещения потерь жидкости. |
| |||
Возникновение |
| субстратно-энергетического | дисбаланса | |
формирует третье | звено | в | патогенезе перитонита – изменения | |
метаболизма с преобладанием | I пути окисления (Эмбдена-Мейергофа). | |||
Нарушение внутриорганной микроциркуляции в ЖКТ, почках, печени, развитие гипоксии, гиперкапнии на фоне катаболической направленности обменных процессов, усугубляя реологические и микроциркуляторные изменения, приводят к изменениям активной реакции внутренней среды (АРВС или КЩС) – метаболическому ацидозу, алкалозу. Этот процесс без врачебного вмешательства уже необратим.
Четвертое звено в патогенезе перитонита — генерализованное поражение гемодинамики (микроциркуляторной и центральной), которое на фоне функциональной несостоятельности ЖКТ, почек, печени и метаболических сдвигов приводит к нарушениям функций жизненно важных органов – сердца, легких и головного мозга.
При поражении приоритарных органов вследствие полного
несоответствия | субстратно-энергетического обеспечения обмена веществ |
(дискредитация | метаболизма) возникает необратимая дискоординация |
нейрогуморальной регуляции всех функциональных систем и органов,
обеспечивающих гомеостаз — пятое звено патогенеза. В этой стадии болезни патогенез перитонита становится танатогенезом – механизмом умирания.
Для понимания семиотики и симптоматологии перитонита рассмотрим упрощенно, схематично некоторые физиологические эффекты гиповолемии и гемоконцентрации, гипоксии и гиперкапнии, изменений метаболизма, которыми обусловлены нарушения функций органов и систем
при перитоните. |
|
| |
На | возникновение | гиповолемии система | дыхания отвечает |
компенсаторной гипервентиляцией, что приводит к увеличению венозного возврата за счет присасывающего действия дыхательной мускулатуры. Возникает респираторный алкалоз, компенсирующий локальный (органный)
Возникает респираторный алкалоз, компенсирующий локальный (органный)
метаболический ацидоз. При этом снижение напряжения кислорода в венозной крови (рО2) обусловлено его повышенной утилизацией в тканях и свидетельствует о наличии гипоксии. Поступление в общий кровоток биологически активных веществ, агрегантов из очага воспаления нарушает недыхательные функции легких, приводит к интерстициальному отеку, снижению растяжимости, возникновению альвеолярного шунта. В клинической картине это проявляется резким снижением функциональных резервов легких и определяется понятием «шокового легкого».
Гиповолемия нарушает функции крови как органа, снижает ее транспортную функцию, кислородную емкость. Дестабилизация системы гемостаза проявляется синдромом диссеминированного внутрисосудистого свертывания.
Снижение почечного кровотока через волюмрецепторы повышает уровень альдостерона, чем обеспечивается повышенная реабсорбция натрия в почечных канальцах. Изменение осмотической концентрации через осморецепторы стимулирует выделение антидиуретического гормона. Эти два механизма обеспечивают компенсацию гиповолемии за счет снижения клубочковой фильтрации, повышения реабсорбции воды в канальцах и клинически проявляются олиго- и анурией, нарушением фильтрационной функции почек. Ишемические апикальные некрозы проявляются острой почечной недостаточностью.
Эти два механизма обеспечивают компенсацию гиповолемии за счет снижения клубочковой фильтрации, повышения реабсорбции воды в канальцах и клинически проявляются олиго- и анурией, нарушением фильтрационной функции почек. Ишемические апикальные некрозы проявляются острой почечной недостаточностью.
Снижение кровотока в ЖКТ приводит к нарушению моторноэвакуаторной, пищеварительной, секреторной и экскреторной функций. С парезом кишечника, объемом перитонеального экссудата связано повышение внутрибрюшного давления (ВБД). В сочетании с болью повышение ВБД ограничивает глубину дыхания, способствуя нарастанию гипоксии, гиперкапнии вследствие гипервентиляции при тахипноэ. Снижение устойчивости слизистой оболочки ЖКТ к пептическому воздействию его содержимого способствует образованию эрозий, язв, что на фоне коагулопатии может проявляться желудочно-кишечными кровотечениями, усугубляющими гемическую гипоксию, гиповолемию.
Снижение мезентериального кровотока усиливает гипоксию печени, что нарушает ее многообразные функции, способствует развитию анемии, тромбоцитопении. Выброс ферритина обуславливает возникновение центральных дольковых некрозов, повышение давления в портальной системе.
Выброс ферритина обуславливает возникновение центральных дольковых некрозов, повышение давления в портальной системе.
Снижение перфузии тканей вследствие гиповолемии приводит к изменению в них обмена веществ. Недостаток кислорода определяет
переход к | анаэробному гликолизу | (путь Эмбдена-Мейергофа) для | |
«аварийного» | обеспечения | энергией | процессов |
жизнеобеспечения. Уменьшение образования энергии (в 15 раз) и
накопление недоокисленных метаболитов – одна из причин возникновения метаболического ацидоза.
Дефицит энергообеспечения и ацидоз угнетают функции миокарда, что через снижение сердечного выброса в совокупности со снижением
насыщения крови кислородом и гипоксией вследствие сдвига кривой диссоциации оксигемоглобина, уменьшением венозного возврата из-за повышения транссудации из сосудистого русла, снижением сократимости миокарда в связи с ионным дисбалансом, приводят к прогрессированию уменьшения сердечного выброса, гиповолемии. Вазоконстрикция, интерстициальный отек, снижение продукции сурфактанта и растяжимости легких приводят к повышению периферического сопротивления в малом круге и развитию правожелудочковой недостаточности кровообращения. Гипоксия миокарда приводит к дегенерации миокарда и развитию миокардиальной недостаточности кровообращения, которые могут проявляться тахикардией, брадикардией, а в последствии — экстрасистолией, фибрилляцией.
Вазоконстрикция, интерстициальный отек, снижение продукции сурфактанта и растяжимости легких приводят к повышению периферического сопротивления в малом круге и развитию правожелудочковой недостаточности кровообращения. Гипоксия миокарда приводит к дегенерации миокарда и развитию миокардиальной недостаточности кровообращения, которые могут проявляться тахикардией, брадикардией, а в последствии — экстрасистолией, фибрилляцией.
Быстрое развитие смешанной гипоксии (циркуляторной, респираторной, гемической, гистотоксической) при перитоните способствует появлению отека мозга как следствия повышения проницаемости мембран. Клинически отек мозга последовательно проявляется эйфорией, церебральной депрессией, судорогами, комой – токсикогипоксической энцефалопатией.
Гипоксическая стимуляция симпатоадреналовой системы через реологические и микроциркуляторные нарушения способствует гиповолемии и снижению сердечного выброса, что вызывает распространение артериолоспазма и нарушений микроциркуляции в организме.
Гипоксия при перитоните – результат гиповентиляции, а потому к ней присоединяется гиперкапния. В сочетании с угнетением миокарда и нарушением сердечного ритма гиперкапния повышает степень гипоксии. Через бронхиолоспазм, повышение вязкости бронхиального секрета при снижении дренирующей функции бронхов гиперкапния приводит к снижению альвеолярной вентиляции. Паралитическая вазодилятация при гиперкапнии способствует нарушению мозгового кровообращения, внутричерепной гипертензии. Снижая мочеобразование в почках на фоне повышенных потерь иона К˙, гиперкапния способствует прогрессированию ионного дисбаланса.
Реакция организма на причинный фактор при развитии перитонита сопровождается усилением энергетических процессов, высоким уровнем катаболизма. В условиях голодания и гипоксии (субстратный дефицит) нарушаются аэробные пути окисления – циклы Кребса, Варбурга. Основным путем становится анаэробный гликолиз (I путь окисления, цикл ЭмбденаМейергофа) как путь быстрого, но крайне не экономичного, аварийного обеспечения энергетических потребностей организма. Тепловой дисбаланс проявляется гипертермией, еще более повышающей энергозатраты организма (на 10-20% при повышении на 1˚С).
Тепловой дисбаланс проявляется гипертермией, еще более повышающей энергозатраты организма (на 10-20% при повышении на 1˚С).
Гипертермия при перитоните обусловлена:
повышением | интенсивности | обмена | вследствие |
гиперкатехоламинемии; |
|
| |
нарушением процессов фосфорилирования и образования АТФ;
раздражением центра терморегуляции микробными и воспалительными пирогенами;
снижением теплоотдачи при централизации кровообращения.
Гипертермия приводит к:
гипервентиляции, ведущей к респираторному алкалозу;
тахикардии, увеличивающей сердечный выброс и периферическое сопротивление, с чем связано повышение артериального давления;
снижению активности ферментативных систем печени, нарастанию лактат-ацидоза;
выделению почками большого количества гипотоничной мочи;
нарастанию дегидратации за счет повышения перспирационных потерь жидкости, гипокалиемии.
Следствием длительной (свыше 10-12 часов) гипертермии являются функциональные и метаболические изменения в организме.
Изменения гидро-ионного баланса и осмолярности при перитоните возникают во внутри- и внеклеточном секторах по изоили гипотоническому типу. Метаболический ацидоз обусловлен снижением транспортной функции системы кровобращения и крови, гиповолемией, уменьшением поступления в организм субстратов и изменением соотношения окисляющихся субстратов. Повышение концентрации ионов Н˙ истощает буферные основания и приводит к возникновению декомпенсированного метаболического ацидоза. Метаболический алкалоз при перитоните связан с дефицитом ионов К˙, Cl’.
Основу патофизиологической сущности реактивной фазы можно представить как ответные реакции организма на локальное нарушение микроциркуляции в капилляроне брюшины. Патофизиологическую основу токсической фазы перитонита составляют ответные реакции на снижение и нарушение внутриорганного кровотока в неприоритарных органах (ЖКТ, печени, почках), терминальной фазы – нарушения микроциркуляции, центральной гемодинамики и изменения метаболизма.
КЛИНИКА, ТЕЧЕНИЕ И ДИАГНОСТИКА ПЕРИТОНИТА
В зависимости от вида причинного фактора, признаки перитонита появляются в 1-2-е сутки при деструктивных воспалительных заболеваниях органов брюшной полости, через несколько часов — при их травматическом повреждении. Достоверность наличия и вероятность выявления симптомов перитонита связаны с возрастом и фоновым состоянием больного, длительностью развития процесса, клинической формой перитонита и фазой адаптационного синдрома.
В клинической картине перитонита выделяем абдоминальный,
инфекционно-воспалительный и адаптационно-компенсаторный синдромы.
Рис.4. Перитонит новорожденного
(вздутие живота, пролабирование кожного пупка, фибрин на культе пуповины,
гиперемия кожи и усиление подкожного венозного рисунка брюшной стенки)
Абдоминальный синдром формируется как следствие нарушения местных тканевых защитных механизмов, реакций клеточного иммунитета. В зависимости от пускового фактора характеризуется:
видимыми признаками повреждения брюшной стенки;
изменением окраски кожи (гиперемия, пятна Мондора – участки цианоза), пастозностью, усилением подкожного венозного рисунка передней брюшной стенки у новорожденных;
нелокализованной болью в животе при выявляемой локальной болезненности;
пассивным защитным мышечным напряжением брюшной стенки;
симптомами раздражения (воспаления) брюшины;
симптомами объемного образования, наличия газа или жидкости в свободной брюшной полости.
Инфекционно-воспалительный синдром характеризуется:
наличием гипертермии;
симптома температурно-пульсовых «ножниц»;
нарушением сна, изменением поведения ребенка;
токсико-воспалительными изменениями в гемограмме, в анализе мочи;
признаками изменения общей и иммунной реактивности организма больного.
Адаптационный синдром складывается из совокупности клинических проявлений ответно-компенсаторных реакций, признаков функциональных нарушений органов и систем. В процессе развития перитонита формируются гастроэнтеропатический, гепаторенальный,
Что такое перитонит у детей и взрослых, значение его ранней диагностики и неотложного лечения
Содержание
Что такое перитонит? Пояснение для родителей и опекунов
Перитонит – это воспаление оболочки, покрывающей органы брюшной полости и окружающие их ткани. Это воспаление может быть вызвано бактериальной инфекцией, травмой или абдоминальной операцией. Симптомы перитонита включают сильную боль в животе, тошноту, рвоту, лихорадку и озноб. Если не лечить, перитонит может стать серьезным заболеванием, которое может привести к смерти.
Если не лечить, перитонит может стать серьезным заболеванием, которое может привести к смерти.
Родителям и опекунам важно знать о симптомах перитонита. Если у вашего ребенка или ребенка, находящегося на вашем попечении, проявляются какие-либо из перечисленных выше симптомов, важно немедленно обратиться за медицинской помощью. Лечение перитонита обычно включает антибиотики, внутривенное введение жидкости и, в некоторых случаях, хирургическое вмешательство. При ранней диагностике и лечении перитонит обычно успешно лечится.
Статья модерирована педиатром Dra. SARA FRANCES TARAZONA ( PEDIATRA en SAGUNTO)
Как диагностируется перитонит у детей и взрослых?
Перитонит – это воспаление оболочки, покрывающей органы брюшной полости и окружающие их ткани. Диагноз ставится на основании физического осмотра, анализов крови, рентгенографии, компьютерной томографии, УЗИ и лапароскопии.
У детей физикальное обследование включает осмотр области живота на наличие боли, вздутия, болезненности и новообразований. Врач также может провести тест на перистальтику кишечника, чтобы определить наличие жидкости в брюшной полости. Анализы крови могут помочь выявить наличие инфекции. Рентгеновские снимки, компьютерная томография и ультразвуковое исследование могут помочь определить наличие жидкости в брюшной полости. Лапароскопия — это хирургическая процедура, используемая для диагностики перитонита.
Врач также может провести тест на перистальтику кишечника, чтобы определить наличие жидкости в брюшной полости. Анализы крови могут помочь выявить наличие инфекции. Рентгеновские снимки, компьютерная томография и ультразвуковое исследование могут помочь определить наличие жидкости в брюшной полости. Лапароскопия — это хирургическая процедура, используемая для диагностики перитонита.
У взрослых физикальное обследование также включает осмотр области живота на наличие боли, вздутия живота, болезненности и объемных образований. Анализы крови могут помочь выявить наличие инфекции. Рентгеновские снимки, компьютерная томография и ультразвуковое исследование могут помочь определить наличие жидкости в брюшной полости. Лапароскопия также используется для диагностики перитонита у взрослых.
Почему важна ранняя диагностика перитонита?
Ранняя диагностика перитонита важна, поскольку она может помочь предотвратить серьезные и опасные для жизни осложнения. Перитонит – это воспаление оболочки, покрывающей органы брюшной полости и окружающие их ткани. Если его не лечить на ранней стадии, это может привести к сепсису, широко распространенному заражению кровотока, которое может привести к летальному исходу. Ранняя диагностика также может помочь сократить время восстановления и риск осложнений. Симптомы перитонита включают сильную боль в животе, тошноту, рвоту, лихорадку и озноб. При возникновении этих симптомов важно немедленно обратиться за медицинской помощью для правильной диагностики и лечения.
Если его не лечить на ранней стадии, это может привести к сепсису, широко распространенному заражению кровотока, которое может привести к летальному исходу. Ранняя диагностика также может помочь сократить время восстановления и риск осложнений. Симптомы перитонита включают сильную боль в животе, тошноту, рвоту, лихорадку и озноб. При возникновении этих симптомов важно немедленно обратиться за медицинской помощью для правильной диагностики и лечения.
Как лечится перитонит?
Перитонит – это воспаление оболочки, покрывающей органы брюшной полости и окружающие их ткани. Лечение перитонита зависит от основной причины. Лечение обычно включает использование антибиотиков для борьбы с инфекцией, а также операцию по дренированию жидкости из брюшной полости. В некоторых случаях для уменьшения воспаления и облегчения боли могут использоваться лекарства. Если перитонит вызван основным заболеванием, например раком, лечение может включать химиотерапию, лучевую терапию или хирургическое вмешательство.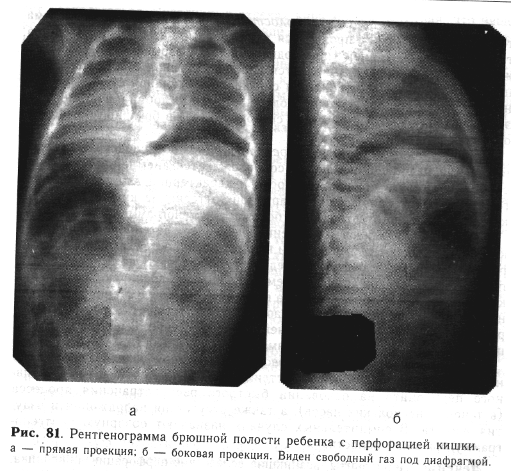 Лечение может также включать диетотерапию, чтобы помочь восстановить уровень питательных веществ в организме.
Лечение может также включать диетотерапию, чтобы помочь восстановить уровень питательных веществ в организме.
Какие осложнения могут возникнуть при перитоните, если его срочно не лечить?
Перитонит – это воспаление мембран, выстилающих органы брюшной полости и малого таза. Если не оказать неотложную помощь, могут возникнуть серьезные осложнения, включая сепсис, почечную недостаточность, диссеминированное внутрисосудистое свертывание крови, гипотензию, полиорганную недостаточность, перфорацию кишечника, внутрибрюшной абсцесс, некроз тканей и смерть. Кроме того, перитонит может привести к образованию спаек, представляющих собой полосы рубцовой ткани, которые образуются между органами брюшной полости, что может вызвать хроническую боль в животе и затруднить будущую операцию.
История болезни: первичный перитонит как начало детской болезни Менетрие
- Список журналов
- Фронт Педиатр
- PMC7838494
В качестве библиотеки NLM предоставляет доступ к научной литературе. Включение в базу данных NLM не означает одобрения или согласия с
Включение в базу данных NLM не означает одобрения или согласия с
содержание NLM или Национальных институтов здравоохранения.
Узнайте больше о нашем отказе от ответственности.
Передний педиатр. 2020; 8: 589853.
Опубликовано в сети 13 января 2021 г. doi: 10.3389/fped.2020.589853
, 1 , 1 , 1, 900 18 2 , 1 , 2 , 3 , 4 , 1 и 1, 2, *
Информация об авторе Примечания к статье Информация об авторских правах и лицензии Отказ от ответственности
- Дополнительные материалы
- Заявление о доступности данных
Введение: Первичный перитонит (ПП) и болезнь Менетрие (БМ) являются редкими состояниями среди детей. Хотя на сегодняшний день в научной литературе описано около 150 случаев МД, его начало при ПП является необычным состоянием.
Представление случая: Мы представляем случай 11-летнего мальчика, который был госпитализирован в наше отделение из-за болей в животе и вздутия живота. Дополнительные тесты показали асцит, двусторонний плеврит, лейкоцитоз, повышение острофазовых реактивов и гипопротеинемию с гипоальбуминемией. Лапароскопия исключила аппендицит или перфорацию внутренних органов и выявила гнойную перитонеальную жидкость, совместимую с ПП. Биохимический анализ кала показал повышенный клиренс альфа-1-антитрипсина, что соответствовало энтеропатии с потерей белка. Результаты гастроскопии были совместимы с MD. Клиническое течение было благоприятным, и у него не было рецидивов после 12 месяцев наблюдения.
Заключение: PP может быть первым клиническим проявлением МД у детей. Знание МД и его в целом доброкачественной природы у детей важно для того, чтобы избежать чрезмерного тестирования и ненужного лечения.
Ключевые слова: Болезнь Менетрие, белоктеряющая энтеропатия, гипертрофическая гастропатия, клинический случай, первичный перитонит . На его долю приходится 1–3% острых абдоминальных неотложных состояний у детей (1–4). Болезнь Менетрие (БМ) относительно распространена среди взрослых, но крайне редко встречается у детей: на сегодняшний день в научной литературе описано около 150 случаев (5–7). Мы представляем необычный случай ПП как начало БМ у мальчика.
На его долю приходится 1–3% острых абдоминальных неотложных состояний у детей (1–4). Болезнь Менетрие (БМ) относительно распространена среди взрослых, но крайне редко встречается у детей: на сегодняшний день в научной литературе описано около 150 случаев (5–7). Мы представляем необычный случай ПП как начало БМ у мальчика.
11-летний мальчик был осмотрен в педиатрическом отделении неотложной помощи в связи с 3-дневной историей боли и вздутия живота. Он был правильно вакцинирован, и в анамнезе у него не было интереса, за исключением самокупирующегося гастроэнтерита за 14 дней до начала этого эпизода.
Больной имел обычный вид за счет спонтанных болей, усиливающихся при движении, лихорадки (38,3°С) и тахикардии (124 уд/мин) при нормальном АД (104/62 мм рт.ст.). Было оценено увеличение на 3,5 кг по сравнению с его обычным весом. Физикальное обследование выявило незудящие эритематозные бляшки на животе, лобке и проксимальных сегментах обеих нижних конечностей (). При осмотре брюшной полости отмечалось вздутие живота, диффузная боль и болезненность. Нижняя часть спины болезненна при пальпации. У него имелись ямочные отеки на брюшной стенке, поясничной области и дистальных сегментах нижних конечностей. При аускультации легких выявлено ослабление везикулярного дыхания справа.
Нижняя часть спины болезненна при пальпации. У него имелись ямочные отеки на брюшной стенке, поясничной области и дистальных сегментах нижних конечностей. При аускультации легких выявлено ослабление везикулярного дыхания справа.
Открыть в отдельном окне
Физикальное обследование: вздутие живота и незудящие эритематозные бляшки на брюшной стенке (А) , лобке и проксимальных сегментах обеих нижних конечностей (В) .
Выполнена рентгенограмма брюшной полости, показывающая вероятное масс-эффект на петлях поперечной и нисходящей ободочной кишки без признаков обструкции. Рентгенограмма грудной клетки выявила правосторонний плеврит. КТ брюшной полости с контрастом была приоритетнее УЗИ, чтобы лучше охарактеризовать предполагаемое образование в брюшной полости. Он показал асцит, двусторонний плеврит, поясничный подкожный отек и ателектаз правой нижней доли с нормальным размером сердца (1). Анализ крови выявил повышенное количество лейкоцитов 37,48 × 10 9 . 0017 9 /л (нейтрофилы 34,30 × 10 9 /л), количество гемоглобина и тромбоцитов в пределах нормы, в мазке периферической крови отклонений нет. Повышение реагентов острой фазы (С-реактивный белок 345 мг/л, прокальцитонин 2,77 нг/мл), гипопротеинемия с гипоальбуминемией (4,2 г общего белка/дл при 1,9 г альбумина/дл) и гипогаммаглобулинемия (IgG 137 мг/дл, IgG -1 1060 мг/л, IgG-2 317 мг/л, IgG-3 139 мг/л, IgA 43 мг/л, другие изотипы в пределах нормы). Ионы, уровень амилазы, ферменты печени, показатели функции почек были в пределах нормы. Биологические параметры функции сердца, такие как тропонины и N-концевой прогормон натрийуретического пептида головного мозга (NT-pro-BNP), также были протестированы при обследовании асцита и плеврального выпота с нормальными результатами. Исследование мочи не выявило значительной протеинурии или гематурии.
0017 9 /л (нейтрофилы 34,30 × 10 9 /л), количество гемоглобина и тромбоцитов в пределах нормы, в мазке периферической крови отклонений нет. Повышение реагентов острой фазы (С-реактивный белок 345 мг/л, прокальцитонин 2,77 нг/мл), гипопротеинемия с гипоальбуминемией (4,2 г общего белка/дл при 1,9 г альбумина/дл) и гипогаммаглобулинемия (IgG 137 мг/дл, IgG -1 1060 мг/л, IgG-2 317 мг/л, IgG-3 139 мг/л, IgA 43 мг/л, другие изотипы в пределах нормы). Ионы, уровень амилазы, ферменты печени, показатели функции почек были в пределах нормы. Биологические параметры функции сердца, такие как тропонины и N-концевой прогормон натрийуретического пептида головного мозга (NT-pro-BNP), также были протестированы при обследовании асцита и плеврального выпота с нормальными результатами. Исследование мочи не выявило значительной протеинурии или гематурии.
Открыть в отдельном окне
КТ брюшной полости: асцит (A) , двусторонний плеврит (B) и поясничный подкожный отек (A) .
При первоначальном диагнозе перитонита и плеврального выпота было принято решение о госпитализации и начата внутривенная антибиотикотерапия цефотаксимом. Через 24 ч после госпитализации была проведена диагностическая лапароскопия, в ходе которой была обнаружена гнойная перитонеальная жидкость и исключен аппендицит или висцеральные перфорации. Рутинная аппендэктомия была выполнена без каких-либо аномальных анатомо-патологических данных. Таким образом, вторичный перитонит был исключен. Образцы асцитической жидкости исследовали на цитобиохимический анализ (562 клетки/мкл, 57% полиморфноядерных, рН 7,34, глюкоза 31 мг/дл, белок 0,12 г/дл, ЛДГ 32 ЕД/мл, триглицериды 54 мг/дл) и микробиологические исследования ( Окрашивание по Граму и аурамину, бактериальные и микобактериальные культуры, а также полимеразная цепная реакция на 9ДНК 0099 Mycobacterium tuberculosis были отрицательными). В связи с преобладанием в нашей среде метициллин-резистентного Staphylococcus aureus (~15%), был добавлен ванкомицин и назначено ограничение жидкости со строгим контролем водного баланса и суточного веса. При подозрении на ПП с гипопротеинемией дополнительные обследования исключали нефротический синдром, печеночную недостаточность, дефицит альфа-1-антитрипсина (α1-АТ), сахарный диабет, красную волчанку, лямблиоз, целиакию, туберкулез и иммунодефициты. Биохимический анализ кала показал повышенный уровень α1-АТ (1,9мг/г стула; референтное значение <0,3 мг/г) и повышенный клиренс α1-АТ (107,7 мл/24 ч; референтное значение <27 мл/24 ч), что совместимо с энтеропатией с потерей белка (ЭБЭ).
При подозрении на ПП с гипопротеинемией дополнительные обследования исключали нефротический синдром, печеночную недостаточность, дефицит альфа-1-антитрипсина (α1-АТ), сахарный диабет, красную волчанку, лямблиоз, целиакию, туберкулез и иммунодефициты. Биохимический анализ кала показал повышенный уровень α1-АТ (1,9мг/г стула; референтное значение <0,3 мг/г) и повышенный клиренс α1-АТ (107,7 мл/24 ч; референтное значение <27 мл/24 ч), что совместимо с энтеропатией с потерей белка (ЭБЭ).
У него было благоприятное клиническое течение с постепенным снижением воспалительных параметров, прогрессивным улучшением уровня сывороточного белка и гамма-глобулина, полной реабсорбцией плеврального выпота и перитонеальной жидкости при поступлении. Пациент прошел 21-дневную антибактериальную терапию (14 дней внутривенного введения цефотаксима и 10 дней внутривенного введения ванкомицина, а после выписки — 7 дней перорального приема амоксициллина-клавулановой кислоты).
Дальнейшие исследования по выявлению причины этого ЭПБ включали нормальную колоноскопию и гастроскопию, которые показали очень эритематозную и дискретно отечную слизистую оболочку и увеличенные желудочные складки в теле и дне желудка. Биопсия слизистой оболочки желудка выявила обширную и значительную гиперплазию фовеолярного слизисто-секреторного эпителия, что привело к удлинению и извитости фовеолярных желез с потерей париетальных клеток и отечностью собственной пластинки. Признаков лимфоплазмоцитарного или нейтрофильного инфильтрата, внутриэпителиального лимфоцитоза, включений патогенной микрофлоры или внутриклеточного цитомегаловируса (ЦМВ) не выявлено. Слизистая двенадцатиперстной кишки сохранена. Эти результаты были совместимы с MD. Гистохимическое исследование на Helicobacter pylori и иммуногистохимическое исследование на ЦМВ были отрицательными (). Серология ЦМВ также была отрицательной.
Биопсия слизистой оболочки желудка выявила обширную и значительную гиперплазию фовеолярного слизисто-секреторного эпителия, что привело к удлинению и извитости фовеолярных желез с потерей париетальных клеток и отечностью собственной пластинки. Признаков лимфоплазмоцитарного или нейтрофильного инфильтрата, внутриэпителиального лимфоцитоза, включений патогенной микрофлоры или внутриклеточного цитомегаловируса (ЦМВ) не выявлено. Слизистая двенадцатиперстной кишки сохранена. Эти результаты были совместимы с MD. Гистохимическое исследование на Helicobacter pylori и иммуногистохимическое исследование на ЦМВ были отрицательными (). Серология ЦМВ также была отрицательной.
Открыть в отдельном окне
(A) Удлиненные и извилистые (штопорообразные) фовеолярные железы с отечной ведущей пластинкой (H-E x200). (B) Кистозные и расширенные железы с потерей париетальных клеток (H-E x100). (C, D) Исследование на H. pilory и CMV у нашего пациента было отрицательным. (3. Уортин-Старри х100, 4. ЦМВ х100).
(3. Уортин-Старри х100, 4. ЦМВ х100).
Несмотря на первоначальную гипогаммаглобулинемию у нашего пациента, внутривенные иммуноглобулины не вводились для предотвращения риска новых гнойных бактериальных инфекций, поскольку у него наблюдалось хорошее клиническое развитие, а уровни гаммаглобулина и белка в его плазме спонтанно медленно увеличивались в течение следующих недель. Аналитический контроль, проведенный через 6 месяцев, показал полное восстановление уровня общего белка плазмы и альбумина. Уровень иммуноглобулинов нормализовался через 10 месяцев после госпитализации. После 12 мес наблюдения рецидива заболевания у пациентки не было. Краткое изложение его клинического течения показано в .
Открыть в отдельном окне
Хронология в днях клинических симптомов, лабораторных данных, процедур и лечения ПП и БМ.
Первичный перитонит, также называемый спонтанным бактериальным перитонитом (СБП), определяемый как бактериальный перитонит при отсутствии очевидного интраабдоминального очага инфекции, такого как перфорация кишечника, является нечастой причиной острого живота у детей (1, 2, 8–11). По данным ряда педиатрических исследований, чаще встречается у женщин (85–9 лет).5%) и в возрастной группе 4–9 лет (1, 2, 4, 12). Однако в данном случае речь шла о 11-летнем мальчике. Хотя большинство случаев у детей возникают спонтанно без фоновой патологии (1, 2, 8, 12), они связаны с заболеваниями, вызывающими гипопротеинемию и/или иммунодефицит, такими как нефротический синдром, заболевания печени, кишечная лимфома или дефицит α1-АТ (1, 2, 8, 12). 9, 11–13). Пациенты с вентрикулоперитонеальным шунтом, по-видимому, имеют более высокий риск развития СБП, поскольку спинномозговая жидкость может снижать бактериостатическую активность перитонеальной жидкости посредством различных механизмов (14). ПП также связан с расстройствами, вызывающими ЭПБ у взрослых (15). Наш случай – нечастый дебют МД с ПП у мальчика.
По данным ряда педиатрических исследований, чаще встречается у женщин (85–9 лет).5%) и в возрастной группе 4–9 лет (1, 2, 4, 12). Однако в данном случае речь шла о 11-летнем мальчике. Хотя большинство случаев у детей возникают спонтанно без фоновой патологии (1, 2, 8, 12), они связаны с заболеваниями, вызывающими гипопротеинемию и/или иммунодефицит, такими как нефротический синдром, заболевания печени, кишечная лимфома или дефицит α1-АТ (1, 2, 8, 12). 9, 11–13). Пациенты с вентрикулоперитонеальным шунтом, по-видимому, имеют более высокий риск развития СБП, поскольку спинномозговая жидкость может снижать бактериостатическую активность перитонеальной жидкости посредством различных механизмов (14). ПП также связан с расстройствами, вызывающими ЭПБ у взрослых (15). Наш случай – нечастый дебют МД с ПП у мальчика.
Наиболее частым клиническим проявлением ПП является острое начало болей в животе с перитонизмом или без него; в то время как лихорадка, рвота и диарея встречаются реже (1, 3, 9, 12). Околопупочная эритема является редким признаком перитонита (12), однако у нашего пациента изначально были эритематозные бляшки на животе, лобке и проксимальных сегментах обеих конечностей. Диагноз обычно подтверждается лапароскопией. В нашем случае были исключены панкреатит и поражение внутренних органов; гнойная перитонеальная жидкость исследовалась с ≥250 полиморфноядерных клеток/мм 3 и посев асцитической жидкости был отрицательным, вероятно, из-за предшествующего лечения антибиотиками. Все эти находки при отсутствии в анамнезе лечения антибиотиками в течение последних 30 дней были определены как культурально-негативный нейтрофилезный асцит (CNNA), разновидность СБП (16).
Околопупочная эритема является редким признаком перитонита (12), однако у нашего пациента изначально были эритематозные бляшки на животе, лобке и проксимальных сегментах обеих конечностей. Диагноз обычно подтверждается лапароскопией. В нашем случае были исключены панкреатит и поражение внутренних органов; гнойная перитонеальная жидкость исследовалась с ≥250 полиморфноядерных клеток/мм 3 и посев асцитической жидкости был отрицательным, вероятно, из-за предшествующего лечения антибиотиками. Все эти находки при отсутствии в анамнезе лечения антибиотиками в течение последних 30 дней были определены как культурально-негативный нейтрофилезный асцит (CNNA), разновидность СБП (16).
Культура асцитической жидкости отрицательна более чем в 50% образцов, на что может повлиять тот факт, что большинство пациентов получают антибиотики до диагностической хирургической процедуры (4, 8), как в нашем случае. В детском возрасте Streptococcus pneumoniae является наиболее часто выделяемым микроорганизмом, за которым следует стрептококк группы А (GAS) (3, 10, 12). ГАС ПП был идентифицирован как очаг 5% инвазивной инфекции ГАС у детей в Финляндии (17), и другие исследования показывают, что возможная связь между ГАС фарингитом и ПП у детей может существовать (3, 10). У пациента мазок из горла экспресс-тест на обнаружение антигена (RADT) для GAS и культура были отрицательными. Исследование показало высокую чувствительность и специфичность RADT для GAS, выполненного на глубоких тканях, включая перитонеальную жидкость (18), хотя в данном случае оно не проводилось. Другие описанные микроорганизмы Escherichia coli, Klebsiella pneumoniae, Enterococcus spp., Staphylococcus aureus и некоторые вирусы (1, 9, 13, 19). Измерение кальпротектина и микроРНК-155 в асцитической жидкости можно использовать в качестве биомаркеров бактериальной инфекции асцитической жидкости (20). Обнаружение антигенов пневмококковой капсулы с помощью иммунохроматографии и полимеразной цепной реакции (традиционная или мультиплексная для бактерий и вирусов, а также амплификация и секвенирование 16S рРНК) использовались для микробиологического анализа в образцах с отрицательной культурой (21, 22).
ГАС ПП был идентифицирован как очаг 5% инвазивной инфекции ГАС у детей в Финляндии (17), и другие исследования показывают, что возможная связь между ГАС фарингитом и ПП у детей может существовать (3, 10). У пациента мазок из горла экспресс-тест на обнаружение антигена (RADT) для GAS и культура были отрицательными. Исследование показало высокую чувствительность и специфичность RADT для GAS, выполненного на глубоких тканях, включая перитонеальную жидкость (18), хотя в данном случае оно не проводилось. Другие описанные микроорганизмы Escherichia coli, Klebsiella pneumoniae, Enterococcus spp., Staphylococcus aureus и некоторые вирусы (1, 9, 13, 19). Измерение кальпротектина и микроРНК-155 в асцитической жидкости можно использовать в качестве биомаркеров бактериальной инфекции асцитической жидкости (20). Обнаружение антигенов пневмококковой капсулы с помощью иммунохроматографии и полимеразной цепной реакции (традиционная или мультиплексная для бактерий и вирусов, а также амплификация и секвенирование 16S рРНК) использовались для микробиологического анализа в образцах с отрицательной культурой (21, 22). но в нашем случае эти приемы не применялись.
но в нашем случае эти приемы не применялись.
Цефотаксим считается антибиотиком выбора (1, 9, 12). В нашем случае в связи с отрицательным посевом перитонеальной жидкости и 15%-ным преобладанием метициллин-резистентного Staphylococcus aureus в нашем районе к цефотаксиму был добавлен ванкомицин. Рекомендуемая продолжительность лечения антибиотиками составляет 10–14 дней для Streptococcus (9, 10, 19) и 10 дней–3 недели для грамотрицательных микроорганизмов (19). В данном случае, поскольку микробиологическая характеристика была невозможна, пациент получил 3 недели лечения антибиотиками. Клиническое течение при своевременном выявлении и лечении в большинстве случаев благоприятное (8, 12).
Болезнь Менетрие — очень редкое ЛЭ у детей. Со времени первого случая МД, представленного в 1888 г. (23), было зарегистрировано около 150 случаев в детском возрасте (5–7). МД характеризуется гипоальбуминемией, вторичной по отношению к потере белка через слизистую оболочку желудочно-кишечного тракта, что приводит к периферическим отекам, асциту или даже анасарке (7, 23, 24). Асцит в сочетании с гипогаммаглобулинемией создает благоприятную обстановку для развития ПП. Во многих ранее зарегистрированных случаях БМ, включая этот, продромальный период болей в животе, анорексии и рвоты описывается примерно за 1 или 2 недели до проявления (5, 6, 25). Считается, что это связано с раздражением слизистой оболочки желудка и гибелью эпителиальных клеток во время первоначального воздействия неизвестного повреждающего агента (5). Большинство педиатрических исследований, по-видимому, указывают на инфекционную этиологию, основанную на наличии антител к ЦМВ в сыворотке или их идентификации в биопсии желудка, и на самокупирующееся течение (средняя продолжительность 5 недель) (5, 6, 24–26). ).
Асцит в сочетании с гипогаммаглобулинемией создает благоприятную обстановку для развития ПП. Во многих ранее зарегистрированных случаях БМ, включая этот, продромальный период болей в животе, анорексии и рвоты описывается примерно за 1 или 2 недели до проявления (5, 6, 25). Считается, что это связано с раздражением слизистой оболочки желудка и гибелью эпителиальных клеток во время первоначального воздействия неизвестного повреждающего агента (5). Большинство педиатрических исследований, по-видимому, указывают на инфекционную этиологию, основанную на наличии антител к ЦМВ в сыворотке или их идентификации в биопсии желудка, и на самокупирующееся течение (средняя продолжительность 5 недель) (5, 6, 24–26). ).
Повышенные значения α1-АТ и его клиренс в изолированных образцах фекалий указывают на диагноз ЭПБ, причем последний является более точным методом. α1-АТ представляет собой антипротеолитический белок плазмы, отсутствует в пищевых продуктах, за исключением грудного молока, и синтезируется в печени. Хотя он может быть разрушен при pH ниже 3 (27), как это происходит в желудке, он не расщепляется кишечными протеазами и не реабсорбируется, поэтому его определение в кале является точным маркером проникновения альбумина в кишечник. просвет кишечника, являясь отличным маркером PLE (28). Определение α1-АТ не считается подходящим методом у детей, находящихся на грудном вскармливании, и его значение может быть ложно заниженным, если ранитидин или ингибиторы протонной помпы (ИПП) не используются, когда утечка белка происходит в основном через слизистую оболочку желудка (27, 28). Наш пациент не получал ранитидин или ИПП, что свидетельствует об очень высокой потере белка желудочным соком или его просачивании через другие участки желудочно-кишечного тракта.
Хотя он может быть разрушен при pH ниже 3 (27), как это происходит в желудке, он не расщепляется кишечными протеазами и не реабсорбируется, поэтому его определение в кале является точным маркером проникновения альбумина в кишечник. просвет кишечника, являясь отличным маркером PLE (28). Определение α1-АТ не считается подходящим методом у детей, находящихся на грудном вскармливании, и его значение может быть ложно заниженным, если ранитидин или ингибиторы протонной помпы (ИПП) не используются, когда утечка белка происходит в основном через слизистую оболочку желудка (27, 28). Наш пациент не получал ранитидин или ИПП, что свидетельствует об очень высокой потере белка желудочным соком или его просачивании через другие участки желудочно-кишечного тракта.
Окончательный диагноз БМ ставится с помощью визуализирующих исследований, таких как эндоскопия, исследования с барием или УЗИ, показывающих фовеолярную гиперплазию с железистой атрофией, связанной с увеличением складок желудка, а также биопсию желудка с гипертрофией желудка и гиперплазией эпителия при микроскопии, преимущественно в области дна и желудка тело (5, 7, 29), как и в нашем случае. Другие находки включают утолщение слизистой оболочки желудка с уменьшением основных и париетальных клеток наряду с базальной кистозной дилатацией желудочных желез, что может способствовать потере белка на желудочно-кишечном уровне и впоследствии привести к глубокой гипоальбуминемии (5, 7, 29).). Изменения, описанные в гистологии, могут быть вызваны некоторыми инфекционными агентами. Наиболее частым является ЦМВ (5–7, 25, 26), за которым следует H. pylori (7, 26, 30). Другими менее распространенными являются Mycoplasma pneumoniae (31), Giardia lamblia и вирус герпеса (29). Однако у нашего пациента не было обнаружено никаких признаков заражения ЦМВ, H. pylori или другими микроорганизмами.
Другие находки включают утолщение слизистой оболочки желудка с уменьшением основных и париетальных клеток наряду с базальной кистозной дилатацией желудочных желез, что может способствовать потере белка на желудочно-кишечном уровне и впоследствии привести к глубокой гипоальбуминемии (5, 7, 29).). Изменения, описанные в гистологии, могут быть вызваны некоторыми инфекционными агентами. Наиболее частым является ЦМВ (5–7, 25, 26), за которым следует H. pylori (7, 26, 30). Другими менее распространенными являются Mycoplasma pneumoniae (31), Giardia lamblia и вирус герпеса (29). Однако у нашего пациента не было обнаружено никаких признаков заражения ЦМВ, H. pylori или другими микроорганизмами.
КТ брюшной полости обычно показывает трансмуральное утолщение желудка в области дна и тела с аномально утолщенными желудочными складками (7, 24). После постановки окончательного диагноза БМ КТ-изображения были тщательно просмотрены радиологами, которые заметили некоторые выступающие желудочные складки в области большой кривизны желудка, но они также отметили, что КТ не была выполнена в идеальных условиях для оценки типичных изображений. МД.
МД.
В педиатрической популяции лечение БД является поддерживающим и включает высокобелковую диету и анальгетики (5–7, 24). Некоторым пациентам могут потребоваться ИПП, антихолинергические стероиды, диуретики (5–7, 24), внутривенные иммуноглобулины (30) и даже инфузии альбумина в случаях тяжелой и длительной гипоальбуминемии (24, 32). Противовирусное лечение валганцикловиром или ганцикловиром может быть рассмотрено при доказанной ЦМВ-инфекции у детей с иммунодефицитом или если заболевание сохраняется более 2-4 недель (5, 6, 24, 32). Кроме того, цетуксимаб, моноклональное антитело, которое блокирует передачу сигналов рецептора эпидермального фактора роста (EGFR), успешно применялся у взрослых пациентов (33).
Учитывая благоприятное течение и частое самопроизвольное разрешение заболевания, прогрессивное восстановление уровня белка и иммуноглобулинов в крови и отсутствие новых инвазивных инфекций, от внутривенного введения иммуноглобулинов в нашем случае отказались (34, 35). В педиатрической популяции МД является самокупирующимся, с хорошим прогнозом и отсутствием тенденции к рецидивам. В нашем случае пациент не нуждался в дополнительном лечении и до настоящего времени не предъявлял новых симптомов. С другой стороны, МД у взрослых обычно протекает хронически, с тенденцией к малигнизации, иногда требуя агрессивного лечения, такого как гастрэктомия (5–7, 26, 33).
В педиатрической популяции МД является самокупирующимся, с хорошим прогнозом и отсутствием тенденции к рецидивам. В нашем случае пациент не нуждался в дополнительном лечении и до настоящего времени не предъявлял новых симптомов. С другой стороны, МД у взрослых обычно протекает хронически, с тенденцией к малигнизации, иногда требуя агрессивного лечения, такого как гастрэктомия (5–7, 26, 33).
В заключение, хотя и редко встречающийся у здоровых детей, ПП представляет собой потенциально опасный для жизни процесс, который следует включать в дифференциальную диагностику острой абдоминальной боли, особенно если она связана с отеком. Как показано в этом клиническом случае, ПП и МД могут сосуществовать у детей, хотя клиническое начало в этом случае, по-видимому, связано с ПП. Знание МД и его в целом доброкачественной природы у детей важно, чтобы избежать ненужных дополнительных тестов или лечения.
Оригинальные вклады, представленные в исследовании, включены в статью/дополнительные материалы, дальнейшие запросы можно направлять соответствующему автору/ам.
Письменное информированное согласие было получено от законного опекуна несовершеннолетнего на публикацию любых потенциально идентифицируемых изображений или данных, включенных в эту статью.
JB-M, EC-G и CM-C разработали первоначальную рукопись, критически рассмотрели и отредактировали окончательную рукопись. AB-F, AP-L и CF-L подготовили первоначальную рукопись, рассмотрели и отредактировали окончательную рукопись. CQ-T и AM-N разработали первоначальную рукопись, выполнили биохимические и патологические процедуры соответственно, а также рассмотрели и отредактировали рукопись. Все авторы предоставили критические отзывы, одобрили окончательный вариант представленной рукописи, согласились нести ответственность за все аспекты работы и обеспечили надлежащее расследование и решение вопросов, связанных с точностью или целостностью любой части работы.
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Мы благодарим пациента и его семью за разрешение использовать данные.
90 185
901 86 экспресс-тест на обнаружение антигена
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www. frontiersin.org/articles/10.3389/fped.2020.589853/full#supplementary-material
frontiersin.org/articles/10.3389/fped.2020.589853/full#supplementary-material
Щелкните здесь, чтобы просмотреть файл с дополнительными данными. (873K, PDF)
1. Хилджи М.Ф. Первичный перитонит — забытое явление. Eur J Pediatric Surg Rep. (2015) 3: 27–9. 10.1055/s-0034-1374544 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
2. Maraki S, Spathopoulou T, Ntaoukakis M, Vlachakis J. Первичный пневмококковый перитонит у иммунокомпетентного ребенка. Braz J Infect Dis. (2012) 16:107–8. 10.1016/S1413-8670(12)70287-8 [PubMed] [CrossRef] [Google Scholar]
3. Sharp EA, Linn A, Zitelli BJ. Стрептококковый фарингит группы А, ассоциированный с первичным перитонитом. BMJ Case Rep. (2019) 12:e229186. 10.1136/bcr-2019-229186 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
4. Фаулер Р. Первичный перитонит: изменяющиеся аспекты, 1956–1970 гг. J Педиатр Здоровье ребенка. (1971) 7:73–83. 10.1111/j.1440-1754.1971.tb02202.x [PubMed] [CrossRef] [Google Scholar]
5. Williamson K, Park HK, Schacht R, Kaistha A. Случай болезни Менетрие у ребенка. Педиатр Неотложная помощь. (2012) 28:277–9. 10.1097/PEC.0b013e31824957b8 [PubMed] [CrossRef] [Google Scholar]
Williamson K, Park HK, Schacht R, Kaistha A. Случай болезни Менетрие у ребенка. Педиатр Неотложная помощь. (2012) 28:277–9. 10.1097/PEC.0b013e31824957b8 [PubMed] [CrossRef] [Google Scholar]
6. Blackstone MM, Mittal MK. Отечный малыш: случай педиатрической болезни Менетрие. Педиатр Неотложная помощь. (2008) 24:682–4. 10.1097/PEC.0b013e3181887e89 [PubMed] [CrossRef] [Google Scholar]
7. Barbati F, Marrani E, Indolfi G, Lionetti P, Trapani S. Болезнь Менетрие и цитомегаловирусная инфекция в детском возрасте: отчет о трех случаях и обзор литературы. Eur J Педиатр. (2020). 10.1007/s00431-020-03782-6. [Epub перед печатью]. [PubMed] [CrossRef] [Google Scholar]
8. Kimber CP, Hutson JM. Первичный перитонит у детей. ANZ J Surg. (1996) 66:169–70. 10.1111/j.1445-2197.1996.tb01149.x [PubMed] [CrossRef] [Google Scholar]
9. Johnson CC, Baldessarre J, Levison ME. Перитонит: обновленная информация о патофизиологии, клинических проявлениях и лечении. Клин Инфекция Дис. (1997) 24:1035–45. 10.1086/513658 [PubMed] [CrossRef] [Google Scholar]
(1997) 24:1035–45. 10.1086/513658 [PubMed] [CrossRef] [Google Scholar]
10. Haskett H, Delair S, Neemann K. Первичный стрептококковый перитонит группы А у ранее здоровой девочки-подростка. Глоб Педиатр Здоровье. (2020) 7:2333794X2095764. 10.1177/2333794X20957647 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
11. Ghoshal UC, Poddar U, Yachha SK. Спонтанный бактериальный перитонит у ребенка с абдоминальной лимфомой. Акта Онкол. (1995) 34:531. 10.3109/02841869509094019 [PubMed] [CrossRef] [Google Scholar]
12. Zhou H, Cheng W.
Первичный перитонит у детей. Энн Колл Сур Гонконг. (2000) 4:53–6. 10.1046/j.1442-2034.2000.00049.x [CrossRef] [Google Scholar]
13. Graham JC, Moss PJ, McKendrick MW. Первичный стрептококковый перитонит группы А. Scand J Infect Dis. (1995) 27:171–2. 10.3109/0036554950
01 [PubMed] [CrossRef] [Google Scholar]
14. Gaskill SJ, Marlin AE. Спонтанный бактериальный перитонит у больных с вентрикулоперитонеальными шунтами. Педиатр Нейрохирург. (1997) 26:115–9. 10.1159/000121175 [PubMed] [CrossRef] [Google Scholar]
Педиатр Нейрохирург. (1997) 26:115–9. 10.1159/000121175 [PubMed] [CrossRef] [Google Scholar]
15. Ploddi A, Atisook K, Hargrove NS. Кишечные лимфангиэктазии при интраабдоминальном туберкулезе. J Med Assoc Thai. (1988) 71:518–23. [PubMed] [Google Scholar]
16. Runyon BA, Hoefs JC. Культурально-негативный нейтрофильный асцит: вариант спонтанного бактериального перитонита. Гепатология. (1984) 4:1209–11. 10.1002/hep.1840040619 [PubMed] [CrossRef] [Google Scholar]
17. Tapiainen T, Launonen S, Renko M, Saxen H, Salo E, Korppi M, et al. Инвазивные стрептококковые инфекции группы А у детей: a общенациональный опрос в Финляндии. Pediatr Infect Dis J. (2016) 35: 123–8. 10.1097/INF.0000000000000945 [PubMed] [CrossRef] [Google Scholar]
18. Газзано В., Бергер А., Бенито Ю., Фрейдьер А.М., Тристан А., Буассет С. и др.. Переоценка роли быстрых тестов обнаружения антигена в диагностике инвазивных стрептококковых инфекций группы А. Дж. Клин Микробиол. (2016) 54:994–9. 10. 1128/JCM.02516-15 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
1128/JCM.02516-15 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Clark JH, Fitzgerald JF, Kleiman MB. Спонтанный бактериальный перитонит. J Педиатр. (1984) 104:495–500. 10.1016/S0022-3476(84)80536-3 [PubMed] [CrossRef] [Google Scholar]
20. Nabiel Y, Barakat G, Abed S. Сывороточный CD64 и асцитическая жидкость кальпротектин и микроРНК-155 как потенциальные биомаркеры спонтанного бактериального перитонита. Eur J Гастроэнтерол Гепатол. (2019) 31:1064–9. 10.1097/MEG.0000000000001443 [PubMed][CrossRef][Google Scholar]
21. Молинос Л. Обнаружение антигенов в моче. Арка Бронконемол. (2006) 42:101–3. 10.1016/S1579-2129(06)60126-2 [PubMed] [CrossRef] [Google Scholar]
22. Даган Р., Шрайкер О., Хазан И. и др.. Проспективное исследование для определения клинической значимости обнаружения ДНК пневмококка в сыворотки детей методом ПЦР. Дж. Клин Микробиол. (1998) 36:669–73. 10.1128/JCM.36.3.669-673.1998 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
23. Ménétrier P.
Ménétrier P.
Des polyadenomes gastriques et de leurs rapports avec le рак де I’Estomac. Арх Физиол Норм Патол. (1888) 32: 236–62. [Google Scholar]
24. Fouda A, Kamath B, Chung C, Punnett A. Болезнь Менетрие (гастропатия с потерей белка) у ребенка с острым лимфобластным лейкозом. Int J Pediatr Adolesc Med. (2019) 6:38–40. 10.1016/j.ijpam.2019.01.002 [бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
25. Sferra TJ, Pawel BR, Qualman SJ, Li BUK. Детская болезнь Менетрие: роль цитомегаловируса и трансформирующего фактора роста альфа. J Педиатр. (1996) 128:213–9. 10.1016/S0022-3476(96)70392-X [PubMed] [CrossRef] [Google Scholar]
26. Кирберг Б.А., Родригес В.Б., Доносо В.Ф., Кирхман Т.М., Нориэль В.М. Гипертрофическая гастропатия с потерей белка: болезнь Менетрие. Клинический случай. Преподобный Чил Педиатрия. (2014) 85:80–5. 10.4067/S0370-41062014000100011 [PubMed] [CrossRef] [Google Scholar]
27. Reinhart WH, Weigand K, Kappeler M, Roesler H, Halter F. Сравнение желудочно-кишечных потерь альфа-1-антитрипсина и хром-51-альбумина при болезни Менетрие и влияние ранитидина. пищеварение. (1983) 26:192–6. 10.1159/000198889 [PubMed] [CrossRef] [Google Scholar]
Сравнение желудочно-кишечных потерь альфа-1-антитрипсина и хром-51-альбумина при болезни Менетрие и влияние ранитидина. пищеварение. (1983) 26:192–6. 10.1159/000198889 [PubMed] [CrossRef] [Google Scholar]
28. Sierra C, Vicioso M, Barco A.
Протеиновая энтеропатия. Detección у causas más frecuentes. Анальная педиатрия. (2001) 54:36–8. [Google Scholar]
29. Фернандес Кааманьо Б., Рамос Болуда Э., Мартинес-Охинага Нодаль Э., Молина Ариас М., Сарриа Осес Х., Прието Бозано Г. Энфермедад де Менетриер, связанный с инфекцией цитомегаловируса. Анальная педиатрия. (2015) 82:e113–6. 10.1016/j.anpedi.2014.02.019[PubMed] [CrossRef] [Google Scholar]
30. Ивама И., Кагимото С., Такано Т., Секидзима Т., Кисимото Х., Оба А. Случай детской болезни Менетрие с цитомегаловирусом и коинфекцией Helicobacter pylori . Педиатр Междунар. (2010) 52:200–3. 10.1111/j.1442-200X.2010.03130.x [PubMed] [CrossRef] [Google Scholar]
31. Бен Амитай Д., Захави И., Динари Г., Гарти Б. З. Транзиторная гипертрофическая гастропатия с потерей белка, связанная с инфекцией Mycoplasma pneumoniae в детском возрасте. J Pediatr Gastroenterol Nutr. (1992) 14:237–9. 10.1097/00005176-199202000-00021 [PubMed] [CrossRef] [Google Scholar]
З. Транзиторная гипертрофическая гастропатия с потерей белка, связанная с инфекцией Mycoplasma pneumoniae в детском возрасте. J Pediatr Gastroenterol Nutr. (1992) 14:237–9. 10.1097/00005176-199202000-00021 [PubMed] [CrossRef] [Google Scholar]
32. Faure C, Besnard M, Hirsch A, Mougenot JF, Peuchmaur M, Cezard JP и др. Хроническая гипертрофическая гастропатия у ребенка, напоминающего болезнь Менетрие взрослых. J Pediatr Gastroenterol Nutr. (1996) 23:419–21. 10.1097/00005176-199611000-00010 [PubMed] [CrossRef] [Google Scholar]
33. Карлсен А., Гримштад Т.Б., Карлсен Л.Н., Греве О.Дж . Клин Дж. Гастроэнтерол. (2019) 12:562–5. 10.1007/s12328-019-00994-8 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
34. Patuzzo G, Tinazzi E, Micheletti M, Puccetti A, Lunardi C. Вторичная гипогаммаглобулинемия при болезни Вальдмана при лечении подкожные иммуноглобулины. Eur Ann Allergy Clin Immunol. (2016) 48:55–7. [PubMed] [Google Scholar]
35. Compagno N, Malipiero G, Cinetto F, Agostini C. Заместительная терапия иммуноглобулином при вторичной гипогаммаглобулинемии. Фронт Иммунол. (2014) 5:626. 10.3389/fimmu.2014.00626 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Заместительная терапия иммуноглобулином при вторичной гипогаммаглобулинемии. Фронт Иммунол. (2014) 5:626. 10.3389/fimmu.2014.00626 [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Статьи из Frontiers in Pediatrics предоставлены здесь с разрешения Frontiers Media SA
Перитонит у детей | Vinmec
Это автоматически переведенная статья.
Статья написана доктором Ле Ван Бинхом, отделение интенсивной терапии, Международная больница общего профиля Vinmec Times City.
Перитонит — это покраснение и отек (воспаление) тканей, выстилающих брюшную полость или брюшную полость. Эта ткань называется брюшиной. Это может быть смертельным заболеванием, если не лечить быстро и должным образом. Заболевание встречается не только у взрослых, но и у детей.
1. Обзор перитонита
Перитонит – воспаление париетально-висцеральной брюшины, обусловленное инфекционными или неинфекционными причинами.
Перитонит включает:
Первичный перитонит. Вторичный перитонит. Комбинированный перитонит (больной на гемодиализе). Причинами перитонита могут быть:
Инфекция: Перфорация желудочно-кишечного тракта, травма, первичная. Неинфекционные: абдоминальная асептическая хирургия, истечение стерильной жидкости в брюшную полость, редкое заболевание,…
2. Клинические проявления
2.1. Функция
Боль в животе: Боль распространяется по всему животу (на ранних стадиях, в зависимости от причины, может быть локализованной). Рвота и тошнота.
2.2. Тело
Симптомы инфекции: Высокая температура, утомляемость, при истощении больного может не быть лихорадки или субфебрилитет. Электролитная дегидратация: Сухость губ, сухость кожи, жажда,… Интоксикация: Утомляемость, бледность кожных покровов, бледность, вялость,… Пульс, АД: Частый, малый пульс, АД часто падает, Могут быть признаки шока.
2.3. Сущность
Вздутие живота различной степени, от легкого до сильного. Живот малоподвижен при дыхании, иногда не двигается, у детей старшего возраста могут плавать мышцы брюшной стенки. Пальпация брюшной стенки: Живот частично или полностью ригидный.
Живот малоподвижен при дыхании, иногда не двигается, у детей старшего возраста могут плавать мышцы брюшной стенки. Пальпация брюшной стенки: Живот частично или полностью ригидный.
Реакция брюшной стенки (+). Чем глубже, тем больнее.
Перитонеальная индукция часто происходит на поздней стадии.
Перкуссия брюшной полости: Обычно низкая мутность. Ректальное исследование: мешок Дугласа полный и болезненный. Люмбальная пункция: Часто бывает мутная жидкость, гной, желчь, кровь,… в зависимости от причины перитонита.
3. Субклинические
3.1. Тест
Лейкоциты крови повышены, нейтрофилы повышены. Гемоконцентрация (может произойти или не произойти). Перитонеальные лейкоциты >250 полиморфноядерных лейкоцитов/мл. Посев перитонеальной жидкости, ПЦР с бактериями.
Xét nghiệm mau giup chẩn đoán viêm phúc mạc.
3.2. Анализ изображений
УЗИ: можно увидеть брюшную жидкость, причину перитонита. Рентгенограмма брюшной полости: непрозрачная брюшная полость, стенка кишки утолщена, петли кишки расширены.
Признак Лорелла: слой жидкости между брюшной стенкой и восходящей и нисходящей ободочной кишкой.
Возможная причина перитонита.
4. Диагностика
4.1. Выполнение квадрантов
Клиническая боль в животе
Спастичность брюшной стенки (реакция брюшной стенки).
Перитонеальная индукция.
Ректальное исследование: выбухание болезненного дугласова пространства.
Субклинические: лейкоциты >250 полиморфноядерных лейкоцитов/мл являются наиболее важным критерием инфекционного перитонита. Повышенные лейкоциты: увеличивается скорость нейтрофилов.
Симптомы, специфичные для каждой причины: перфорация внутренних органов, первичный перитонит, билиарный перитонит.
4.2. Дифференциальный диагноз
Травма брюшной стенки. Другие инфекции и отравления: особенно желудочно-кишечного тракта.
5. Лечение
Принципы лечения:
Первичный перитонит обычно требует только медикаментозного лечения, включающего: Жидкостную регидратацию, водно-электролитную коррекцию, кислотно-щелочное.
Антибиотики: широкий спектр, предпочтительна чувствительность к грамотрицательным возбудителям. Метронидазол анаэробный антибиотик.
Вторичный перитонит: Обычно для лечения причины перитонита требуется комбинированное хирургическое лечение.
Перитонит – опасное заболевание, которое может привести к тяжелым последствиям и сопряжено с высоким риском летального исхода. Поэтому при появлении у ребенка аномальных признаков родителям необходимо немедленно отвезти ребенка в медицинское учреждение для обследования.
Международная многопрофильная больница Vinmec — одна из больниц, которая не только обеспечивает профессиональное качество благодаря команде ведущих врачей, современному оборудованию и технологиям, но и отличается своими услугами по обследованию и консультациям. всестороннее и профессиональное медицинское консультирование и лечение; цивилизованное, вежливое, безопасное и стерильное помещение для медицинского осмотра и лечения.
Пожалуйста, наберите
ГОРЯЧАЯ ЛИНИЯ
для получения дополнительной информации или регистрации на прием ЗДЕСЬ .

 Вторичный перитонит
Вторичный перитонит 3.
3.