Обменная нефропатия у детей: Дисметаболическая нефропатия у детей — причины, симптомы, методы диагностики и лечения детских болезней в «СМ-Клиника» для детей и подростков
Дисметаболические нефропатии в педиатрической практике | #08/10
Синдром обменной нефропатии является одной из актуальных и спорных проблем современной педиатрии. Причем сегодня, по статистическим данным, отмечается повсеместный рост обменных нарушений в почках. Так, обменная нефропатия составляет от 27% до 64% в структуре заболеваемости мочевыделительной системы у детей, а в повседневной практике врача-педиатра синдром обменных нарушений в моче отмечается практически у каждого третьего больного. Необходимо отметить, что дисметаболическая или обменная нефропатия не является отдельной нозологической единицей, а по своей сути — это синдромальное состояние и включает в себя большую группу нефропатий различной этиологии и патогенеза (Е79 — нарушение обмена пуринов, Е74.8 — оксалоз, оксалурия, Е83.8 — другие нарушения минерального обмена), объединенных тем, что их развитие связано с различными нарушениями обмена веществ, приводящих к появлению кристаллического осадка в моче и как следствие этого к повреждению почечных структур и других уровней мочевыделительной системы.
Хорошо известно, что моча в норме представляет собой перенасыщенный солевой раствор, находящийся в состоянии динамического равновесия за счет веществ, которые способствуют растворению или дисперсии составных частей мочи. Процесс образования кристаллов в мочевых путях представляет процесс, в основе которого лежат нарушения коллоидного равновесия в тканях организма и в почечной паренхиме. То есть можно говорить о нарушении равновесия между повреждающими (предрасполагающими) и защитными факторами.
Предрасполагающие факторы делятся на две большие группы — экзогенные и эндогенные. К экзогенным относятся: климатические (сухой и жаркий климат), особенности состава питьевой воды (высокая жесткость), уровень солнечной радиации, содержание микро- и макроэлементов во внешней среде (недостаток магния, йода, избыток кальция, стронция), особенности пищевого режима (дефицит витаминов А, В6, РР, гипервитаминоз D, избыточное употребление продуктов, богатых белком, пуринами, щавелевой кислотой, недостаточное употребление продуктов, содержащих ненасыщенные жирные кислоты), недостаточность питьевого режима, частое посещение сауны, прием алкоголя, лекарственные воздействия (сульфаниламиды, диуретики, цитостатики). Эндогенные факторы: врожденные аномалии почек и мочевыводящих путей, особенно с нарушением оттока мочи, воспалительные процессы в почках и по ходу мочевых путей, нарушение водно-солевого обмена при гиперпаратиреозе, повышенные потери воды при экстраренальных потерях, интенсивных мышечных нагрузках, нарушение обмена кальция (вымывание кальция из костей в кровь) при длительном постельном режиме или иммобилизации, увеличение всасывания кальция и оксалатов при повышенной проницаемости кишечной стенки (пищевая аллергия, воспалительные процессы в кишечнике), наследственные варианты нарушения обмена веществ.
Эндогенные факторы: врожденные аномалии почек и мочевыводящих путей, особенно с нарушением оттока мочи, воспалительные процессы в почках и по ходу мочевых путей, нарушение водно-солевого обмена при гиперпаратиреозе, повышенные потери воды при экстраренальных потерях, интенсивных мышечных нагрузках, нарушение обмена кальция (вымывание кальция из костей в кровь) при длительном постельном режиме или иммобилизации, увеличение всасывания кальция и оксалатов при повышенной проницаемости кишечной стенки (пищевая аллергия, воспалительные процессы в кишечнике), наследственные варианты нарушения обмена веществ.
Защитные факторы
К защитным факторам относятся вещества, которые удерживают соли в растворенном состоянии, зачастую они называются защитными коллоидами. Эти вещества частично представлены в плазме крови, фильтруются в первичную и окончательную мочу, секретируются канальциевым эпителием. Кроме того, размеры коллоидных частиц мочи определяются биологически активными веществами — трипсином, пепсином, катепсинами и другими. Их действие опосредуется через рН-среды, влиянием активаторов и ингибиторов. Таким образом, при недостаточности факторов защиты, превалировании предрасполагающих факторов и на фоне разрешающего воздействия (инфекции, травмы, прием лекарств, дефицит жидкости и т. п.) начинается процесс кристаллообразования и как крайняя степень выраженности — процесс камнеобразования.
Их действие опосредуется через рН-среды, влиянием активаторов и ингибиторов. Таким образом, при недостаточности факторов защиты, превалировании предрасполагающих факторов и на фоне разрешающего воздействия (инфекции, травмы, прием лекарств, дефицит жидкости и т. п.) начинается процесс кристаллообразования и как крайняя степень выраженности — процесс камнеобразования.
Типичными морфологическими изменениями при обменных нефропатиях является отложение кристаллов в собирательных трубочках, канальцах и интерстиции почек. В ответ на отложение кристаллов первоначально развивается неспецифический воспалительный процесс, в последующем возможно развитие иммунокомплексного воспалительного процесса с вторичным поражением различных отделов нефрона. В зависимости от уровня поражения нефрона обменная нефропатия может протекать по следующим клиническим вариантам: острая почечная недостаточность, тубуло-интерстициальный нефрит, уролитиаз, мочекислый диатез, бессимптомное течение.
Вне зависимости от варианта клинического течения длительное существование дисметаболических нарушений приводит к фиброзу интерстиция, снижению канальциевых функций и, как следствие этого, к нарушению концентрационной функции почек.
Чаще всего в клинической практике встречаются дисметаболические нефропатии, связанные с нарушением обмена оксалатов (солей щавелевой кислоты) и уратов. Все варианты обменных нефропатий вне зависимости от клинического варианта течения можно разделить на две большие группы: связанные с наследственным или врожденным нарушением обмена веществ и вторичные дисметаболические нефропатии.
Первичная оксалурия встречается редко. Педиатры имеют дело со вторичной оксалурией. Большинство оксалатов, выводимых с мочой, образуются в процессе обмена веществ из аминокислот — серина, глицина, оксипролина и частично из аскорбиновой кислоты. Незначительное количество поступает из кишечника при приеме с пищей оксалогенных продуктов. В обычной диете содержится от 97 до 930 мг оксалатов (в зависимости от времени года), но только от 2% до 5% из них всасываются в кишечнике. В физиологических условиях 10% экскретируемых с мочой оксалатов образуются из аскорбиновой кислоты и 40% из глицина. Поступление глицина в организм обусловлено его содержанием в пищевых продуктах, но возможно и ятрогенное развитие оксалурии при назначении глицина. Глицин® — лекарственный препарат на основе аминокислоты глицина, применяется в неврологической практике с целью улучшения обменных процессов в головном мозге. Причем в аннотации к препарату указано, что он не обладает побочными действиями, что не противоречит истине, но, к сожалению, аннотация составлена без учета метаболизма препарата.
Поступление глицина в организм обусловлено его содержанием в пищевых продуктах, но возможно и ятрогенное развитие оксалурии при назначении глицина. Глицин® — лекарственный препарат на основе аминокислоты глицина, применяется в неврологической практике с целью улучшения обменных процессов в головном мозге. Причем в аннотации к препарату указано, что он не обладает побочными действиями, что не противоречит истине, но, к сожалению, аннотация составлена без учета метаболизма препарата.
Возможно локальное образование оксалатов в почках в связи с разрушением фосфолипидов клеточных мембран, вследствие чего образуются предшественники оксалатов, с которыми кальций образует нерастворимые соли. Причинами распада мембран являются бактериальные фосфолипазы при воспалительных процессах в почках, воздействие мембранотоксических соединений, например сульфаниламидных препаратов, ишемия почек и др., при этом морфологически выявляют выраженную деструкцию щеточных каемок проксимальных и дистальных канальцев, заполнение просветов канальцев кристаллами, выраженную лимфогистиоцитарную инфильтрацию интерстиция. В последние годы получены интересные данные о том, что при оксалуриях снижено число вставочных клеток в собирательных трубочках, секретирующих Н+-ионы, т. е. оксалурия может быть отнесена к тубулопатиям — дистальному почечному ацидозу.
В последние годы получены интересные данные о том, что при оксалуриях снижено число вставочных клеток в собирательных трубочках, секретирующих Н+-ионы, т. е. оксалурия может быть отнесена к тубулопатиям — дистальному почечному ацидозу.
Специфических симптомов оксалатной нефропатии нет. Чаще всего выявляются рецидивирующие боли в животе, при мочеиспускании может возникать чувство жжения, иногда развивается воспаление гениталий за счет постоянного раздражения кожи и слизистой, возможно появление других дизурических расстройств. При визуальной оценке мочи отмечается ее насыщенный характер, возможно спонтанное образование осадка. Ведущим признаком патологии почек является мочевой синдром; повышение удельного веса мочи, микрогематурия, протеинурия, лейкоцитурия, оксалурия.
У детей с оксалурией отмечается снижение антикристаллообразующей способности мочи. В большинстве случаев оксалатная нефропатия обнаруживается случайно, иногда на фоне провоцирующих интеркуррентных заболеваний. Дебют заболевания приходится на младший возраст — 1–6 лет, а обострения чаще отмечаются в периоды интенсивного роста 7–8 лет и 10–14 лет.
Дебют заболевания приходится на младший возраст — 1–6 лет, а обострения чаще отмечаются в периоды интенсивного роста 7–8 лет и 10–14 лет.
Первичная урикозурия. К первичной гиперурикемической нефропатии относится подагра. Распространенность гиперурикемии колеблется от 3,3% в Англии до 40% в Новой Зеландии, встречаясь в среднем у 8–13% населения. Заболевание наследуется аутосомно-доминантным путем. В основе развития болезни лежит генетический дефект, приводящий к изменению активности ряда ферментов (глюкозо-6-фосфатазы, частичный дефицит гипоксантин-гуанинфосфорибозилтрансферазы) и повышение каталитической активности фосфорибозилпирофосфатсинтетазы, что приводит к повышению эндогенной продукции пуриновых соединений. В условиях гиперпродукции мочевой кислоты гиперурикемии предшествует повышенная экскреция мочевой кислоты (гиперуратурия). У взрослого человека в нормальных условиях через клубочки почек за сутки фильтруется 5–10 г мочевой кислоты, из которых около 1 г реабсорбируется, а остальное выделяется с мочой. При нарушении обмена количество профильтрованной и выделенной мочевой кислоты увеличивается в 3–4 раза. До 5–6% уратов в организме могут быть связаны с белками плазмы, т. е. не все ураты способны свободно фильтроваться в клубочках, при подагре значительно возрастает количество уратов, прочно связанных с белком.
При нарушении обмена количество профильтрованной и выделенной мочевой кислоты увеличивается в 3–4 раза. До 5–6% уратов в организме могут быть связаны с белками плазмы, т. е. не все ураты способны свободно фильтроваться в клубочках, при подагре значительно возрастает количество уратов, прочно связанных с белком.
Подагру считают полиорганным заболеванием, что подтверждается поражением не только почек, но и нервной системы, сердца, практически постоянно подагре сопутствуют ожирение, артериальная гипертензия, мигрень, суставной синдром, аллергия (бронхиальная астма, крапивница, нейродермит и др.). По данным эпидемиологических исследований гиперурикемия является фактором риска ишемической болезни сердца (ИБС), инфаркта, диабета, мочекаменной болезни. Считается, что подагрой болеют после 40 лет, однако трудно себе представить на протяжении столь длительного времени совершенно здорового человека с наследственным дефектом ферментных систем. Одним из первых проявлений подагры в детском возрасте и является дисметаболическая урикозурическая нефропатия.
Вторичная урикозурическая нефропатия. Повышение концентрации мочевой кислоты может отмечаться при ряде заболеваний, что позволяет говорить о вторичном характере процесса. Это заболевания крови — гемолитические анемии, лейкозы, новообразования, гипопаратиреоз, лекарственные воздействия; прием цитостатиков, сульфаниламидных препаратов, глюкокортикоидов, антибиотиков широкого спектра действия. Специфических отличий в клинической симптоматике и характере мочевого синдрома, за исключением кристаллурии, вторичная оксалурическая и урикозурические нефропатии практически не имеют.
Вне зависимости от механизма образования, вида кристаллурии, повышенное содержание кристаллов в моче на фоне нарушения коллоидного равновесия мочи приводит к отложению кристаллов в канальцах, собирательных трубочках почек с последующим нарушением пассажа мочи. Тем самым создаются условия для присоединения инфекции и развития пиелонефрита, тубулоинтерстициального нефрита, мочекаменной болезни. Итак, диагностика обменных нефропатий базируется на анализе: генеалогического анамнеза, учете факторов риска, жалобах пациента, клинической симптоматике, характерных изменениях в анализах мочи, характеристике салуреза (в норме за сутки выделяется с мочой до 40 мг оксалатов, в детской практике обязателен пересчет на единицу веса — не более 1 мг/кг/сут, уратов 5,5–6,0 ммоль/сут, не более 0,1 ммоль/кг/сут), определении уровня мочевой кислоты в крови, данных ультразвукового исследования почек — гиперэхогенные включения в чашечно-лоханочный комплекс, обызвествление кончиков пирамидок, в тяжелых случаях обызвествление всех пирамидок, данных рентгенологического исследования почек — выявление конкрементов, врожденных пороков развития. Нужно отметить, что диагноз обменной нефропатии ставится только на основании сочетания клинических и лабораторных данных. Постановка диагноза обменной нефропатии только по изолированным лабораторно-инструментальным признакам является ошибочной и приводит к нерациональной терапии и ограничению жизнедеятельности детей и подростков.
Итак, диагностика обменных нефропатий базируется на анализе: генеалогического анамнеза, учете факторов риска, жалобах пациента, клинической симптоматике, характерных изменениях в анализах мочи, характеристике салуреза (в норме за сутки выделяется с мочой до 40 мг оксалатов, в детской практике обязателен пересчет на единицу веса — не более 1 мг/кг/сут, уратов 5,5–6,0 ммоль/сут, не более 0,1 ммоль/кг/сут), определении уровня мочевой кислоты в крови, данных ультразвукового исследования почек — гиперэхогенные включения в чашечно-лоханочный комплекс, обызвествление кончиков пирамидок, в тяжелых случаях обызвествление всех пирамидок, данных рентгенологического исследования почек — выявление конкрементов, врожденных пороков развития. Нужно отметить, что диагноз обменной нефропатии ставится только на основании сочетания клинических и лабораторных данных. Постановка диагноза обменной нефропатии только по изолированным лабораторно-инструментальным признакам является ошибочной и приводит к нерациональной терапии и ограничению жизнедеятельности детей и подростков.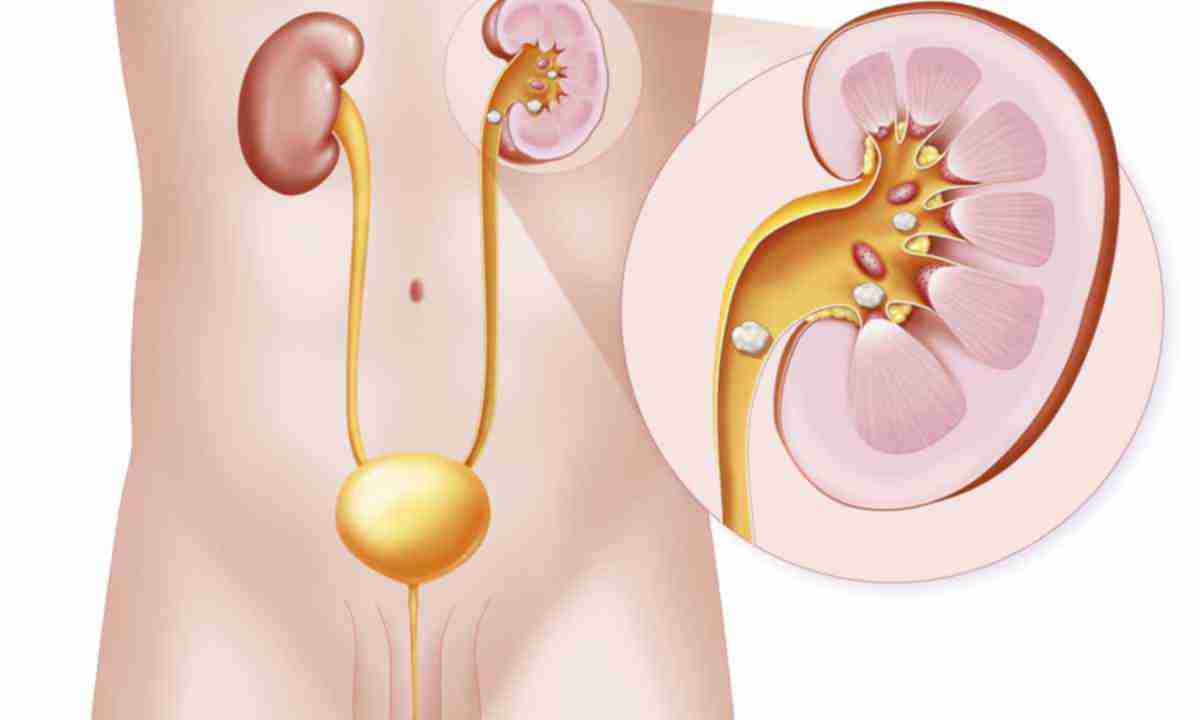
Лечение
Тактика лечения зависит от варианта клинического течения и вида кристаллурии. В тяжелой форме, с развитием острой почечной недостаточности (ОПН), тубуло-интерстициального нефрита 2–3 степени активности, дисметаболическая нефропатия встречается редко, как правило, в случаях первичных врожденных нарушений обмена веществ, подобные больные госпитализируются в специализированное нефрологическое отделение. При среднетяжелом течении заболевания пациенты могут направляться как в специализированное нефрологическое отделение, так и получать лечение в условиях соматического стационара. В остальных случаях дисметаболической нефропатии с оксалурией и/или уратурией, протекающей с минимальными клинико-лабораторными изменениями, лечение проводится амбулаторно.
Основой лечения любой формы дисметаболической нефропатии является обеспечение дополнительной водной нагрузки, до 500–1000 мл по отношению к возрастной потребности. Так, например, средняя физиологическая потребность детей в воде в зависимости от возраста следующая: 1–2 года — 1300–1500 мл, 4–6 лет 1800–2000, от 10 лет и старше 2000–2500 мл в день. Необходимо понимать, что жидкость ребенок и взрослый человек получает не только с питьем (чай, соки, супы и т. д.), но и со всеми продуктами питания. Нужно отметить, что ребенок первого и второго года жизни получает достаточное количество жидкости за счет контроля со стороны педиатров и родителей за объемом питания. К сожалению, дети старшего возраста при превалирующем нерегулярном питании вместе с продуктами получает в среднем за сутки 1500–1700 мл воды, что приводит к нарушению обменных процессов на уровне всего организма.
Так, например, средняя физиологическая потребность детей в воде в зависимости от возраста следующая: 1–2 года — 1300–1500 мл, 4–6 лет 1800–2000, от 10 лет и старше 2000–2500 мл в день. Необходимо понимать, что жидкость ребенок и взрослый человек получает не только с питьем (чай, соки, супы и т. д.), но и со всеми продуктами питания. Нужно отметить, что ребенок первого и второго года жизни получает достаточное количество жидкости за счет контроля со стороны педиатров и родителей за объемом питания. К сожалению, дети старшего возраста при превалирующем нерегулярном питании вместе с продуктами получает в среднем за сутки 1500–1700 мл воды, что приводит к нарушению обменных процессов на уровне всего организма.
Другим базисным компонентом терапии является диетическая коррекция. При оксалурии исключаются из питания продукты с высоким и средним содержанием щавелевой кислоты. Продукты с высоким содержанием щавелевой кислоты (от 10 до 1 г/кг веса продукта): какао, шоколад, свекла, сельдерей, шпинат, щавель, петрушка, ревень. Продукты со средним содержанием щавелевой кислоты (от 1,0 до 0,3 г/кг веса продукта): морковь, цикорий, зеленая фасоль, лук, помидоры, чай. Разрешаются продуты со средним и низким содержанием щавелевой кислоты: белокочанная капуста, абрикосы, бананы, картофель, грибы, баклажаны, кабачки, горох, огурцы, тыква. Ограничиваются продукты, богатые витамином С: шиповник, перец сладкий, смородина, облепиха, капуста брюссельская, цветная, рябина, апельсины. При построении диеты необходимо помнить, что аскорбиновая кислота в человеческом организме не синтезируется и является жизненно необходимым элементом питания, поэтому нельзя полностью элиминировать продукты, содержащие витамин С, из рациона питания.
Продукты со средним содержанием щавелевой кислоты (от 1,0 до 0,3 г/кг веса продукта): морковь, цикорий, зеленая фасоль, лук, помидоры, чай. Разрешаются продуты со средним и низким содержанием щавелевой кислоты: белокочанная капуста, абрикосы, бананы, картофель, грибы, баклажаны, кабачки, горох, огурцы, тыква. Ограничиваются продукты, богатые витамином С: шиповник, перец сладкий, смородина, облепиха, капуста брюссельская, цветная, рябина, апельсины. При построении диеты необходимо помнить, что аскорбиновая кислота в человеческом организме не синтезируется и является жизненно необходимым элементом питания, поэтому нельзя полностью элиминировать продукты, содержащие витамин С, из рациона питания.
На фоне диетических мероприятий экскреция оксалатов с мочой уменьшается на 40% и более. Экскреция оксалатов может быть уменьшена в результате изменения метаболизма глицина при введении в организм бензоата натрия, который блокирует эндогенный синтез оксалатов из глицина, то есть при введении в рацион (дополнительное питье) клюквы и брусники. Уменьшение выделения оксалатов на фоне дачи бензоата натрия происходит благодаря превращению глицина в гиппуровую кислоту.
Уменьшение выделения оксалатов на фоне дачи бензоата натрия происходит благодаря превращению глицина в гиппуровую кислоту.
При урикозурических нефропатиях рекомендована диета с ограничением пуриновых веществ. Продукты с высоким содержанием пуринов: сардины, сельдь, скумбрия, субпродукты. Среднее содержание пуринов: чечевица, говядина, свинина, кролик, речная и озерная рыба.
С учетом того, что кристаллы оксалатов и уратов осаждаются в кислой среде, необходимо следить за соотношением кислых и щелочных валентностей в пище, кислые валентности содержатся в продуктах животного происхождения и злаковых, щелочные во фруктах и овощах, то есть ориентироваться на молочно-растительный (из разрешенного перечня) стереотип питания.
Кроме того, с ощелачивающей целью назначаются щелочные минеральные воды типа «Боржоми», «Нарзан», «Ессентуки» и т. п., средней минерализации в возрастных дозах, курсами по 2–3 недели.
К методам диетической коррекции также можно отнести прием растительных масел как поставщиков полиненасыщенных жирных кислот по 5,0–15,0 мл 1–3 раза в день. Растительные масла логично использовать в качестве заправок для овощных салатов, пюре или каши.
Растительные масла логично использовать в качестве заправок для овощных салатов, пюре или каши.
Медикаментозное лечение
Основу медикаментозного лечения любой формы дисметаболических нефропатий составляет метаболическая и мембранопротекторная терапия.
При оксалозе рекомендовано назначение витаминов В1 и В6 с целью активизации метаболизма глицина, назначают витамины per os в высоких дозах от 20–60 мг/сут до 100 мг/сут в утренние и дневные часы, курс 2–3 недели. При оксалозе можно применять и комплексные препараты, содержащие витамины В1 и В6.
Магне В6 содержит пиридоксин и магний. Разрешен к применению у детей старше 12 лет. Принимается по 1–2 таблетки 3 раза в день. Курс 2–3 недели.
Мульти-табс В-Комплекс. Содержит: витамин В1 (тиамина нитрат) — 15 мг, витамин В2 (рибофлавин) — 15 мг, витамин В6 (пиридоксина гидрохлорид) — 15 мг, витамин В12 (цианокобаламин) 5 мкг, никотинамид — 60 мг, пантотеновую кислоту (кальция пантотенат) — 30 мг, фолиевую кислоту — 200 мкг. Применять по 1–2 таблетки в день, курс 2–3 месяца.
Применять по 1–2 таблетки в день, курс 2–3 месяца.
При оксалурии и уратурии показаны курсы метаболической терапии и мембранопротекторов, витамины А, Е, Аевит в возрастных дозах.
Димефосфон (15% раствор). Является антигипоксантом и антиоксидантом, регулятором водно-электролитного баланса и кислотно-щелочного состояния. Применяют внутрь, запивая водой, в виде раствора, взрослым и детям по 30–50 мг/кг (или из расчета 1 мл 15% раствора на 5 кг массы тела), 1–4 раза в сутки, длительность приема 3 недели — 2 месяца. Обладает горьким вкусом, поэтому для облегчения приема детям рекомендуется запивать молоком, фруктовым соком или сладким чаем.
Элькар (L-карнитин) — 20% водный раствор для перорального применения, содержащий 200 мг действующего вещества в 1 мл раствора. Препарат относится к фармакологической группе «Метаболические средства» и выпускается во флаконах по 25, 50 и 100 мл. Элькар представляет собой прозрачную бесцветную жидкость без запаха, содержащую L-карнитин, по химической структуре и биологической активности идентичный природному. Участвует в процессах обмена веществ. Нормализует структуру и функцию митохондрий, оптимизирует энергетический обмен в клетках. После приема внутрь хорошо всасывается в кишечнике, концентрация в плазме крови достигает максимума через 3 ч и сохраняется в терапевтическом диапазоне в течение 9 ч, выводится почками. Препарат разрешен к применению у детей с первого года жизни. Легко дозируется, можно применять в качестве питья или в виде добавки к сладким блюдам. До 3 лет 5–10 капель на прием, от 3 до 6 лет — по 0,1 г (14 капель) 2–3 раза в день (суточная доза — 0,2–0,3 г), от 6 до 12 лет — по 0,2–0,3 г (28–42 капли) 2–3 раза в день (суточная доза — 0,4–0,9 г). Курс лечения — 1 мес. Противопоказаний для назначения препарата нет.
Участвует в процессах обмена веществ. Нормализует структуру и функцию митохондрий, оптимизирует энергетический обмен в клетках. После приема внутрь хорошо всасывается в кишечнике, концентрация в плазме крови достигает максимума через 3 ч и сохраняется в терапевтическом диапазоне в течение 9 ч, выводится почками. Препарат разрешен к применению у детей с первого года жизни. Легко дозируется, можно применять в качестве питья или в виде добавки к сладким блюдам. До 3 лет 5–10 капель на прием, от 3 до 6 лет — по 0,1 г (14 капель) 2–3 раза в день (суточная доза — 0,2–0,3 г), от 6 до 12 лет — по 0,2–0,3 г (28–42 капли) 2–3 раза в день (суточная доза — 0,4–0,9 г). Курс лечения — 1 мес. Противопоказаний для назначения препарата нет.
Эссенциале форте Н. Содержит эссенциальные фосфолипиды (EPL) из соевых бобов, содержащие 76% (3-sn-фосфатидил) холина, сочетающиеся с природными эндогенными фосфолипидами по химической структуре, нормализуют метаболизм липидов и белков, способствуют активации и защите фосфолипидзависимых ферментных систем, восстанавливают клеточную структуру, улучшают регенерацию. Ежедневный прием — по 2 капсулы 2–3 раза в день, во время еды, проглатывая целиком, запивая небольшим количеством воды.
Ежедневный прием — по 2 капсулы 2–3 раза в день, во время еды, проглатывая целиком, запивая небольшим количеством воды.
Эссливер форте. Выпускается в капсулах. Содержит эссенциальные фосфолипиды (фосфатидилхолин — 29%, фосфатидилэтаноламин и др.) — 300 мг, витамин B1 — 6 мг, витамин В2 — 6 мг, витамин В6 — 6 мг, витамин В12 — 6 мкг, токоферола ацетат — 6 мг, никотинамид — 30 мг. Регулирует проницаемость биомембран, активность мембраносвязанных ферментов, обеспечивая физиологическую норму процессов окислительного фосфорилирования в клеточном метаболизме. Восстанавливает мембраны путем структурной регенерации и методом конкурентного ингибирования перекисных процессов. Применяется внутрь по 2 капсулы 3 раза в день во время еды. У детей до 12 лет применяется с осторожностью.
Фосфоглив. Комплексный препарат, содержащий фосфатидилхолин растительного происхождения и тринатриевую соль глицирризиновой кислоты из корня солодки. Фосфатидилхолин является основным компонентом фосфолипидного биослоя биологических мембран. При пероральном введении в организм фосфатидилхолин восстанавливает целостность клеточных мембран. Глицирризиновая кислота обладает противовоспалительными свойствами. Форма выпуска — капсулы. По 1–2 капсулы 3 раза в день в течение 30 дней регулярно. Высшая разовая доза — 4 капсулы, суточная — 12 капсул. Разрешен к применению у взрослых.
Фосфатидилхолин является основным компонентом фосфолипидного биослоя биологических мембран. При пероральном введении в организм фосфатидилхолин восстанавливает целостность клеточных мембран. Глицирризиновая кислота обладает противовоспалительными свойствами. Форма выпуска — капсулы. По 1–2 капсулы 3 раза в день в течение 30 дней регулярно. Высшая разовая доза — 4 капсулы, суточная — 12 капсул. Разрешен к применению у взрослых.
Тыквеол. Формы выпуска: капсулы, масло для приема внутрь, свечи ректальные. Содержит комплекс биологически активных веществ из семян тыквы (каротиноиды, токоферолы — не менее 4%, фосфолипиды, стерины, фосфатиды, флавоноиды, витамины B1, B2, C, PP, насыщенные, ненасыщенные и полиненасыщенные жирные кислоты — пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Оказывает выраженное антиоксидантное действие, угнетающее процессы перекисного окисления липидов в биологических мембранах. Эссенциальные фосфолипиды — структурные элементы клеточных мембран и мембран органелл, регулируют проницаемость мембран и процессы окислительного фосфорилирования, способствуют восстановлению структуры и функции мембран. Применяется внутрь, по 1 чайной ложке экстракта за 30 мин до еды или по 2–4 капсулы, во время или после еды 3–4 раза в сутки.
Применяется внутрь, по 1 чайной ложке экстракта за 30 мин до еды или по 2–4 капсулы, во время или после еды 3–4 раза в сутки.
Длительность курса протекторной терапии 2–3 недели, проводится 3–4 раза в год.
Помимо мембранопротекторной терапии широко используются комбинированные препараты на основе лекарственных трав и эфирных масел.
Фитотерапия традиционно популярна для лечения самых разных заболеваний почек. В целом, надо отметить, что при дисметаболической нефропатии целесообразно использовать лекарственные травы с диуретическими и мембраностабилизирующими свойствами и избегать трав с высоким содержанием оксалатов и аскорбиновой кислоты при оксалурии. Несмотря на большой выбор лекарственных растений и их препаратов, важно выделять те из них, в отношении которых имеются научные данные в плане эффективности лечения и безопасности. Одним из наиболее популярных в лечении дисметаболических нефропатий препаратов является растительный лекарственный препарат Канефрон Н. В исследованиях показано мочегонное, уросептическое, мембраностабилизирующее и антиоксидантное действие Канефрона Н при различных инфекционно-воспалительных и обменных заболеваниях почек. Препарат может использоваться как в лечебном комплексе, так и отдельно длительным курсом у детей с дисметаболическими нефропатиями.
В исследованиях показано мочегонное, уросептическое, мембраностабилизирующее и антиоксидантное действие Канефрона Н при различных инфекционно-воспалительных и обменных заболеваниях почек. Препарат может использоваться как в лечебном комплексе, так и отдельно длительным курсом у детей с дисметаболическими нефропатиями.
Канефрон Н. Выпускается в виде водно-спиртового раствора и в драже. В состав лекарственного препарата растительного происхождения входят: травы золототысячника (Centaurii herba), корня любистока (Levistici radix), листьев розмарина (Rosmarini folia). Фармакологическое действие: диуретическое, спазмолитическое, противовоспалительное, антибактериальное. Способ применения и дозы: внутрь, грудным детям — по 10 капель 3 раза в сутки; детям дошкольного возраста — по 15 капель 3 раза в сутки; детям школьного возраста — по 25 капель или по 1 драже 3 раза в сутки. Курс 2–4 недели. При необходимости (для улучшения вкуса) капли можно принимать вместе с другими жидкостями. Драже следует принимать не разжевывая, запивая небольшим количеством воды.
Драже следует принимать не разжевывая, запивая небольшим количеством воды.
Олиметин. Комплексный препарат, содержащий масло мяты перечной, масло терпентинное очищенное, масло аира, масло оливковое, серу очищенную. Оказывает спазмолитическое, желчегонное, мочегонное и противовоспалительное действие. Форма выпуска — капсулы. Применяют по 1–2 капсулы 3 раза в день до еды. Курс 2–3 недели. С профилактической целью применяют по 1 капсуле в день длительным курсом.
Фитолизин. Препарат — паста мягкой консистенции, зелено-коричневого цвета со специфическим ароматом. Содержит экстракты растений: корня петрушки, корневища пырея, травы полевого хвоща, листьев березы, травы горца птичьего и др., а также масла — мятное, шалфейное, сосновое, апельсиновое и ванилин. Оказывает мочегонное, противовоспалительное, спазмолитическое действие. Применяют для разрыхления и удаления мочевых конкрементов и облегчения их выведения с мочой. Принимают по 1 чайной ложке в 1/2 стакана теплой подслащенной воды 3 раза в день после еды. Форма выпуска: в тубах по 100 г.
Принимают по 1 чайной ложке в 1/2 стакана теплой подслащенной воды 3 раза в день после еды. Форма выпуска: в тубах по 100 г.
Цистон. За счет комбинированного состава препарат нормализует коллоидное равновесие мочи, обладает противовоспалительным, антисептическим и спазмолитическим, диуретическим действием, что позволяет его использовать в качестве одного из основных средств лечения дисметаболической нефропатии, причем длительным курсом до 6 месяцев, в возрастных дозах.
Уролесан. Форма выпуска — капли. Состав: масла пихтовое, масло перечной мяты, масло касторовое, экстракт семян моркови дикой, экстракт шишек хмеля, экстракт травы душицы обыкновенной. Применяют при мочекаменной и желчнокаменной болезни. Препарат оказывает спазмолитическое и противовоспалительное действие. Принимают внутрь по 8–10 капель перед едой. Курс лечения 3–4 недели.
Фитотерапия. При выборе лекарственных растений учитывается наличие мочегонного действия, зависящего от содержания эфирных масел, сапонинов, силикатов (можжевельник, петрушка, листья березы, хвощ полевой), противовоспалительного действия, связанного с присутствием танинов и арбутина (листья брусники, толокнянка), антисептического, обусловленного фитонцидами (ромашка, зверобой, тысячелистник, пол-пола), и литолитического эффекта (почечный чай, василек, марена красильная, пол-пола).
При интеркуррентных заболеваниях назначается постельный режим, обильное питье, обязательно мембранопротекторная или фитотерапия, при необходимости тщательно подбираются антибактериальные препараты, не обладающие нефротоксическим действием, сдаются контрольные анализы мочи при выздоровлении и через 10–14 дней.
Диспансерное наблюдение проводится индивидуально в зависимости от клинического варианта течения дисметаболической нефропатии.
Литература
Эрман М. В. Нефрология детского возраста в схемах и таблицах, С.-Пб: Специальная литература, 1997, с. 182–203, 319–339.
Игнатова М. С., Вельтищев Ю. Е. Детская нефрология. М.: Медицина, 1989, с. 276–293.
Шулутко Б. И. Болезни печени и почек. С.-Пб: Ренкор, 1995, с. 399–408.
Нефрология. Под ред. Тареевой И. Е. М.: Медицина, 1995, с. 312–321.
Регистр лекарственных средств России-2007.

Химический состав пищевых продуктов. Справочные таблицы содержания основных пищевых веществ и энергетической ценности пищевых продуктов. Под ред. Покровского А. А. М.: Пищевая промышленность, 1976, 227 с.
С. В. Рычкова, доктор медицинских наук, доцент
СПб МАПО, Санкт-Петербург
Контактная информация об авторе для переписки: [email protected]
Обменные нефропатии у детей: систематический обзор | Бурлуцкая
1. Обухова А.Н., Халецкая О.В., Туш Е.В. Роль кишечной микрофлоры в патогенезе вторичной гипероксалурии у детей. Российский вестник перинатологии и педиатрии. 2020; 65(4): 41–46. DOI: 10.21508/1027-4065-2020-65-4-41-46
2. Colliou E., Mari A., Delas A., Delarche A., Faguer S. Oxalate nephropathy following vitamin C intake within intensive care unit. Clin. Nephrol. 2017; 88(12): 354–358. DOI: 10.5414/CN109118
3. Liu M., Nazzal L. Enteric hyperoxaluria: role of microbiota and antibiotics. Curr. Opin. Nephrol. Hypertens. 2019; 28(4): 352–359. DOI: 10.1097/MNH.0000000000000518
Liu M., Nazzal L. Enteric hyperoxaluria: role of microbiota and antibiotics. Curr. Opin. Nephrol. Hypertens. 2019; 28(4): 352–359. DOI: 10.1097/MNH.0000000000000518
4. Чугунова О.Л., Шумихина М.В., Павлушкина Л.В. Основные факторы риска развития мочекаменной болезни у детей. Педиатрия. Журнал им. Г.Н. Сперанского. 2018; 97(5): 93–101. DOI: 10.24110/0031-403X-2018-97-5-93-103
5. Юрьева Э.А., Длин В.В., Кудин М.В., Новикова Н.Н., Воздвиженская Е.С., Харабадзе М.Н., Князева Д.Л. Обменные нефропатии у детей: причины развития, клинико-лабораторные проявления. Российский вестник перинатологии и педиатрии. 2016; 61(2): 28–34. DOI: 10.21508/1027-4065-2016-61-2-28-34
6. Batagello C.A., Monga M., Miller A.W. Calcium Oxalate Urolithiasis: A Case of Missing Microbes? J. Endourol. 2018; 32(11): 995–1005. DOI: 10.1089/end.2018.0294
7. Fargue S., Milliner D.S., Knight J., Olson J.B., Lowther W.T., Holmes R.P. Hydroxyproline metabolism and oxalate synthesis in primary hyperoxaluria. J. Am. Soc. Nephrol. 2018; 29(6): 1615–1623. DOI: 10.1681/ASN.2017040390
J. Am. Soc. Nephrol. 2018; 29(6): 1615–1623. DOI: 10.1681/ASN.2017040390
8. Mitchell T., Kumar P., Reddy T., Wood K.D., Knight J., Assimos D.G., Holmes R.P. Dietary oxalate and kidney stone formation. Am. J. Physiol. Renal Physiol. 2019; 316(3): F409–F413. DOI: 10.1152/ajprenal.00373.2018
9. Siener R., Hoppe B., Löhr P., Müller S.C., Latz S. Metabolic profile and impact of diet in patients with primary hyperoxaluria. Int. Urol. Nephrol. 2018; 50(9): 1583–1589. DOI: 10.1007/s11255-018-1939-1
10. Daudon M., Frochot V. Crystalluria. Clin. Chem. Lab. Med. 2015; 53 Suppl 2: s1479–s1487. DOI: 10.1515/cclm-2015-0860
11. Arvans D., Jung Y.C., Antonopoulos D., Koval J., Granja I., Bashir M., Karrar E., Roy-Chowdhury J., Musch M., Asplin J., Chang E., Hassan H. Oxalobacter formigenes-derived bioactive factors stimulate oxalate transport by intestinal epithelial cells. J. Am. Soc. Nephrol. 2017; 28(3): 876–887. DOI: 10.1681/ASN.2016020132
12. Hoppe B., Niaudet P., Salomon R. , Harambat J., Hulton S.A., Van’t Hoff W., Moochhala S.H., Deschênes G., Lindner E., Sjögren A., Cochat P. A randomised phase I/II trial to evaluate the efficacy and safety of orally administered Oxalobacter formigenes to treat primary hyperoxaluria. Pediatr. Nephrol. 2017; 32(5): 781–790. DOI: 10.1007/s00467-016-3553-8
, Harambat J., Hulton S.A., Van’t Hoff W., Moochhala S.H., Deschênes G., Lindner E., Sjögren A., Cochat P. A randomised phase I/II trial to evaluate the efficacy and safety of orally administered Oxalobacter formigenes to treat primary hyperoxaluria. Pediatr. Nephrol. 2017; 32(5): 781–790. DOI: 10.1007/s00467-016-3553-8
13. Liu M., Koh H., Kurtz Z.D., Battaglia T., PeBenito A., Li H., Nazzal L., Blaser M.J.. Oxalobacter formigenes–associated host features and microbial community structures examined using the American Gut Project. Microbiome. 2017; 5(1): 108. DOI: 10.1186/s40168-017-0316-0
14. Miller A.W., Oakeson K.F., Dale C., Dearing M.D. Effect of dietary oxalate on the gut microbiota of the mammalian herbivore neotoma albigula. Appl. Environ. Microbiol. 2016 Apr 18;82(9):2669–2675. DOI: 10.1128/AEM.00216-16
15. Canales B.K., Hatch M. Oxalobacter formigenes colonization normalizes oxalate excretion in a gastric bypass model of hyperoxaluria. Surg. Obes. Relat. Dis. 2017; 13(7): 1152–1157. DOI: 10.1016/j.soard.2017.03.014
DOI: 10.1016/j.soard.2017.03.014
16. Canales B.K., Hatch M. Oxalobacter formigenes colonization normalizes oxalate excretion in a gastric bypass model of hyperoxaluria. Surg. Obes. Relat. Dis. 2017; 13(7): 1152–1157. DOI: 10.1016/j.soard.2017.03.014
17. Bamberger J.N., Blum K.A., Kan K.M., Parkhomenko E., Gallante B., Gupta M. Clinical and metabolic correlates of calcium oxalate stone subtypes: implications for etiology and management. J. Endourol. 2019; 33(9): 755–760. DOI: 10.1089/end.2019.0245
18. Roodnat J.I., de Mik-van Egmond A.M.E., Visser W.J., Berger S.P., van der Meijden W.A.G., Knauf F., van Agteren M., Betjes M.G.H., Hoorn E.J. A Successful approach to kidney transplantation in patients with enteric (secondary) hyperoxaluria. Transplant. Direct. 2017; 3(12): e331. DOI: 10.1097/TXD.0000000000000748
19. Knight J., Madduma-Liyanage K., Mobley J.A., Assimos D.G., Holmes R.P. Ascorbic acid intake and oxalate synthesis. Urolithiasis. 2016; 44(4): 289–97. DOI: 10. 1007/s00240-016-0868-7
1007/s00240-016-0868-7
20. Ermer T., Eckardt K.U., Aronson P.S., Knauf F. Oxalate, inflammasome, and progression of kidney disease. Curr. Opin. Nephrol. Hypertens. 2016; 25(4): 363–371. DOI: 10.1097/MNH.0000000000000229
21. Krieger N.S., Asplin J.R., Frick K.K., Granja I., Culbertson C.D., Ng A., Grynpas M.D., Bushinsky D.A. Effect of potassium citrate on calcium phosphate stones in a model of hypercalciuria. J. Am. Soc. Nephrol. 2015; 26(12): 3001–3008. DOI: 10.1681/ASN.2014121223
22. Klimesova K., Whittamore J.M., Hatch M. Bifidobacterium animalis subsp. lactis decreases urinary oxalate excretion in a mouse model of primary hyperoxaluria. Urolithiasis. 2015; 43(2): 107–117. DOI: 10.1007/s00240-014-0728-2
23. Lieske J.C. Probiotics for prevention of urinary stones. Ann. Transl. Med. 2017; 5(2): 29. DOI: 10.21037/atm.2016.11.86
24. Pereira D.J., Schoolwerth A.C., Pais V.M. Cystinuria: current concepts and future directions. Clin. Nephrol. 2015; 83(3): 138–146. DOI: 10.5414/cn108514
DOI: 10.5414/cn108514
25. Woodard L.E., Welch R.C., Veach R.A., Beckermann T.M., Sha F., Weinman E.J., Ikizler T.A., Tischfield J.A., Sahota A., Wilson M.H. Metabolic consequences of cystinuria. BMC Nephrol. 2019; 20(1): 227. DOI: 10.1186/s12882-019-1417-8
26. Moussa M., Papatsoris A.G., Abou Chakra M., Moussa Y. Update on cystine stones: current and future concepts in treatment. Intractable Rare. Dis. Res. 2020; 9(2): 71–78. DOI: 10.5582/irdr.2020.03006
27. Usawachintachit M., Sherer B., Hudnall M., Tzou D.T., Taguchi K., Hsi R.S., Stoller M., Chi T. Clinical outcomes for cystinuria patients with unilateral versus bilateral cystine stone disease. J. Endourol. 2018; 32(2): 148–153. DOI: 10.1089/end.2017.0335
28. Obaid A., Nashabat M., Al Fakeeh K., Al Qahtani A.T., Alfadhel M. Delineation of cystinuria in Saudi Arabia: A case series. BMC Nephrol. 2017; 18(1): 50. DOI: 10.1186/s12882-017-0469-x
29. Andreassen K.H., Pedersen K.V., Osther S.S., Jung H.U., Lildal S. K., Osther P.J. How should patients with cystine stone disease be evaluated and treated in the twenty-first century? Urolithiasis. 2016; 44(1): 65–76. DOI: 10.1007/s00240-015-0841-x
K., Osther P.J. How should patients with cystine stone disease be evaluated and treated in the twenty-first century? Urolithiasis. 2016; 44(1): 65–76. DOI: 10.1007/s00240-015-0841-x
30. Yang Y., Albanyan H., Lee S., Aloysius H., Liang J.J., Kholodovych V., Sahota A., Hu L. Design, synthesis, and evaluation of l-cystine diamides as l-cystine crystallization inhibitors for cystinuria. Bioorg. Med. Chem. Lett. 2018; 28(8): 1303–1308. DOI: 10.1016/j.bmcl.2018.03.024
31. Fattah H., Hambaroush Y., Goldfarb D.S. Cystine nephrolithiasis. Transl. Androl. Urol. 2014; 3(3): 228–233. DOI: 10.3978/j.issn.2223–4683.2014.07.04
32. Sumorok N., Goldfarb D.S. Update on cystinuria. Curr. Opin. Nephrol. Hypertens. 2013; 22(4): 427–31. DOI: 10.1097/MNH.0b013e3283621c5d
33. Sahota A., Tischfield J.A., Goldfarb D.S., Ward M.D., Hu L. Cystinuria: genetic aspects, mouse models, and a new approach to therapy. Urolithiasis. 2019; 47(1): 57–66. DOI: 10.1007/s00240-018-1101-7
34. Wong K. A., Pardy C., Pillay S., Athanasiou T., Rottenberg G., Bultitude M., Chandra A., Thomas K. Can the presence of crystalluria predict stone formation in patients with cystinuria? J. Endourol. 2016; 30(5): 609–614. DOI: 10.1089/end.2015.0692
A., Pardy C., Pillay S., Athanasiou T., Rottenberg G., Bultitude M., Chandra A., Thomas K. Can the presence of crystalluria predict stone formation in patients with cystinuria? J. Endourol. 2016; 30(5): 609–614. DOI: 10.1089/end.2015.0692
35. Burns Z., Knight J., Fargue S., Holmes R., Assimos D., Wood K. Future treatments for hyperoxaluria. Curr. Opin. Urol. 2020; 30(2): 171–176. DOI: 10.1097/MOU.0000000000000709
36. Letavernier E., Daudon M. Stiripentol identifies a therapeutic target to reduce oxaluria. Curr. Opin. Nephrol. Hypertens. 2020; 29(4): 394–399. DOI: 10.1097/MNH.0000000000000621
37. Clark B., Baqdunes M.W., Kunkel G.M. Diet–induced oxalate nephropathy. BMJ Case Rep. 2019; 12(9): e231284. DOI: 10.1136/bcr-2019-231284
38. Asplin J.R. The management of patients with enteric hyperoxaluria. Urolithiasis. 2016; 44(1): 33–43. DOI: 10.1007/s00240-015-0846-5
39. Holmes R.P., Knight J., Assimos D.G. Lowering urinary oxalate excretion to decrease calcium oxalate stone disease. Urolithiasis. 2016; 44(1): 27–32. DOI: 10.1007/s00240-015-0839-4
Urolithiasis. 2016; 44(1): 27–32. DOI: 10.1007/s00240-015-0839-4
40. Assadi F., Moghtaderi M. Preventive kidney stones: continue medical education. Int. J. Prev. Med. 2017; 8: 67. DOI: 10.4103/ijpvm.IJPVM_17_17
41. Boushey C.J., Spoden M., Zhu F.M., Delp E.J., Kerr D.A. New mobile methods for dietary assessment: review of image-assisted and image-based dietary assessment methods. Proc. Nutr. Soc. 2017; 76(3): 283–294. DOI: 10.1017/S0029665116002913
42. Ellis D., Lieb J. Hyperoxaluria and genitourinary disorders in children ingesting almond milk products. J. Pediatr. 2015; 167(5): 1155–1158. DOI: 10.1016/j.jpeds.2015.08.029
43. Gao J., Xue J.-F., Xu M., Gui B.-S., Wang F.-X., Ouyang J.-M. Comparison of physicochemical properties of nano- and microsized crystals in the urine of calcium oxalate stone patients and control subjects. Journal of Nanomaterials. 2014; 2014: 1–9. DOI: 10.1155/2014/790473
44. Crivelli J.J., Mitchell T., Knight J., Wood K.D., Assimos D. G., Holmes R.P., Fargue S. Contribution of dietary oxalate and oxalate precursors to urinary oxalate excretion. Nutrients. 2020; 13(1): 62. DOI: 10.3390/nu13010062
G., Holmes R.P., Fargue S. Contribution of dietary oxalate and oxalate precursors to urinary oxalate excretion. Nutrients. 2020; 13(1): 62. DOI: 10.3390/nu13010062
45. Langman C.B., Grujic D., Pease R.M., Easter L., Nezzer J., Margolin A., Brettman L. A Double-blind, placebo controlled, randomized phase 1 cross-over study with ALLN-177, an orally administered oxalate degrading enzyme. Am. J. Nephrol. 2016;44(2):150–158. DOI: 10.1159/000448766
46. Noori N., Honarkar E., Goldfarb D.S., Kalantar-Zadeh K., Taheri M., Shakhssalim N., Parvin M., Basiri A. Urinary lithogenic risk profile in recurrent stone formers with hyperoxaluria: a randomized controlled trial comparing DASH (Dietary Approaches to Stop Hypertension)-style and low-oxalate diets. Am. J. Kidney Dis. 2014; 63(3): 456–463. DOI: 10.1053/j.ajkd.2013.11.022
47. Patel M., Yarlagadda V., Adedoyin O., Saini V., Assimos D.G., Holmes R.P., Mitchell T. Oxalate induces mitochondrial dysfunction and disrupts redox homeostasis in a human monocyte derived cell line. Redox Biol. 2018; 15: 207–215. DOI: 10.1016/j.redox.2017.12.003
Redox Biol. 2018; 15: 207–215. DOI: 10.1016/j.redox.2017.12.003
48. Robertson W.G. Potential role of fluctuations in the composition of renal tubular fluid through the nephron in the initiation of Randall’s plugs and calcium oxalate crystalluria in a computer model of renal function. Urolithiasis. 2015; 43 Suppl 1: 93–107. DOI: 10.1007/s00240-014-0737-1
49. Williams J., Holmes R.P., Assimos D.G., Mitchell T. Monocyte mitochondrial function in calcium oxalate stone formers. Urology. 2016; 93: 224.e1–224.e6. DOI: 10.1016/j.urology.2016.03.004
50. Prochaska M., Taylor E., Ferraro P.M., Curhan G. Relative supersaturation of 24–hour urine and likelihood of kidney stones. J. Urol. 2018; 199(5): 1262–1266. DOI: 10.1016/j.juro.2017.10.046
Метаболический синдром у детей с хронической болезнью почек и после трансплантации почки
Обзор
. 2014 фев; 29 (2): 203-16.
doi: 10.1007/s00467-013-2500-1.
Epub 2013 13 июня.
Мечислав Литвин
1
, Анна Немирска
принадлежность
- 1 Отделение нефрологии и артериальной гипертензии Детского мемориального института здоровья, Варшава, Польша, [email protected].
PMID:
23760991
PMCID:
PMC3889828
DOI:
10.1007/s00467-013-2500-1
Бесплатная статья ЧВК
Обзор
Мечислав Литвин и др.
Педиатр Нефрол.
2014 Февраль
Бесплатная статья ЧВК
. 2014 фев; 29 (2): 203-16.
2014 фев; 29 (2): 203-16.
doi: 10.1007/s00467-013-2500-1.
Epub 2013 13 июня.
Авторы
Мечислав Литвин
1
, Анна Немирска
принадлежность
- 1 Отделение нефрологии и артериальной гипертензии, Детский мемориальный институт здоровья, Варшава, Польша, [email protected].
PMID:
23760991
PMCID:
PMC3889828
DOI:
10.1007/s00467-013-2500-1
Абстрактный
Висцеральное ожирение и метаболические нарушения, типичные для метаболического синдрома (МС), являются новой эпидемией в подростковом возрасте. РС является фактором риска не только сердечно-сосудистых заболеваний, но и хронической болезни почек (ХБП). Таким образом, есть некоторые основания признать РС новой проблемой для детских нефрологов. Во-первых, гипертоническая и диабетическая нефропатия, основные причины ХБП у взрослых, имеют одни и те же патофизиологические аномалии, связанные с висцеральным ожирением и резистентностью к инсулину, и берут свое начало в детстве. Во-вторых, поскольку эпидемия ожирения затрагивает и детей с ХБП, РС становится фактором риска прогрессирования ХБП. В-третьих, метаболические нарушения, характерные для РС, могут представлять дополнительный риск сердечно-сосудистой заболеваемости и смертности у детей с ХБП. Наконец, хотя трансплантация почки устраняет уремические аномалии, она связана с воздействием новых метаболических факторов риска, типичных для РС, и было обнаружено, что РС является фактором риска потери трансплантата и сердечно-сосудистых заболеваний после трансплантации почки. Рассеянный склероз является результатом дисбаланса между потреблением и расходом энергии с пищей, вызывающим непропорциональное накопление жира.
РС является фактором риска не только сердечно-сосудистых заболеваний, но и хронической болезни почек (ХБП). Таким образом, есть некоторые основания признать РС новой проблемой для детских нефрологов. Во-первых, гипертоническая и диабетическая нефропатия, основные причины ХБП у взрослых, имеют одни и те же патофизиологические аномалии, связанные с висцеральным ожирением и резистентностью к инсулину, и берут свое начало в детстве. Во-вторых, поскольку эпидемия ожирения затрагивает и детей с ХБП, РС становится фактором риска прогрессирования ХБП. В-третьих, метаболические нарушения, характерные для РС, могут представлять дополнительный риск сердечно-сосудистой заболеваемости и смертности у детей с ХБП. Наконец, хотя трансплантация почки устраняет уремические аномалии, она связана с воздействием новых метаболических факторов риска, типичных для РС, и было обнаружено, что РС является фактором риска потери трансплантата и сердечно-сосудистых заболеваний после трансплантации почки. Рассеянный склероз является результатом дисбаланса между потреблением и расходом энергии с пищей, вызывающим непропорциональное накопление жира. Таким образом, наилучшей профилактикой и лечением РС является физическая активность и поддержание правильного соотношения между мышечной и жировой массой.
Таким образом, наилучшей профилактикой и лечением РС является физическая активность и поддержание правильного соотношения между мышечной и жировой массой.
Цифры
Рис. 1
Левая уремическая артериопатия. Стенка аорты…
Рис. 1
Левая уремическая артериопатия. Стенка аорты 20-летнего мальчика на диализе в течение 8 лет. Утолщение…
рисунок 1
Левая уремическая артериопатия. Стенка аорты 20-летнего мальчика на диализе в течение 8 лет. Утолщение медии стенки аорты. Нормальный эндотелий. Справа Атеросклероз почечной артерии у 60-летнего мужчины (любезно предоставлено доктором В. Грайковской)
Рис. 2
Левый нормальный миокард. Правый Миокардиальный…
Правый Миокардиальный…
Рис. 2
Левый нормальный миокард. Право Биопсия миокарда 13-летней девочки, находившейся на диализе в течение 5 лет.…
Рис. 2
Левый нормальный миокард. Справа Биопсия миокарда 13-летней девочки, находившейся на диализе в течение 5 лет. Гипертрофия миокардиоцитов ( стрелки ). Диффузный фиброз межмиокардиоцитов ( двойные стрелки ) и стеатоз. Количество соединительной ткани – 3 % (норма 1 %) (любезно предоставлено доктором В. Грайковской)
Рис. 3
Биопсия почки 14-летнего…
Рис. 3
Биопсия почки 14-летней девочки с тяжелым ожирением, протеинурией, гиперурикемией и метаболическими…
Рис. 3
3
Биопсия почки 14-летней девочки с тяжелым ожирением, протеинурией, гиперурикемией и метаболическим синдромом. Ей сделали диализ в 20 лет и трансплантацию в 21 год. 200× (любезно предоставлено доктором П. Клюге)
См. это изображение и информацию об авторских правах в PMC
Похожие статьи
Оценка и лечение ожирения и метаболического синдрома у детей с ХБП 2-5 стадий на диализе и после трансплантации почки – рекомендации по клинической практике Целевой группы по почечному питанию у детей.
Стабули С., Полдерман Н., Нелмс С.Л., Пальялонга Ф., Остервельд М.Дж.С., Гринбаум Л.А., Варади Б.А., Андерсон С., Хаффнер Д., Деслувер А., Кизальбаш Л., Ренкен-Терхардт Дж., Туоккола Дж., Валле Дж.В., Шоу В., Мицнефес М, Шрофф Р.
Стабули С. и др.
Педиатр Нефрол. 2022 янв; 37(1):1-20. doi: 10.1007/s00467-021-05148-y. Epub 2021 10 августа.
Epub 2021 10 августа.
Педиатр Нефрол. 2022.PMID: 34374836
Бесплатная статья ЧВК.Обзор.
Ожирение при метаболическом синдроме, а также при дисфункции почек.
Садулаева И.А., Васюк Ю.А., Трофименко О.С., Ющук Е.Н., Иванова С.В., Шупенина Е.Ю., Нестерова Е.А.
Садулаева И.А., и соавт.
Тер Арх. 2016;88(10):93-98. doi: 10.17116/терарх301688693-98.
Тер Арх. 2016.PMID: 28635857
Русский.
Распространенность хронической болезни почек у взрослых в Турции с ожирением и метаболическим синдромом: апостериорный анализ исследования хронической болезни почек в Турции.
Аринсой Т., Дегер С.М., Атес К., Алтун Б., Экдер Т., Камсари Т., Серденгекти К., Сулейманлар Г.
Аринсой Т. и соавт.
Джей Рен Нутр. 2016 ноябрь;26(6):373-379. doi: 10.1053/j.jrn.2016.08.004. Epub 2016 15 сентября.
doi: 10.1053/j.jrn.2016.08.004. Epub 2016 15 сентября.
Джей Рен Нутр. 2016.PMID: 27641823
[Хроническая болезнь почек (ХБП) — недавний прогресс. Темы: VI. Хроническая болезнь почек (ХБП) и связанные с ней заболевания; 6. ХБП, ассоциированная с ожирением и метаболическим синдромом].
Вакино С., Ото Х.
Вакино С. и др.
Нихон Найка Гаккай Засси. 2012 10 мая; 101 (5): 1310-7. doi: 10.2169/naika.101.1310.
Нихон Найка Гаккай Засси. 2012.PMID: 22693851
Обзор.
Японский язык.
Аннотация недоступна.Влияние метаболического синдрома на расход энергии в покое у пациентов с хронической болезнью почек.
Родригес CQD, Santos JAP, Quinto BMR, Marrocos MSM, Teixeira AA, Rodrigues CJO, Batista MC.
Родригес CQD и др.
Клин Nutr ESPEN. 2016 Окт;15:107-113. doi: 10.1016/j.clnesp.2016.07.001. Epub 2016 18 августа.
2016 Окт;15:107-113. doi: 10.1016/j.clnesp.2016.07.001. Epub 2016 18 августа.
Клин Nutr ESPEN. 2016.PMID: 28531773
Посмотреть все похожие статьи
Цитируется
Связь между сопутствующими заболеваниями, связанными с ожирением, и оценкой функции почек у детей.
ван Дам MJCM, Pottel H, Vreugdenhil ACE.
ван Дам MJCM и др.
Педиатр Нефрол. 2023 июнь; 38(6):1867-1876. doi: 10.1007/s00467-022-05810-z. Epub 2022 22 ноября.
Педиатр Нефрол. 2023.PMID: 36416955
Бесплатная статья ЧВК.Недоедание и субпопуляции иммунных клеток у детей, перенесших трансплантацию почки.
Шоу Б.И., Ли Х.Дж., Эттенгер Р., Гримм П., Рид Э.Ф., Сарвал М., Стемпора Л., Уоршоу Б., Чжао С., Мартинес О.М., Макивер Н.Дж., Кирк А.
 Д., Чемберс И.Т.
Д., Чемберс И.Т.Шоу Б.И. и др.
Педиатр трансплантат. 2022 дек;26(8):e14371. doi: 10.1111/petr.14371. Epub 2022 8 августа.
Педиатр трансплантат. 2022.PMID: 35938682
Ригидность левого желудочка у детей с терминальной стадией заболевания почек.
Чой А.В., Фонг Н.К., Ли В.В., Хо Т.В., Чан Э.Ю., Ма А.Л., Чунг Ю.Ф.
Чой А.В. и соавт.
Педиатр Нефрол. 2020 июнь;35(6):1051-1060. doi: 10.1007/s00467-020-04484-9. Epub 2020 3 февраля.
Педиатр Нефрол. 2020.PMID: 32016625
Депрессия и нейрокогнитивная дисфункция у детей и молодых людей с хронической болезнью почек.
Kogon AJ, Kim JY, Laney N, Radcliffe J, Hooper SR, Furth SL, Hartung EA.
Когон А.Дж. и соавт.
Педиатр Нефрол. 2019 сен;34(9):1575-1582. doi: 10. 1007/s00467-019-04265-z. Эпаб 2019 2 мая.
1007/s00467-019-04265-z. Эпаб 2019 2 мая.
Педиатр Нефрол. 2019.PMID: 31049719
Кардиометаболические факторы риска, метаболический синдром и прогрессирование хронической болезни почек у детей.
Лалан С., Цзян С., Нг Д.К., Купферман Ф., Варади Б.А., Фурт С., Мицнефес М.М.
Лалан С. и др.
J Педиатр. 2018 ноябрь; 202:163-170. doi: 10.1016/j.jpeds.2018.06.007. Epub 2018 2 июля.
J Педиатр. 2018.PMID: 30041938
Бесплатная статья ЧВК.
Просмотреть все статьи «Цитируется по»
Рекомендации
Kannel WB, Brand N, Skinner JJ, Jr, Dawber TR, McNamara PM. Связь ожирения с артериальным давлением и развитием артериальной гипертензии. Фрамингемское исследование. Энн Интерн Мед. 1967;67:48–59.
—
пабмед
Ривен ГМ.
 Banting Lecture 1988. Роль резистентности к инсулину в заболеваниях человека. Диабет. 1988; 37: 1956–607.
Banting Lecture 1988. Роль резистентности к инсулину в заболеваниях человека. Диабет. 1988; 37: 1956–607.—
пабмед
Дэниэлс С.Р., Кимбалл Т.Р., Моррисон Дж.А., Хури П., Витт С., Мейер Р.А. Влияние безжировой массы тела, жировой массы, артериального давления и полового созревания на массу левого желудочка у детей и подростков. Статистическая, биологическая и клиническая значимость. Тираж. 1995;92:3249–3254.
—
пабмед
Пуарье П., Лемье И., Морьеж П., Дюайи Э.
 , Бланше С., Бержерон Ж., Депре Ж.П. Влияние окружности талии на взаимосвязь между артериальным давлением и инсулином. Исследование здоровья Квебека. Гипертония. 2005; 45: 363–367.
, Бланше С., Бержерон Ж., Депре Ж.П. Влияние окружности талии на взаимосвязь между артериальным давлением и инсулином. Исследование здоровья Квебека. Гипертония. 2005; 45: 363–367.—
пабмед
Юсуф С., Хокен С., Оунпуу С., Баутиста Л., Францози М.Г., Коммерфорд П., Ланг С.К., Румбольдт З., Онен С.Л., Лишенг Л., Таномсуп С., Вангай П., младший, Разак Ф., Шарма А.М., Ананд С.С., Исследователи INTERHEART . Ожирение и риск инфаркта миокарда у 27 000 участников из 52 стран: исследование случай-контроль. Ланцет. 2005; 366:1640–1649.
—
пабмед
Типы публикаций
термины MeSH
Основные нарушения обмена веществ у детей с диабетической нефропатией
Основные нарушения обмена веществ у детей с диабетической нефропатией
ISSN: 2090-7214
Номинация на премию 20+ миллионов читателей
Цитаты: 1487
Клиники здоровья матери и ребенка получили 1487 цитат согласно отчету Google Scholar
- Журнал GenamicsSeek
- Поиск ссылок
- Университет Хамдарда
- ЭБСКО А-Я
- Публикации
- Женевский фонд медицинского образования и исследований
- Европаб
- Академия Google
Международная конференция по педиатрии и детскому здоровью
Дубай, ОАЭ
3-я Международная конференция по педиатрии и детской неврологии
Франкфурт, Германия Твиты от MaternalHealthJ
Специальный выпуск — (2021) Том 0, Выпуск 0
- Посмотреть PDF
- Скачать PDF
Основные метаболические нарушения у детей с диабетической нефропатией
Евгения Бурлака *
Кафедра педиатрии, Медицинский университет имени Богомольца, Киев, Украина
* Соответствие:
Др.
Евгения Бурлака, кафедра педиатрии, медицинский университет имени Богомольца, Киев,
Украина, Электронная почта:
Получено: 05 июля 2021 г.
Опубликовано:
26 июля 2021 г., DOI: 10.35248/2090-7214.21.18.e357
Описание
Известно расширенное преобладание диабета I типа (СД1)
как юношеский диабет или инсулинозависимый диабет,
хроническое состояние, при котором поджелудочная железа мало или совсем не вырабатывает
инсулин. Диабет I типа имеет несколько осложнений, которые включают:
Диабет I типа имеет несколько осложнений, которые включают:
Ишемическая болезнь сердца, Инсульт, Зрительный импеданс, Диабетик
Нефропатия (DN) и терминальная стадия почечной инфекции (ESRD).
Приобретенные нарушения обмена веществ — это наследственные состояния,
о проблемах пищеварения или метаболических проблемах. Унаследовано
Метаболические расстройства будут иметь дефектный ген, который приводит к
недостаточность ферментов. Метаболизм относится к распаду сложных
пищу в простые соединения с помощью метаболических ферментов, которые
приводит к сложному набору химических реакций.
Существует несколько типов наследственных нарушений обмена веществ, которые
приводит к нескольким типам расстройств, особенно у детей. Некоторые из
это болезнь Ниманна-Пика, при которой у детей развивается печень
расширение. Болезнь Тея-Сакса, приводящая к поражению
Нервы и нервные клетки, болезнь Фабри, вызывающая боль в
Почки и сердце.
Диабетическая нефропатия также является нарушением обмена веществ, которое приводит
при тяжелых осложнениях почек. Факторы риска этого заболевания
Факторы риска этого заболевания
включают гипергликемию (высокий уровень сахара в крови),
Гипертония (высокое кровяное давление) и повреждение крови
сосуды сетчатки (диабетическая ретинопатия), повышение калия
уровня в крови (гиперкалиемия).
Диабетики Нефропатия диагностируется различными методами с использованием
Анализы крови, анализы мочи, визуализирующие исследования, биопсия почек и почек
функциональное испытание. Лечение этого заболевания включает различные
лекарства для контроля высокого уровня сахара в крови, высокого кровяного давления, контроля уровня холестерина в крови, улучшения костей
здоровье и контроль уровня креатинина и белка в моче.
Диализ также может помочь при диабетической нефропатии.
Диализ бывает двух видов: гемодиализ и перитонеальный.
диализ. Гемодиализ – это процедура, при которой диализный аппарат
и специальный фильтр, называемый искусственной почкой, или диализатор.
используется для очистки вашей крови. Перитонеальный диализ удаляет отходы
продукции из крови при неэффективной работе почек.
Первая причина большинства наследственных проблем с обменом веществ – это качество
трансформации, которая произошла много лет назад. Каждый приобретенный
метаболические проблемы очень редко встречаются у всех. Учтены все
вместе, приобретенные проблемы с обменом веществ могут повлиять примерно на 1 из
каждые 1000-2500 новорожденных. В некоторых местах, например,
Ашкенази (евреи очаговой и восточноевропейской родословной),
влияние приобретенных проблем с обменом веществ выше.
Диабетическая нефропатия представляет собой почечное заболевание 1-го и
сахарный диабет 2 типа. Около 25% людей с диабетом
в конце концов создают почечную недостаточность. Диабетическая нефропатия
влияет на способность почек выполнять типичную для них работу
удаление отходов и дополнительных жидких тел. Самый идеальный
Подход к диабетической нефропатии заключается в поддержании здорового образа жизни
стиль и снижение диабета и гипертонии.
С годами это состояние постепенно наносит вред почкам, чувствительным
рамки.
