Митохондриальная патология: Митохондриальная патология у детей | #01/16
причины, симптомы и методы лечения
Содержимое
- 1 Митохондриальная патология у детей
- 1.1 Митохондриальная патология у детей
- 1.2 Причины митохондриальной патологии у детей
- 1.3 Симптомы митохондриальной патологии у детей
- 1.4 Методы диагностики митохондриальной патологии у детей
- 1.5 Методы лечения митохондриальной патологии у детей
- 1.6 Роль митохондрий в организме человека
- 1.7 Генетическая природа митохондриальных патологий
- 1.8 Построение рационального питания для детей с митохондриальной патологией
- 1.9 Влияние митохондриальной патологии на физическое развитие детей
- 1.10 Психологические особенности детей с митохондриальной патологией
- 1.11 Видео по теме:
- 1.12 Вопрос-ответ:
- 1.12.0.1 Что такое митохондриальная патология?
- 1.12.0.2 Какие причины митохондральной патологии у детей?
- 1.12.0.3 Какие симптомы митохондриальной патологии могут проявиться у детей?
Митохондриальная патология у детей является редким генетическим заболеванием, которое оказывает значительное влияние на функционирование клеток и органов. В данной статье рассматриваются основные причины, симптомы и методы диагностики и лечения этого заболевания. Также описываются возможные осложнения и прогнозы для пациентов с митохондриальной патологией.
В данной статье рассматриваются основные причины, симптомы и методы диагностики и лечения этого заболевания. Также описываются возможные осложнения и прогнозы для пациентов с митохондриальной патологией.
Митохондрии — это специальные органыллы, находящиеся внутри клеток, отвечающие за процесс образования энергии. Они являются своеобразными «электростанциями» организма, так как производят большую часть необходимой клетке энергии в форме АТФ. Однако, как и любые другие органы, митохондрии могут подвергаться заболеваниям, что сопровождается нарушением их функций. Патологии, связанные с митохондриями, называются митохондриальными заболеваниями.
Митохондриальная патология может развиваться у детей в результате наследственности, когда нарушения передаются от родителей генетическим путем. Наследственные митохондриальные заболевания могут иметь различные формы и проявления, так как могут быть задействованы разные гены и комбинации их мутаций. В некоторых случаях, митохондриальная патология может возникать путем новых мутаций сперматозоида или яйцеклетки, что приводит к генетическим изменениям у ребенка.
Симптомы митохондриальной патологии могут варьироваться в зависимости от области и степени повреждения митохондрий. Однако, часто наблюдается общая симптоматика, которая включает вялость, быструю утомляемость, задержку развития, мышечную слабость, проблемы с сердцем, зрительные нарушения, проблемы с пищеварением и др. При наличии подозрений на митохондриальную патологию, рекомендуется обратиться к врачу и провести специализированные исследования для установления точного диагноза.
Лечение митохондриальной патологии направлено на облегчение симптомов и замедление прогрессирования заболевания. Оно состоит из нескольких компонентов, включая поддержку функции митохондрий, питательную терапию, физиотерапию и прочие методы, направленные на укрепление организма и снижение негативного влияния заболевания. В некоторых случаях, когда митохондрии находятся в сильно поврежденном состоянии, может потребоваться трансплантация органов или использование экспериментальных методов лечения.
Митохондриальная патология у детей
Митохондрии — это органеллы, которые находятся внутри клеток и отвечают за производство энергии. Митохондриальная патология у детей — это группа генетических заболеваний, которые приводят к нарушениям в функционировании митохондрий.
Митохондриальная патология у детей — это группа генетических заболеваний, которые приводят к нарушениям в функционировании митохондрий.
Симптомы митохондриальной патологии у детей могут проявляться на ранних стадиях развития. Это может быть слабость мышц, задержка развития, эпилептические припадки, проблемы с сердцем, плохая координация движений и другие.
Диагностика митохондриальной патологии у детей может включать биохимические и генетические тесты, магнитно-резонансную томографию, биопсию мышц и другие методы исследования.
Лечение митохондриальной патологии у детей направлено на снижение симптомов и поддержание функции митохондрий. Это может включать прием лекарств, физиотерапию, диетотерапию и другие подходы в зависимости от конкретного случая.
Митохондриальная патология у детей является серьезным заболеванием, которое требует внимательного наблюдения и своевременного лечения. Поэтому родители детей с подозрением на митохондриальную патологию должны обратиться к специалисту для диагностики и назначения оптимального лечения.
Причины митохондриальной патологии у детей
Генетические мутации являются основной причиной митохондриальной патологии у детей. Эти мутации могут наследоваться от одного или обоих родителей, что делает их наследственными. Мутации могут влиять на разные гены, ответственные за процессы, связанные с митохондриями, включая синтез энергии и метаболические функции.
Нуклеарные мутации возникают в ДНК ядерных клеток и могут влиять на образование определенных белков, необходимых для нормального функционирования митохондрий. Эти мутации могут быть унаследованы или возникнуть новыми в результате мутаций в родительских клетках.
Митохондриальные мутации возникают в ДНК митохондрий и могут влиять на их функционирование. Унаследованные от матери, митохондриальные мутации могут иметь различную степень воздействия на организм ребенка, в зависимости от количества пораженных митохондрий в клетках.
В некоторых случаях, митохондриальная патология может быть вызвана внешними факторами, такими как инфекции, токсины и окружающая среда. Эти факторы могут воздействовать на митохондрии и приводить к нарушению их функционирования.
Эти факторы могут воздействовать на митохондрии и приводить к нарушению их функционирования.
Митохондриальная патология у детей имеет много причин, и в каждом случае необходимо проводить тщательное генетическое исследование, чтобы определить их конкретную природу. Понимание этих причин является важным шагом к разработке эффективных методов лечения и улучшению прогноза для детей, страдающих от этого заболевания.
Симптомы митохондриальной патологии у детей
Митохондриальная патология является группой редких и наследственных заболеваний, которые воздействуют на функционирование митохондрий — органоидов, отвечающих за энергетическое обеспечение клеток. У детей с митохондриальной патологией наблюдаются различные симптомы, которые могут быть разнообразными и варьировать в зависимости от вида и степени поражения.
Другим характерным симптомом митохондриальной патологии у детей является мышечная слабость и атрофия. Ребенок может испытывать трудности при ходьбе, подъеме по лестнице или поддержании правильной осанки. Возможны подергивания мышц и непроизвольные судороги, которые могут значительно ограничивать двигательную активность ребенка.
Возможны подергивания мышц и непроизвольные судороги, которые могут значительно ограничивать двигательную активность ребенка.
Другими распространенными симптомами митохондриальной патологии у детей могут быть задержка психомоторного развития, проблемы с речью и координацией движений, снижение интеллектуальных способностей, проблемы с зрением и слухом. В некоторых случаях, поражение митохондрий может влиять на работу органов, таких как сердце, печень или почки, что приводит к нарушениям их функционирования.
Методы диагностики митохондриальной патологии у детей
Митохондриальная патология является сложным нейродегенеративным заболеванием, что требует применения специальных методов диагностики для своего обнаружения. Врачи используют различные молекулярно-генетические методы, чтобы определить наличие митохондриальных мутаций, которые могут быть ответственными за развитие патологии.
Одним из таких методов является исследование ДНК с целью выявления генетических изменений, которые могут влиять на функцию митохондрий. Это может включать секвенирование ДНК, позволяющее определить конкретные мутации, а также определение уровня митохондриальной ДНК в организме.
Это может включать секвенирование ДНК, позволяющее определить конкретные мутации, а также определение уровня митохондриальной ДНК в организме.
Для подтверждения диагноза митохондриальной патологии может потребоваться проведение электрофизиологических исследований, таких как электромиография и электрокардиография. Эти методы помогают оценить функцию мышц и сердца, которые являются наиболее часто поражаемыми органами при митохондриальной патологии.
Также могут быть использованы другие методы диагностики, такие как биопсия митохондрий, измерение энергии и метаболического направленности в клетках, анализ митохондриальной структуры и функции с использованием микроскопии и электронной микроскопии.
Все эти методы диагностики помогают врачам определить причину митохондриальной патологии у ребенка, что позволяет разработать эффективный план лечения и улучшить прогноз заболевания. Раннее обнаружение митохондриальной патологии через использование различных методов диагностики играет важную роль в управлении этим состоянием и улучшении качества жизни детей.
Методы лечения митохондриальной патологии у детей
Лечение митохондриальной патологии у детей – сложный и многоступенчатый процесс, направленный на устранение симптомов и замедление прогрессирования заболевания. Основной упор делается на поддержание функционирования митохондрий и снижение негативного влияния мутаций на работу клеток.
Для улучшения функции митохондрий также могут быть использованы препараты, которые содержат коферментный коэнзим Q10. Он является ключевым компонентом в процессе транспорта электронов и помогает оптимизировать работу митохондрий.
Однако лишь медикаментозное лечение недостаточно для борьбы с митохондриальной патологией у детей. Постоянное наблюдение у врача и поддержание здорового образа жизни также играют важную роль в процессе лечения. Для этого особое внимание уделяется правильному питанию, физическим нагрузкам и регулярному приему витаминов и микроэлементов.
Помимо этого, при лечении митохондриальной патологии у детей может быть использована терапия генами. Это новаторский подход, который направлен на изменение генетической составляющей и восстановление нормального функционирования митохондрий. Однако такая терапия все еще находится на стадии исследований и разработки и пока не является широко доступной методикой для лечения.
Это новаторский подход, который направлен на изменение генетической составляющей и восстановление нормального функционирования митохондрий. Однако такая терапия все еще находится на стадии исследований и разработки и пока не является широко доступной методикой для лечения.
Помимо основных методов лечения, врачи могут рекомендовать дополнительные терапевтические мероприятия, которые могут помочь в уменьшении симптомов и улучшении качества жизни пациента. В каждом случае выбор методов лечения зависит от конкретной ситуации и индивидуальных особенностей ребенка, поэтому важно получить консультацию у специалиста и разработать индивидуальный план лечения.
Роль митохондрий в организме человека
Митохондрии – это маленькие органеллы, которые содержатся внутри клеток человека. Они играют ключевую роль в обеспечении энергией всех процессов в организме. Митохондрии являются своего рода фабриками, которые производят энергию в форме молекулы АТФ (аденозинтрифосфата).
Процесс производства АТФ называется дыхательной цепью. Кислород, поступающий в организм с воздухом, проходит через легкие и поступает в клетки. В митохондриях, с помощью различных ферментов, происходит окисление различных веществ, в результате чего выделяется энергия. Эта энергия затем используется клетками для выполнения своих функций.
Митохондрии присутствуют во всех клетках человека, но их количество может варьироваться в зависимости от типа клетки. Так, в мозге и мышцах, которые имеют высокую энергетическую потребность, митохондрии обычно присутствуют в большом количестве.
Кроме того, митохондрии выполняют еще несколько важных функций. Они принимают участие в регуляции стабильности внутренней среды клеток, участвуют в обработке и разрушении некоторых веществ, а также играют роль в клеточном делении и апоптозе (программированной клеточной смерти).
Однако, дефекты митохондрий могут привести к серьезным нарушениям в работе организма, особенно у детей. Митохондриальная патология характеризуется неправильной работой митохондрий, что может привести к различным симптомам и проблемам со здоровьем.
Генетическая природа митохондриальных патологий
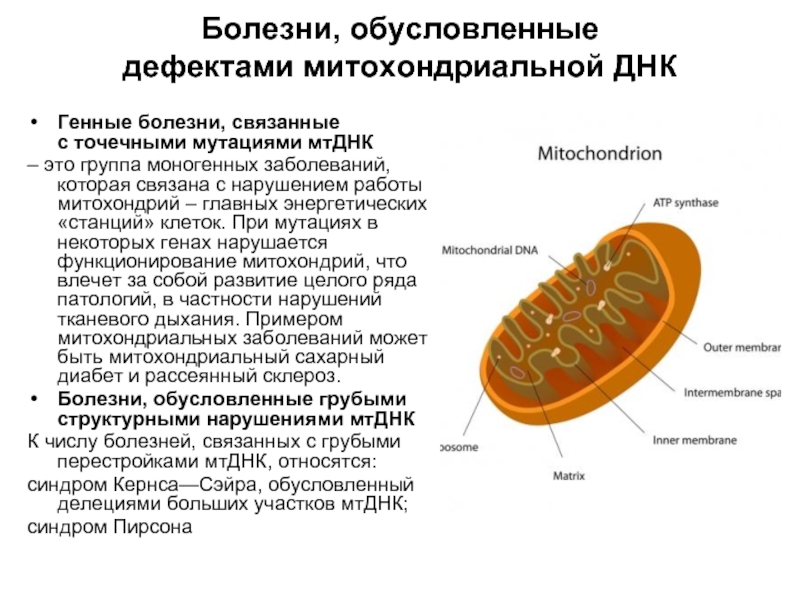
Митохондрии — это органеллы внутри клеток, которые играют ключевую роль в обеспечении энергии организма. Митохондриальные патологии — это группа генетических заболеваний, связанных с дефектами в митохондриальной ДНК.
Митохондриальная ДНК (mtDNA) отличается от ядерной ДНК (nDNA) тем, что передается только по материнской линии. Это означает, что, если мать имеет дефект mtDNA, есть риск передачи этого дефекта своим детям.
Генетическая природа митохондриальных патологий может быть связана с точечными мутациями, делециями (удалениями) или дупликациями (копированиями) mtDNA. Это приводит к дисфункции митохондрий и нарушению их способности производить энергию.
Важно отметить, что митохондриальные патологии могут проявляться по-разному в разных органах и тканях, так как митохондрии присутствуют практически во всех клетках организма. Это может объяснить широкий спектр симптомов и клинических проявлений этих заболеваний у детей.
Построение рационального питания для детей с митохондриальной патологией
Митохондриальная патология у детей требует особого внимания при построении рационального питания. Для обеспечения достаточного количества энергии и поддержания здоровья детей с этим заболеванием рекомендуется следовать определенным принципам питания.
В рационе детей с митохондриальной патологией должны присутствовать нежирные молочные продукты, такие как йогурт, творог и кефир. Эти продукты богаты кальцием и важны для нормального развития костной ткани, а также для поддержания нормального функционирования митохондрий. Подавать молочные продукты лучше небольшими порциями в течение всего дня.
Овощи и фрукты являются обязательным компонентом рациона детей с митохондриальной патологией. Они богаты витаминами, минералами и антиоксидантами, которые помогают бороться с свободными радикалами и поддерживают здоровье клеток митохондрий. Органические овощи и фрукты предпочтительнее, так как они содержат меньше пестицидов и химических добавок.
Важно также учитывать индивидуальные потребности ребенка и его личные предпочтения. В рационе должны быть включены разнообразные продукты и блюда, чтобы обеспечить полноценное питание, а также с учетом ограничений и рекомендаций лечащего врача.
Для детей с митохондриальной патологией также рекомендуется ограничение потребления продуктов, богатых сахаром и простыми углеводами. Вместо этого, следует предпочитать продукты с низким гликемическим индексом, такие как цельнозерновые продукты, овощи и бобовые. Эти продукты обеспечивают постепенное и равномерное поступление энергии, не нагружая митохондрии и делая питание более устойчивым.
Влияние митохондриальной патологии на физическое развитие детей
Митохондриальная патология является серьезным нарушением в работе клеток нашего организма и может оказывать значительное влияние на физическое развитие детей. У детей, страдающих от этого заболевания, часто наблюдаются задержки в росте и недостаточный вес. Это связано с тем, что митохондрии ответственны за производство энергии в клетках, и если она не производится в достаточном количестве, это может привести к замедлению роста и развития.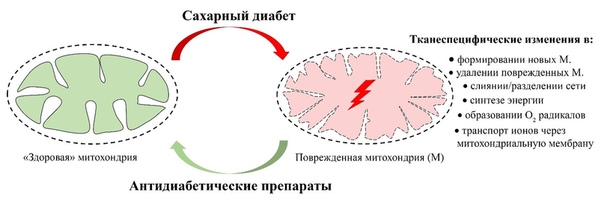
Кроме того, митохондриальная патология может также влиять на силу и выносливость детей. У них часто наблюдаются слабость мышц, быстрая утомляемость и ограниченная физическая активность. Это происходит из-за того, что митохондрии играют важную роль в обеспечении клеток энергией, необходимой для нормального функционирования мышц. Недостаток энергии, вызванный митохондриальной патологией, приводит к ослаблению мышц и их недостаточному функционированию.
Кроме того, митохондриальная патология может влиять на развитие костной системы у детей. Дефекты в функционировании митохондрий могут приводить к нарушению процесса образования костей и снижению их прочности. Это может проявляться в виде задержки роста костей, деформаций скелета и повышенной склонности к переломам.
Таким образом, митохондриальная патология оказывает серьезное влияние на физическое развитие детей. Задержки в росте и недостаточный вес, слабость мышц и ограниченная физическая активность, а также нарушения в развитии костной системы — все это является последствиями нарушений в работе митохондрий и требует специализированного медицинского вмешательства.
Психологические особенности детей с митохондриальной патологией
Митохондриальная патология — это группа заболеваний, связанных с нарушением функций митохондрий — органелл внутри клеток, отвечающих за энергетический обмен. У детей с митохондриальной патологией наблюдаются ряд психологических особенностей, вызванных нарушением работы этих органов.
Одной из характерных особенностей является нарушение памяти. Дети с митохондриальной патологией могут испытывать трудности в запоминании и воспроизведении информации. Этот фактор может отразиться на их успеваемости в школе и потребовать особых подходов к обучению и оценке знаний.
Затруднения в коммуникации — еще одна особенность, с которой сталкиваются дети с митохондриальной патологией. У них может быть затруднено понимание речи, сложности в выражении своих мыслей и эмоций. Это требует терпения и поддержки со стороны родителей и образовательных учреждений.
Ограниченная физическая активность является еще одним психологическим аспектом, с которым сталкиваются дети с митохондриальной патологией. Они испытывают затруднения с физической активностью, что может повлиять на их самооценку и общее настроение. Важно создать для них условия, где они могут проявить свои способности и достичь успеха в других сферах.
Они испытывают затруднения с физической активностью, что может повлиять на их самооценку и общее настроение. Важно создать для них условия, где они могут проявить свои способности и достичь успеха в других сферах.
Социальная изоляция является одной из основных проблем психологического характера у детей с митохондриальной патологией. Из-за избирательного ограничения физической активности и трудностей в коммуникации они могут чувствовать себя неудобно в обществе сверстников. Важно создать для них дружелюбную и поддерживающую среду, где они могут чувствовать себя комфортно и принятые.
Видео по теме:
Вопрос-ответ:
Что такое митохондриальная патология?
Митохондриальная патология — это группа генетических заболеваний, связанных с дефектами в митохондриях, которые отвечают за производство энергии в клетках организма. В случае митохондриальной патологии, клетки не получают достаточно энергии для нормальной работы, что приводит к различным симптомам и повреждениям органов.
В случае митохондриальной патологии, клетки не получают достаточно энергии для нормальной работы, что приводит к различным симптомам и повреждениям органов.
Какие причины митохондральной патологии у детей?
Митохондриальные патологии обусловлены генетическими дефектами в наследственном материале человека. Эти дефекты могут быть унаследованы от одного или обоих родителей или возникнуть случайно во время разделения клеток. Некоторые формы митохондриальной патологии могут быть вызваны мутациями в определенных генах, отвечающих за функционирование митохондрий.
Какие симптомы митохондриальной патологии могут проявиться у детей?
Митохондриальные патологии могут проявляться различными симптомами, такими как: задержка психомоторного развития, умственная отсталость, мышечная слабость, проблемы с координацией движений, задержка роста, ухудшение зрения и слуха, проблемы с сердечно-сосудистой системой и дыхательной системой, эпилептические приступы и другие растроиства центральной нервной системы, а также различные проблемы с пищеварением и выведением шлаков из организма.
Митохондриальные эпилепсии
10 Февраля 2019г.
Митохондриальные заболевания представлены большой группой. Они развиваются в результате нарушения нормального функционирования митохондрий – главного поставщика энергии в клетки. Эти нарушения могут быть избирательными и затрагивать различные системы организма. Если изменения происходят в тканях и органах нервной системы, то развивается митохондриальная эпилепсия.
Причины болезни
Митохондриальная эпилепсия является следствием дефекта митохондрий, который может быть обусловлен генетическими, биохимическими или структурными изменениями. Они могут затрагивать различные звенья, которые участвуют в передаче энергии, но результат всегда будет одинаковым – сниженная продукция АТФ – основного источника энергии для всех клеточных процессов. В результате развивается нестабильность потенциала на мембранах нервных клеток, из-за чего они погибают. Их место занимают новые клетки, но несмотря на дефицит энергии, они склонны к постоянной активности. Такие изменения приводят к появлению патологического очага возбуждения в головном мозге, который и является причиной развития митохондриальной эпилепсии.
Такие изменения приводят к появлению патологического очага возбуждения в головном мозге, который и является причиной развития митохондриальной эпилепсии.
Диагностика заболевания
Митохондриальные заболевания могут быть схожи с другими видами мультисистемной патологии, поэтому их необходимо отличать друг от друга. Точку в этом вопросе может поставить генетическое тестирование, которое поможет установить характерный фенотип или специфическую мутацию. Обычно назначают секвенирование ядерной или митохондриальной ДНК. Данный метод точен и информативен для анализа индивидуальной генетической изменчивости. С его помощью можно расшифровать генетический код, который уникален для каждого индивидуума. Выбор конкретного метода исследования зависит от клинических проявлений у пациента. При несиндромальной митохондриальной эпилепсии предпочтение отдается секвенированию ядерной ДНК, в остальных случаях может назначаться секвенирование митохондриальной ДНК. Таким образом, оба метода применяются при диагностике заболевания, и они доступны в медико-генетическом центре «Геномед».
Среди других методов диагностики могут применяться:
- общеклинические анализы. В крови пациентов с митохондриальной эпилепсией выявляется повышенный уровень молочной кислоты (лактата), ацилкарнитина, кетоновых тел, в моче – повышение концентрации органических кислот;
- биопсия мышц. Позволяет получить митохондрии и изучить активность ферментов дыхательной цепи;
- КТ или МРТ головного мозга. Применяется для исключения опухолевой природы эпилепсии. Иногда специалистам удается выявить очаговые изменения в головном мозге, которые могут быть следствием метаболической энцефалопатии;
- ЭЭГ. Позволяет оценить электрическую активность мозга, выявить очаги патологической импульсации.
Диагностика заболевания также основывается и на клинической картине. У пациентов с митохондриальной эпилепсией часто отмечаются психические расстройства, мышечная слабость, быстрая утомляемость, светобоязнь и др.
Лечение митохондриальной эпилепсии
Эффективной терапии, которая могла бы воздействовать на причину митохондриальной эпилепсии, пока не существует.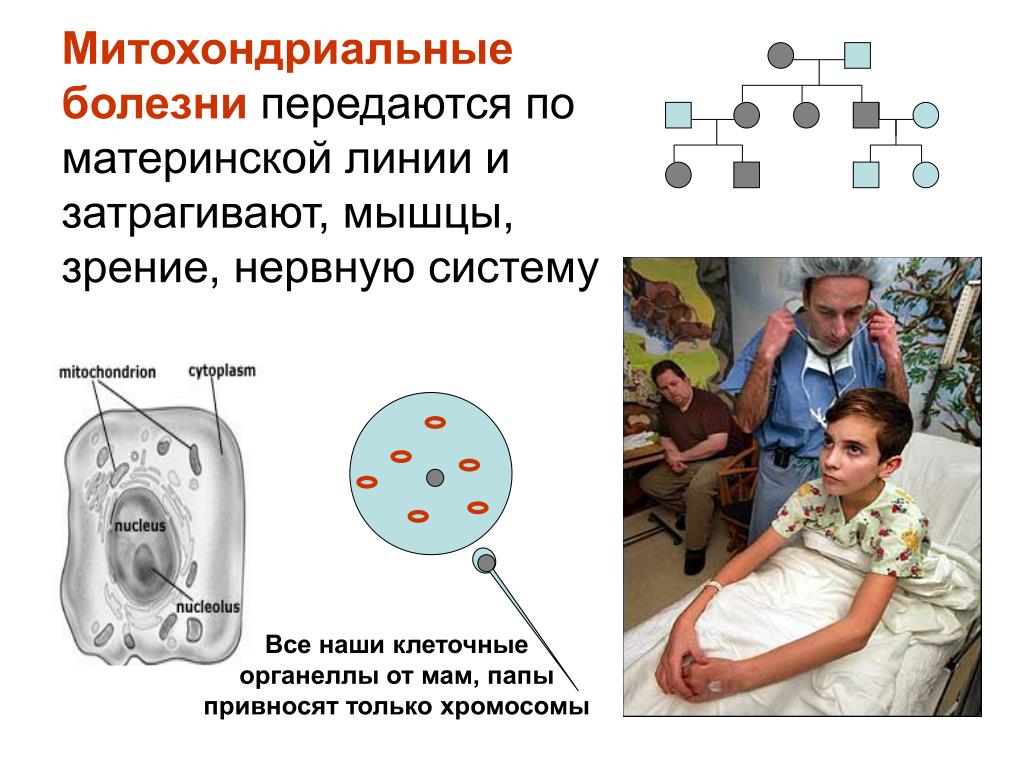 Пациенты получают симптоматическое лечение. Дополнительно назначаются препараты, которые снижают уровень лактата в крови, витамины группы В, аскорбиновая кислота, токоферол, янтарная кислота. Если митохондриальная эпилепсия сочетается с патологией других органов, то схема лечения дополняется необходимыми лекарственными препаратами.
Пациенты получают симптоматическое лечение. Дополнительно назначаются препараты, которые снижают уровень лактата в крови, витамины группы В, аскорбиновая кислота, токоферол, янтарная кислота. Если митохондриальная эпилепсия сочетается с патологией других органов, то схема лечения дополняется необходимыми лекарственными препаратами.
Прогноз во многом зависит от того, насколько своевременно была выявлена митохондриальная эпилепсия. В благоприятных случаях удается купировать основные симптомы и улучшить качество жизни пациентов, несмотря на необходимость пожизненного лечения.
Митохондриальная патология — Нейродегенерация — Книжная полка NCBI
Ключевые моменты, поднятые отдельными докладчиками
Из-за высокой потребности в энергии нейроны особенно уязвимы к травмам и гибели из-за дисфункциональных митохондрий.
Патологические и физиологические данные свидетельствуют о дисфункции митохондрий при всех основных нейродегенеративных заболеваниях.
Остаются вопросы относительно того, является ли митохондриальная дисфункция причиной нейродегенеративных заболеваний. Даже если это не является причиной, митохондриальная дисфункция все еще очень важна и, вероятно, способствует заболеванию. Идентификация методов лечения для улучшения митохондриальной функции или деградации дисфункциональных митохондрий может иметь смысл.
Изучение первичных митохондриальных заболеваний может пролить свет на нейродегенеративные заболевания, которые проявляют сходную патологию. Поскольку оба типа заболеваний поражают множество путей и систем органов, они требуют подхода системной биологии.
Потенциальные терапевтические подходы включают лекарства, индуцирующие митохондриальный генез, каталитические антиоксиданты для защиты от активных форм кислорода, регуляторы внутриклеточного кальция и регуляторы окислительно-восстановительного потенциала через митохондриальную мембрану. Поддержание окислительно-восстановительного потенциала имеет решающее значение для целостности митохондрий и контроля окислительного фосфорилирования.

Митохондрии — это клеточные органеллы, ответственные за окислительное фосфорилирование, жизненно важный процесс превращения питательных веществ в молекулы аденозинтрифосфата (АТФ), которые обеспечивают энергию для нормального функционирования клеток. Каждый нейрон имеет по меньшей мере сотни митохондрий. Поскольку нервные клетки являются постмитотическими, любое стойкое митохондриальное повреждение будет накапливаться с возрастом и приводить к дисфункции. Широко распространенное повреждение митохондрий приводит к гибели клеток, потому что они больше не могут производить достаточно энергии. Действительно, сами митохондрии высвобождают ферменты, ответственные за гибель клеток. Мозг особенно уязвим для митохондриальной дисфункции, поскольку его энергетические потребности выше, чем у любого другого органа тела. Мозг составляет всего 2 процента массы тела, но при этом потребляет 20 процентов кислорода.
Функционирование митохондрий определяется двумя отдельными геномами, один в митохондриях, известный как митохондриальная ДНК (мтДНК), а другой в ядре. Митохондриальный геном кодирует 13 белков, каждый из которых жизненно важен для окислительного фосфорилирования. Ядерный геном кодирует около 1500 генов, участвующих в митохондриальной биологии, включая белки, необходимые для репликации мтДНК, транскрипции, трансляции и посттрансляционных модификаций. Существует только одна копия мтДНК, унаследованная от матери, по сравнению с двумя копиями ядерной ДНК, одна от матери, а другая от отца. Митохондрии не только ответственны за окислительное фосфорилирование, но также играют важную роль в метаболизме и передаче сигналов, включая синтез жирных кислот, метаболизм кетоновых тел, гомеостаз кальция и апоптоз. В частности, митохондрии обеспечивают большую часть клеточной энергии в форме АТФ. Они генерируют и регулируют активные формы кислорода, буферизуют уровни кальция внутри клетки и контролируют апоптоз (Wallace, 2005, 2010).
Митохондриальный геном кодирует 13 белков, каждый из которых жизненно важен для окислительного фосфорилирования. Ядерный геном кодирует около 1500 генов, участвующих в митохондриальной биологии, включая белки, необходимые для репликации мтДНК, транскрипции, трансляции и посттрансляционных модификаций. Существует только одна копия мтДНК, унаследованная от матери, по сравнению с двумя копиями ядерной ДНК, одна от матери, а другая от отца. Митохондрии не только ответственны за окислительное фосфорилирование, но также играют важную роль в метаболизме и передаче сигналов, включая синтез жирных кислот, метаболизм кетоновых тел, гомеостаз кальция и апоптоз. В частности, митохондрии обеспечивают большую часть клеточной энергии в форме АТФ. Они генерируют и регулируют активные формы кислорода, буферизуют уровни кальция внутри клетки и контролируют апоптоз (Wallace, 2005, 2010).
Митохондриальные дефекты обнаруживаются при патологических исследованиях всех основных нейродегенеративных заболеваний, сказал Вамси Мутха из Гарвардской медицинской школы. Диапазон митохондриальных дефектов включает фрагментацию и другие морфологические изменения, повышенную частоту мутаций в мтДНК, изменения проницаемости митохондриальных мембран, изменения окислительно-восстановительного потенциала, накопление мутантных белков и нарушение окислительного фосфорилирования (Reddy and Reddy, 2011). Но являются ли эти митохондриальные дефекты причиной нейродегенеративных заболеваний, является фундаментальным вопросом, сказал Мутха. Потенциальные роли митохондрий в нейродегенеративных заболеваниях, по его мнению, троякие: (1) они содержат первичные поражения и, таким образом, служат первичным источником патологии болезни; (2) они функционируют должным образом, но служат медиаторами или усилителями болезни; или (3) они являются сторонними наблюдателями, которые не способствуют патологии. Даже если митохондриальные дефекты не являются причиной, они, вероятно, способствуют этому, отмечает Нил Коуэлл из Бостонского университета, и поэтому любая терапия, которая сохраняет, улучшает или корректирует митохондриальную функцию, вероятно, будет полезна для предотвращения гибели клеток и прогрессирования заболевания.
Диапазон митохондриальных дефектов включает фрагментацию и другие морфологические изменения, повышенную частоту мутаций в мтДНК, изменения проницаемости митохондриальных мембран, изменения окислительно-восстановительного потенциала, накопление мутантных белков и нарушение окислительного фосфорилирования (Reddy and Reddy, 2011). Но являются ли эти митохондриальные дефекты причиной нейродегенеративных заболеваний, является фундаментальным вопросом, сказал Мутха. Потенциальные роли митохондрий в нейродегенеративных заболеваниях, по его мнению, троякие: (1) они содержат первичные поражения и, таким образом, служат первичным источником патологии болезни; (2) они функционируют должным образом, но служат медиаторами или усилителями болезни; или (3) они являются сторонними наблюдателями, которые не способствуют патологии. Даже если митохондриальные дефекты не являются причиной, они, вероятно, способствуют этому, отмечает Нил Коуэлл из Бостонского университета, и поэтому любая терапия, которая сохраняет, улучшает или корректирует митохондриальную функцию, вероятно, будет полезна для предотвращения гибели клеток и прогрессирования заболевания.
В этой главе обобщаются презентации семинаров, в которых приводятся доказательства митохондриальной дисфункции при основных нейродегенеративных заболеваниях. По словам нескольких участников, поскольку нет четких данных о том, является ли митохондриальная дисфункция причиной, может быть полезно взглянуть на первичные митохондриальные заболевания и применить системный подход к исследованиям.
МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ И НЕЙРОДЕГЕНЕРАТИВНЫЕ ЗАБОЛЕВАНИЯ
Как отмечалось выше, митохондриальная дисфункция обнаруживается при основных нейродегенеративных заболеваниях. В этом разделе представлены презентации семинаров о митохондриальной дисфункции при болезни Паркинсона, боковом амиотрофическом склерозе (БАС), болезни Гентингтона и болезни Альцгеймера.
Болезнь Паркинсона
Болезнь Паркинсона характеризуется потерей дофаминсодержащих нейронов в области мозга, известной как черная субстанция. Патологические и другие исследования убедительно показали, что дефицит митохондрий накапливается в этой области мозга с возрастом, сказал Ричард Юл из Национального института неврологических расстройств и инсульта. Выступление Юла было сосредоточено на функции двух белков, которые мутируют при семейной болезни Паркинсона с ранним началом: Parkin и PINK1 (предполагаемая киназа 1, индуцированная PTEN).
Выступление Юла было сосредоточено на функции двух белков, которые мутируют при семейной болезни Паркинсона с ранним началом: Parkin и PINK1 (предполагаемая киназа 1, индуцированная PTEN).
Нормальные функции Parkin и PINK1 до недавнего времени не были хорошо изучены, сказал Юл. Накапливаются данные от нескольких видов о том, что эти белки обычно работают вместе, чтобы вызвать очищение поврежденных митохондрий, процесс, известный как митофагия. Само собой разумеется, что в случае мутации они могут не индуцировать митофагию, в результате чего дисфункциональные митохондрии накапливаются внутри клетки и вызывают гибель. Таким образом, нарушение митофагии связано с этиологией болезни Паркинсона с ранним началом (Narendra and Youle, 2011).
Когда митохондрии находятся в состоянии стресса или повреждены, заметил Юл, они накапливают PINK1. PINK1 представляет собой митохондриальный белок, обычно прикрепленный к внешней мембране митохондрии в низких концентрациях. Когда митохондриальная мембрана теряет свой электрический потенциал — из-за мутаций ДНК, активных форм кислорода (АФК), 1 или других возмущений — PINK1 увеличивается. Увеличение концентрации PINK1, в свою очередь, способствует рекрутированию паркина, который представляет собой убиквитинлигазу, из цитозоля. Паркин помечает поврежденную митохондрию убиквитином, процесс, запускающий образование аутофагосомы (см. также главу 3). Аутофагосома поглощает поврежденную митохондрию, затем сливается с лизосомой, которая разрушает ее. По словам Юла, результаты исследований PINK1/Parkin, которые были воспроизведены в нескольких лабораториях, открыли новый путь контроля качества митохондрий. Он отметил, что большая часть ранней работы в этой области была выполнена на культивируемых клеточных линиях, потому что соединения, используемые для индукции этого пути в культивируемых клеточных линиях, были слишком токсичны для нейронов. Однако совсем недавно две группы показали этот путь в нейронах (Cai et al., 2012; Wang et al., 2011).
Увеличение концентрации PINK1, в свою очередь, способствует рекрутированию паркина, который представляет собой убиквитинлигазу, из цитозоля. Паркин помечает поврежденную митохондрию убиквитином, процесс, запускающий образование аутофагосомы (см. также главу 3). Аутофагосома поглощает поврежденную митохондрию, затем сливается с лизосомой, которая разрушает ее. По словам Юла, результаты исследований PINK1/Parkin, которые были воспроизведены в нескольких лабораториях, открыли новый путь контроля качества митохондрий. Он отметил, что большая часть ранней работы в этой области была выполнена на культивируемых клеточных линиях, потому что соединения, используемые для индукции этого пути в культивируемых клеточных линиях, были слишком токсичны для нейронов. Однако совсем недавно две группы показали этот путь в нейронах (Cai et al., 2012; Wang et al., 2011).
Юл сообщил, что его лаборатория начала программу скрининга наркотиков для выявления соединений, которые стимулируют путь PINK1/Parkin. Хотя он признал, что людям с болезнью Паркинсона с ранним началом может не помочь стимуляция пути, потому что их PINK1 или PARKIN мутированы, люди со спорадической болезнью Паркинсона могут получить пользу, как и другие люди с нейродегенеративным заболеванием, чьи митохондрии дисфункциональны.
Хотя он признал, что людям с болезнью Паркинсона с ранним началом может не помочь стимуляция пути, потому что их PINK1 или PARKIN мутированы, люди со спорадической болезнью Паркинсона могут получить пользу, как и другие люди с нейродегенеративным заболеванием, чьи митохондрии дисфункциональны.
Боковой амиотрофический склероз
БАС преимущественно поражает двигательные нейроны, что приводит к прогрессирующей мышечной атрофии и параличу. В животных моделях БАС митохондриальные аномалии предшествуют симптомам заболевания (Manfredi and Xu, 2005). Электронная микроскопия выявила структурные аномалии в митохондриях спинномозговых мотонейронов и в моторной коре у больных БАС. Нил Коуэлл из Бостонского университета сосредоточил свое выступление на SOD1 (супероксиддисмутаза Cu, Zn), первом идентифицированном гене, ответственном за возникновение БАС. Соответствующий белок мутирует примерно в 20% семейных случаев БАС. 2 Наиболее широко используемой животной моделью БАС является трансгенная мышь, несущая мутантный ген SOD1. У мыши развивается атрофия мышц, аналогичная таковой при БАС.
У мыши развивается атрофия мышц, аналогичная таковой при БАС.
Митохондрии из двигательных нейронов в этой животной модели демонстрируют меньший размер, меньшее количество, дефект мембранного потенциала и нарушение слияния. Слияние митохондрий предназначено для распространения мтДНК среди популяции митохондрий и сохранения способности к окислительному фосфорилированию. Эти морфологические и физиологические изменения в мотонейронах mutSOD1 не наблюдаются в мотонейронах SOD1 дикого типа (Magrane et al., 2012). mutSOD1 также изменяет уровни по крайней мере 50 различных митохондриальных белков, включая белки, участвующие в цепи переноса электронов и в их слиянии, указывая на возможный широко распространенный эффект mutSOD1 (Karbowski and Neutzner, 2012).
mutSOD1 также вызывает повреждение митохондрий, о чем свидетельствует увеличение содержания цитохрома с в цитозоле. Поскольку цитохром с является важным компонентом электрон-транспортной цепи, расположенной во внутренней мембране митохондрий, его выход в цитоплазму свидетельствует о разрушении мембран митохондрий. Но этот токсический эффект возникает только в присутствии белка Bcl-2, который может изменить свой функциональный фенотип и стать токсичным белком (Pedrini et al., 2010). Идентификация Bcl-2 как необходимого фактора токсичности SOD1 предполагает, что Bcl-2 можно использовать в качестве молекулярной мишени для препаратов, предназначенных для ингибирования его действия (Pedrini et al., 2010). Bcl-2 также может быть важной мишенью не только при семейном БАС, но, возможно, и при спорадическом БАС, сказал Коуэлл. Это связано с тем, что исследования недавно показали, что в подгруппе пациентов с БАС с бульбарным началом SOD1 дикого типа становится гиперокисленной. Вместе с Bcl-2 гиперокисленный wtSOD1 проявляет митохондриальную токсичность, подобную наблюдаемой с mutSOD1. Таким образом, Bcl-2 представляет собой обычное связующее звено между семейным и подтипом спорадического БАС и, таким образом, является хорошей мишенью для терапевтических средств, которые его ингибируют.
Но этот токсический эффект возникает только в присутствии белка Bcl-2, который может изменить свой функциональный фенотип и стать токсичным белком (Pedrini et al., 2010). Идентификация Bcl-2 как необходимого фактора токсичности SOD1 предполагает, что Bcl-2 можно использовать в качестве молекулярной мишени для препаратов, предназначенных для ингибирования его действия (Pedrini et al., 2010). Bcl-2 также может быть важной мишенью не только при семейном БАС, но, возможно, и при спорадическом БАС, сказал Коуэлл. Это связано с тем, что исследования недавно показали, что в подгруппе пациентов с БАС с бульбарным началом SOD1 дикого типа становится гиперокисленной. Вместе с Bcl-2 гиперокисленный wtSOD1 проявляет митохондриальную токсичность, подобную наблюдаемой с mutSOD1. Таким образом, Bcl-2 представляет собой обычное связующее звено между семейным и подтипом спорадического БАС и, таким образом, является хорошей мишенью для терапевтических средств, которые его ингибируют.
Болезнь Гентингтона
Болезнь Хантингтона — аутосомно-доминантное заболевание, при котором мутантный белок мхантингтин (mHTT) содержит избыточные полиглутаминовые повторы. mHTT локализуется на внешней митохондриальной мембране, где он оказывает обширное и вредное воздействие на митохондрии и избирательную потерю нейронов в стриатуме. Коуэлл сказал, что большое количество доказательств показывает, что mHTT снижает подвижность митохондрий, изменяет митохондриальную морфологию, вызывает дисрегуляцию кальция, снижает окислительное фосфорилирование и деполяризует митохондриальную мембрану в лимфобластах пациентов с болезнью Гентингтона. Деполяризация увеличивается с увеличением числа полиглутаминовых повторов. mHTT также изменяет баланс между слиянием и делением митохондрий (Lin and Beal, 2006; Reddy and Reddy, 2011).
mHTT локализуется на внешней митохондриальной мембране, где он оказывает обширное и вредное воздействие на митохондрии и избирательную потерю нейронов в стриатуме. Коуэлл сказал, что большое количество доказательств показывает, что mHTT снижает подвижность митохондрий, изменяет митохондриальную морфологию, вызывает дисрегуляцию кальция, снижает окислительное фосфорилирование и деполяризует митохондриальную мембрану в лимфобластах пациентов с болезнью Гентингтона. Деполяризация увеличивается с увеличением числа полиглутаминовых повторов. mHTT также изменяет баланс между слиянием и делением митохондрий (Lin and Beal, 2006; Reddy and Reddy, 2011).
В последнее время появилось несколько терапевтических стратегий для лечения болезни Гентингтона, отметил Коуэлл. Одним из путей является нацеливание на белок деления митохондрий 3 , с которым связывается mHTT, GTPase dynamin-related protein 1 (DRP1). Нацеленность на DRP1 подтверждается обнаружением того, что доминантно-негативный мутант DRP1K38A, который снижает активность DRP1, спасает митохондрии от следующих неблагоприятных эффектов mHTT: фрагментация митохондрий, дефекты антероградного и ретроградного транспорта митохондрий и гибель нейронов. Об этих результатах сообщалось в клетках людей с болезнью Хантингтона и мышей (Song et al., 2011). Другими словами, соединения, которые ингибируют DRP1, могут быть полезны в качестве потенциальной терапии.
Об этих результатах сообщалось в клетках людей с болезнью Хантингтона и мышей (Song et al., 2011). Другими словами, соединения, которые ингибируют DRP1, могут быть полезны в качестве потенциальной терапии.
Коуэлл описал еще два новых метода лечения. Первая направлена на детоксикацию HTT. Он включает внутрижелудочковую инфузию ганглиозида GM1, который фосфорилирует мутантный HTT по определенным аминокислотным остаткам серина. Такой подход не только снижал токсичность HTT, но и восстанавливал нормальную двигательную функцию у мышей с симптомами болезни Гентингтона (Di Pardo et al., 2012). Вторая терапия проводится уже одобренным препаратом меклизином. Этот препарат подавляет митохондриальное дыхание и активирует пути выживания клеток. В нескольких моделях болезни Хантингтона было обнаружено, что меклизин оказывает нейропротекторное действие (Gohil et al., 2011).
Болезнь Альцгеймера
Митохондриальная дисфункция предшествует патологическим изменениям, которые являются отличительными чертами болезни Альцгеймера (Yao et al. , 2009). Дуглас Уоллес из Детской больницы Филадельфии предположил, что причиной болезни Альцгеймера и деменции в более широком смысле является основная дисфункция митохондрий. Начиная с 1993 года группа Уоллеса обнаружила мутацию в одном из генов митохондриальной тРНК. Мутация коррелировала с 3 процентами случаев болезни Альцгеймера с поздним началом, 5 процентами болезни Паркинсона и 7 процентами населения в целом. Вывод был позже подтвержден другими. Он утверждал, что тонкие дефекты в тРНК будут генерировать более глобальные дефекты синтеза митохондриальных белков. Впоследствии его группа начала изучать мутацию в положении 414 нуклеотида, которое примыкает к промотору контрольной области мтДНК. Ранее было показано, что мутация увеличивается с возрастом в фибробластах человека (Michikawa et al., 19).99). Команда Уоллеса обнаружила мутацию в 65% мозга больных Альцгеймером и в 57% мозга людей с синдромом Дауна и деменцией по сравнению с 0% контрольной группы того же возраста (Coskun et al.
, 2009). Дуглас Уоллес из Детской больницы Филадельфии предположил, что причиной болезни Альцгеймера и деменции в более широком смысле является основная дисфункция митохондрий. Начиная с 1993 года группа Уоллеса обнаружила мутацию в одном из генов митохондриальной тРНК. Мутация коррелировала с 3 процентами случаев болезни Альцгеймера с поздним началом, 5 процентами болезни Паркинсона и 7 процентами населения в целом. Вывод был позже подтвержден другими. Он утверждал, что тонкие дефекты в тРНК будут генерировать более глобальные дефекты синтеза митохондриальных белков. Впоследствии его группа начала изучать мутацию в положении 414 нуклеотида, которое примыкает к промотору контрольной области мтДНК. Ранее было показано, что мутация увеличивается с возрастом в фибробластах человека (Michikawa et al., 19).99). Команда Уоллеса обнаружила мутацию в 65% мозга больных Альцгеймером и в 57% мозга людей с синдромом Дауна и деменцией по сравнению с 0% контрольной группы того же возраста (Coskun et al. , 2004).
, 2004).
Совсем недавно команда Уоллеса исследовала более глобально контрольную область мтДНК в ткани, взятой из лобной коры головного мозга. Контрольная область отвечает за регуляцию транскрипции митохондриальных генов и помогает копировать мтДНК. Они обнаружили самый высокий уровень соматических мутаций в мозге людей с болезнью Альцгеймера (Coskun et al., 2010). Частота мутаций также была повышена в случаях синдрома Дауна и деменции по сравнению с контрольной группой, но была ниже, чем при болезни Альцгеймера. В контрольной ткани действительно наблюдалось возрастное увеличение частоты мутаций, хотя уровень был ниже, чем в других группах. Повышенный уровень мутаций был также обнаружен в сыворотке и других тканях при болезни Альцгеймера и синдроме Дауна, что позволяет предположить, что это явление является системным. Но, по словам Уоллеса, мозг является наиболее пораженной тканью из-за его непропорционально высоких энергетических потребностей. Исследование также обнаружило снижение транскрипции мтДНК и уменьшение количества копий мтДНК, что указывает на снижение окислительного фосфорилирования.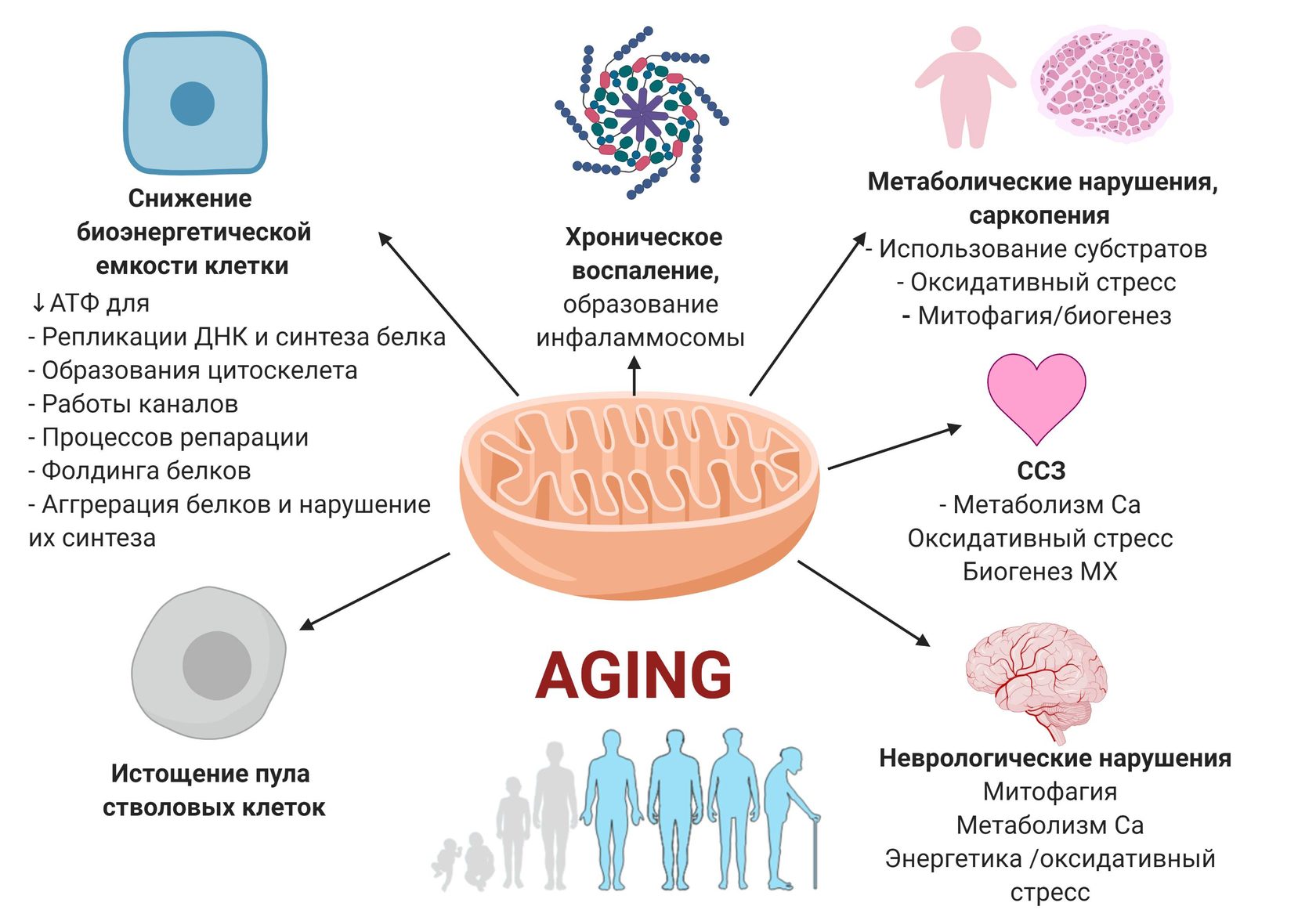
Обращаясь к причинно-следственной связи нейродегенеративного заболевания, Уоллес выразил мнение, что образование бляшек Aβ не является причинной; скорее, предположил он, белок Aβ первоначально продуцируется клетками в качестве компенсаторного средства , защищающего митохондрий. Но поскольку белок продолжает вырабатываться, он начинает агрегировать с образованием олигомеров и более крупных агрегатов, которые ингибируют митохондрии, что приводит к повреждению и гибели клеток. Согласно этой модели, белковые агрегаты способствуют гибели нейронов при нейродегенеративном заболевании, но не являются причиной. Первичная причина, согласно его гипотезе, лежит в дисфункциональных митохондриях. Он высказал мнение, что «общим патофизиологическим механизмом всех этих нейродегенеративных заболеваний является биоэнергетика». Затем в ходе обсуждения его допросили несколько скептически настроенных участников, которые не согласились с его причинной атрибуцией. В ответ Уоллес рассказал, как его команда разработала способ введения точечной мутации цитохромоксидазы в мтДНК и обнаружила, что у животного развилась кардиомиопатия, миопатия и патологические изменения в нейронах гиппокампа, ганглиозных клетках сетчатки и зрительном нерве. «Эта конкретная точечная мутация — она не имеет ничего общего с ядром — показывает, что энергетика может влиять на все эти различные функции», — заявил он.
«Эта конкретная точечная мутация — она не имеет ничего общего с ядром — показывает, что энергетика может влиять на все эти различные функции», — заявил он.
БЕЛКОВЫЕ ДЕПОЗИТЫ И ТОКСИЧНОСТЬ ДЛЯ МИТОХОНДРИЙ
Многочисленные данные свидетельствуют о том, что токсичные белки, такие как Aβ, фрагменты аполипопротеина E (ApoE) и α-синуклеин, могут повредить митохондрии, сказал Леннарт Маке из Институтов Гладстона и Калифорнийского университета в Сан-Франциско. В этом случае поврежденные митохондрии не будут основной причиной заболевания, а скорее будут вторичными по отношению к действиям агрегированных белков, которые и будут основной причиной. Значительное количество исследований показывает, что пептиды Aβ накапливаются в митохондриях, где они вызывают дисфункцию и апоптоз (Manczak et al., 2006; Yao et al., 2009).).
Одним из возможных механизмов токсичности белковых отложений для нейронов является нарушение аксонального транспорта митохондрий. Митохондрии генерируются в основном в теле клетки и должны активно транспортироваться в синапс, где потребность в энергии высока.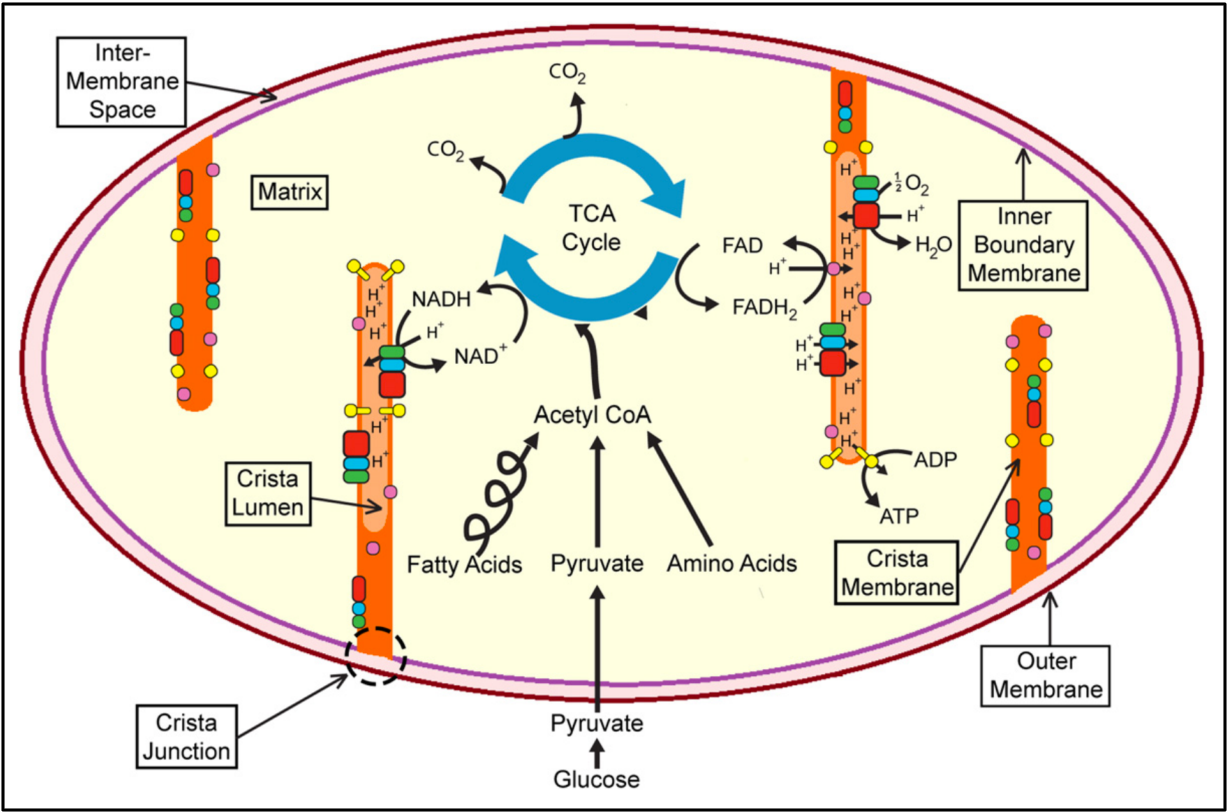 Без митохондрий синаптическая функция может быть нарушена. Mucke и его команда оценили эффекты белков Aβ и tau на аксональный транспорт митохондрий (Vossel et al., 2010). Они обнаружили, что добавление олигомеров Aβ в культуру быстро ингибирует аксональный транспорт митохондрий в здоровых нейронах, что подтверждается более ранними исследованиями. Их также интересовало определение того, играет ли роль тау. Снижение уровня тау предотвратило индуцированное олигомером Aβ нарушение транспорта аксонов, не влияя на исходный аксональный транспорт. Полное устранение тау путем нокдауна гена также имело тот же эффект. Они пришли к выводу, что «Aβ требует тау для нарушения аксонального транспорта, и что снижение уровня тау защищает от дефектов Aβ-индуцированного аксонального транспорта» (Vossel et al., 2010, стр. 19).8-а).
Без митохондрий синаптическая функция может быть нарушена. Mucke и его команда оценили эффекты белков Aβ и tau на аксональный транспорт митохондрий (Vossel et al., 2010). Они обнаружили, что добавление олигомеров Aβ в культуру быстро ингибирует аксональный транспорт митохондрий в здоровых нейронах, что подтверждается более ранними исследованиями. Их также интересовало определение того, играет ли роль тау. Снижение уровня тау предотвратило индуцированное олигомером Aβ нарушение транспорта аксонов, не влияя на исходный аксональный транспорт. Полное устранение тау путем нокдауна гена также имело тот же эффект. Они пришли к выводу, что «Aβ требует тау для нарушения аксонального транспорта, и что снижение уровня тау защищает от дефектов Aβ-индуцированного аксонального транспорта» (Vossel et al., 2010, стр. 19).8-а).
Другим белком, связанным с заболеванием, который повреждает митохондрии, является ApoE. Ген ApoE является основным геном предрасположенности, идентифицированным для болезни Альцгеймера с поздним началом, и он находится на хромосоме 19. Нейроны продуцируют ApoE, когда они подвергаются стрессу под действием множества факторов, включая старение, окислительный стресс, травму и отложение белка. Считается, что синтез ApoE защищает нейроны от повреждений, а также восстанавливает и реконструирует их. Однако исследования показали, что продукты расщепления ApoE повреждают митохондрии (Brecht et al., 2004). По словам Макке, аллель ApoE e4, связанный с болезнью Альцгеймера, наиболее чувствителен к расщеплению, в то время как другие аллели ApoE менее чувствительны.
Нейроны продуцируют ApoE, когда они подвергаются стрессу под действием множества факторов, включая старение, окислительный стресс, травму и отложение белка. Считается, что синтез ApoE защищает нейроны от повреждений, а также восстанавливает и реконструирует их. Однако исследования показали, что продукты расщепления ApoE повреждают митохондрии (Brecht et al., 2004). По словам Макке, аллель ApoE e4, связанный с болезнью Альцгеймера, наиболее чувствителен к расщеплению, в то время как другие аллели ApoE менее чувствительны.
МИТОХОНДРИАЛЬНЫЕ ЗАБОЛЕВАНИЯ И ИХ ПОЛЕЗНОСТЬ ПРИ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ
Учитывая неопределенность в отношении того, какую роль митохондриальная дисфункция играет в нейродегенеративных заболеваниях, Мута предположил ценность изучения первичных митохондриальных заболеваний, которые относятся к почти 150 генетическим заболеваниям, при которых поражение лежит в ген, кодирующий белок, непосредственно участвующий в биологии митохондрий. Болезни неоднородны, десятки находятся в центре внимания исследований на протяжении многих десятилетий. Вызванные генетическими мутациями или делециями одного гена, они следуют менделевскому или материнскому типу наследования.
Вызванные генетическими мутациями или делециями одного гена, они следуют менделевскому или материнскому типу наследования.
Митохондриальные заболевания могут пролить свет на нейродегенеративные заболевания, сказал Мутха, отчасти потому, что фенотипы заболеваний схожи. Например, некоторые фенотипы митохондриальных заболеваний включают атаксию, невропатию, миопатию, глухоту и слепоту. Действительно, несколько последующих презентаций были посвящены митохондриальной патологии при нейродегенеративных заболеваниях, таких как болезнь Паркинсона и БАС. Еще одна причина, по которой митохондриальные заболевания играют важную роль в нейродегенеративных заболеваниях, заключается в том, что, как и при нейродегенеративных заболеваниях, вовлекаются многие системы органов, а их генетика лучше охарактеризована с помощью амбициозного проекта, известного как Mitocarta, который представляет собой перечень более 1000 мышиных генов, кодирующих белки. которые локализуются в митохондриях (Pagliarini et al. , 2008). Наконец, митохондриальные заболевания ценны, по его мнению, тем, что они обеспечивают «генетические крайности», которые могут помочь определить, может ли конкретное нейродегенеративное заболевание иметь митохондриальные дефекты в качестве основной причины. Мутха посоветовал искать связи между митохондриальными и нейродегенеративными заболеваниями, когда есть хотя бы какие-то точки соприкосновения, например, в патогенезе, патологии или биомаркерах.
, 2008). Наконец, митохондриальные заболевания ценны, по его мнению, тем, что они обеспечивают «генетические крайности», которые могут помочь определить, может ли конкретное нейродегенеративное заболевание иметь митохондриальные дефекты в качестве основной причины. Мутха посоветовал искать связи между митохондриальными и нейродегенеративными заболеваниями, когда есть хотя бы какие-то точки соприкосновения, например, в патогенезе, патологии или биомаркерах.
Несмотря на то, что митохондрии выглядят одинаково при микроскопии, внешний вид обманчив. Мутха отметил огромную неоднородность митохондрий в разных тканях. Он сообщил, что после изучения 14 различных тканей исследования показали, что митохондрии из 2 разных тканей имеют только 75 процентов общих белков, тогда как остальные митохондриальные белки являются тканеспецифичными. Существует даже физиологическая неоднородность внутри отдельной клетки — митохондрии, например, могут иметь разные модели использования топлива. Учитывая разнообразие фенотипов и генотипов, Мутха выступал за системный подход к изучению митохондриальной функции. Такой подход сочетает в себе геномику, протеомику, метаболомику, биохимию и компьютерное моделирование, чтобы охватить динамический диапазон сложных взаимодействий внутри клеток и между тканями. Он заметил, что применение системной биологии к нейродегенеративным заболеваниям потребует определения составных частей, построения схем соединений для соединения этих частей, определения схем, вызывающих заболевание, и использования знаний для разработки методов лечения.
Такой подход сочетает в себе геномику, протеомику, метаболомику, биохимию и компьютерное моделирование, чтобы охватить динамический диапазон сложных взаимодействий внутри клеток и между тканями. Он заметил, что применение системной биологии к нейродегенеративным заболеваниям потребует определения составных частей, построения схем соединений для соединения этих частей, определения схем, вызывающих заболевание, и использования знаний для разработки методов лечения.
МИТОХОНДРИИ И СМЕРТЬ КЛЕТОК
Общим для нейродегенеративных заболеваний является то, что все они характеризуются высокой степенью гибели клеток. Здесь основное внимание уделяется митохондриям; митохондрии играют ключевую роль в регуляции гибели клеток, которая происходит в определенных областях мозга при всех нейродегенеративных заболеваниях. Гибель клеток бывает трех типов: (1) некроз, представляющий собой наиболее хаотичную форму гибели, которая включает набухание цитоплазмы, растворение ядра и лизис; (2) апоптоз, упорядоченная форма смерти, зависящая от АТФ, которая производит клеточные фрагменты, которые фагоцитирующие клетки способны поглощать и удалять до того, как содержимое клетки извергнется на окружающие клетки и вызовет повреждение; и (3) аутофагия, при которой клетка разрушает свою цитоплазму и органеллы с помощью лизосом (Martin et al. , 2010). Митохондрии — это места, где взаимодействуют антиапоптотические и проапоптотические белки, и они регулируют сигналы клеточной гибели.
, 2010). Митохондрии — это места, где взаимодействуют антиапоптотические и проапоптотические белки, и они регулируют сигналы клеточной гибели.
Ли Мартин из Университета Джона Хопкинса предупредил, что гибель клеток в моделях нейродегенеративных заболеваний у людей и животных может происходить по разным механизмам. Он сообщил о различиях между видами мышей и людей в факторах, контролирующих переход митохондриальной проницаемости (MPT), то есть увеличение проницаемости митохондриальных мембран для молекул с малой молекулярной массой. MPT возникает в результате открытия поры перехода митохондриальной проницаемости, белковой поры, образующейся в митохондриальных мембранах при определенных патологических состояниях. Индукция поры перехода проницаемости может привести к набуханию митохондрий и некрозу, а также играет важную роль в некоторых типах апоптоза. Мартин также отметил видовые различия в механизмах передачи сигналов каспаз, которые представляют собой ферменты, находящиеся под контролем митохондрий, которые имеют решающее значение для апоптоза, различия в субстратах касп, различия в механизмах слияния митохондрий и в механизмах передачи сигналов для репарации и метаболизма ДНК, среди прочего. Он заметил, что межвидовые различия в гибели клеток мешают переводу результатов, полученных с животных моделей, в клинические испытания на людях. Он предложил изменить дизайн доклинических исследований, чтобы меньше полагаться на мыши в качестве моделей и больше на нейроны, полученные из нервных стволовых клеток человека.
Он заметил, что межвидовые различия в гибели клеток мешают переводу результатов, полученных с животных моделей, в клинические испытания на людях. Он предложил изменить дизайн доклинических исследований, чтобы меньше полагаться на мыши в качестве моделей и больше на нейроны, полученные из нервных стволовых клеток человека.
ПОТЕНЦИАЛЬНЫЕ БИОМАРКЕРЫ И ТЕРАПИИ
Нет установленных биомаркеров или методов лечения для лечения митохондриальной дисфункции при нейродегенеративных заболеваниях. Уоллес сказал, что его лаборатория работает над их разработкой. Одним из разрабатываемых биомаркеров является спектроскопия кожи в ближнем инфракрасном диапазоне с использованием различных инфракрасных диодов, которые исследуют окислительно-восстановительный потенциал дыхательных цепей. Уоллес сказал, что его лаборатория также разрабатывает биомаркер с использованием анализа дыхания микроорганизмов. Они надеются получить некоторые суррогатные переменные, которые изменяются в режиме реального времени, а затем перейти к фазе I клинических испытаний и иметь по крайней мере показания безопасности/эффективности.
Что касается методов лечения, в этой главе уже упоминались некоторые из них, относящиеся к конкретным нейродегенеративным заболеваниям. Вместо этого сосредоточившись на родовых методах лечения митохондриальной дисфункции, Уоллес сказал, что его первоочередной задачей в терапии будет стимуляция образования большего количества митохондрий. Препараты для создания митохондрий тестируются на различных животных моделях и в системах клеточных культур. В частности, он отметил, что препарат безафибрат увеличивает биогенез митохондрий в раковых клетках и улучшает митохондриальную дисфункцию (Wang and Moraes, 2011). Он еще не был испытан на клетках головного мозга.
Другие варианты лечения, объяснил Уоллес, включают (1) каталитические антиоксиданты для защиты от АФК; (2) регуляторы внутриклеточного кальция; и (3) регуляторы окислительно-восстановительного потенциала через митохондриальную мембрану. Поддержание окислительно-восстановительного потенциала имеет решающее значение для целостности митохондрий и контроля окислительного фосфорилирования. Один участник отметил, что антиоксидантная терапия в клинических испытаниях всегда оказывалась неэффективной, но Уоллес ответил, что дозы, возможно, были недостаточно высокими. Другой участник посоветовал нацеливать митохондриальную терапию в случаях пороговых эффектов, то есть в момент, когда происходит значительное нарушение функции митохондрий. Участник также отметил, что митохондриальная терапия может иметь вторичные недостатки.
Один участник отметил, что антиоксидантная терапия в клинических испытаниях всегда оказывалась неэффективной, но Уоллес ответил, что дозы, возможно, были недостаточно высокими. Другой участник посоветовал нацеливать митохондриальную терапию в случаях пороговых эффектов, то есть в момент, когда происходит значительное нарушение функции митохондрий. Участник также отметил, что митохондриальная терапия может иметь вторичные недостатки.
ПОТРЕБНОСТИ В ИССЛЕДОВАНИЯХ И СЛЕДУЮЩИЕ ШАГИ, ПРЕДЛОЖЕННЫЕ ОТДЕЛЬНЫМИ УЧАСТНИКАМИ
Спикеры семинара определили множество вопросов для будущих исследований и другие возможности для будущих действий. Предложения, связанные с митохондриальной дисфункцией, собраны здесь, чтобы дать представление о диапазоне сделанных предложений. Предложения отождествляются с докладчиком, который их сделал, и не должны рассматриваться как отражение консенсуса на семинаре или одобрение Институтом медицины.
Развивать более глубокое понимание энергетической биологии и взаимодействия между биоэнергетикой и влиянием окружающей среды.
 (Уоллес)
(Уоллес)Определите биомаркеры для отслеживания функционирования митохондрий. (Ли, Мутха)
Найдите биомаркеры угасания митохондрий. (Mootha)
Определить новые методы лечения, которые усиливают митохондриальный биогенез. (Wallace)
Определить методы лечения, которые препятствуют митохондриальному вкладу в патогенез нейродегенеративного заболевания, включая методы лечения, которые усиливают митофагию или стимулируют активность PINK1 и паркина. (Мута, Юл)
Найдите методы лечения, которые детоксифицируют агрегаты мутантных белков, которые взаимодействуют с митохондриями. (Kowall)
Сноски
- 1
АФК образуются как побочный продукт окислительного фосфорилирования.
- 2
Примерно от 5 до 10 процентов случаев БАС являются семейными.
- 3
Деление митохондрий — это механизм контроля качества, при котором митохондрия делится на две части, одна здоровая, а другая содержит поврежденную часть митохондрий.
 Последняя часть деградирует.
Последняя часть деградирует.
Митохондриальная патология — Нейродегенерация — Книжная полка NCBI
Ключевые моменты, поднятые отдельными докладчиками
Из-за высокой потребности в энергии нейроны особенно уязвимы к повреждению и гибели из-за дисфункции митохондрий.
Патологические и физиологические данные свидетельствуют о дисфункции митохондрий при всех основных нейродегенеративных заболеваниях.
Остаются вопросы относительно того, является ли митохондриальная дисфункция причиной нейродегенеративных заболеваний. Даже если это не является причиной, митохондриальная дисфункция все еще очень важна и, вероятно, способствует заболеванию. Идентификация методов лечения для улучшения митохондриальной функции или деградации дисфункциональных митохондрий может иметь смысл.
Изучение первичных митохондриальных заболеваний может пролить свет на нейродегенеративные заболевания, которые проявляют сходную патологию.
 Поскольку оба типа заболеваний поражают множество путей и систем органов, они требуют подхода системной биологии.
Поскольку оба типа заболеваний поражают множество путей и систем органов, они требуют подхода системной биологии.Потенциальные терапевтические подходы включают лекарства, индуцирующие митохондриальный генез, каталитические антиоксиданты для защиты от активных форм кислорода, регуляторы внутриклеточного кальция и регуляторы окислительно-восстановительного потенциала через митохондриальную мембрану. Поддержание окислительно-восстановительного потенциала имеет решающее значение для целостности митохондрий и контроля окислительного фосфорилирования.
Митохондрии — это клеточные органеллы, ответственные за окислительное фосфорилирование, жизненно важный процесс превращения питательных веществ в молекулы аденозинтрифосфата (АТФ), которые обеспечивают энергию для нормального функционирования клеток. Каждый нейрон имеет по меньшей мере сотни митохондрий. Поскольку нервные клетки являются постмитотическими, любое стойкое митохондриальное повреждение будет накапливаться с возрастом и приводить к дисфункции. Широко распространенное повреждение митохондрий приводит к гибели клеток, потому что они больше не могут производить достаточно энергии. Действительно, сами митохондрии высвобождают ферменты, ответственные за гибель клеток. Мозг особенно уязвим для митохондриальной дисфункции, поскольку его энергетические потребности выше, чем у любого другого органа тела. Мозг составляет всего 2 процента массы тела, но при этом потребляет 20 процентов кислорода.
Широко распространенное повреждение митохондрий приводит к гибели клеток, потому что они больше не могут производить достаточно энергии. Действительно, сами митохондрии высвобождают ферменты, ответственные за гибель клеток. Мозг особенно уязвим для митохондриальной дисфункции, поскольку его энергетические потребности выше, чем у любого другого органа тела. Мозг составляет всего 2 процента массы тела, но при этом потребляет 20 процентов кислорода.
Функционирование митохондрий определяется двумя отдельными геномами, один в митохондриях, известный как митохондриальная ДНК (мтДНК), а другой в ядре. Митохондриальный геном кодирует 13 белков, каждый из которых жизненно важен для окислительного фосфорилирования. Ядерный геном кодирует около 1500 генов, участвующих в митохондриальной биологии, включая белки, необходимые для репликации мтДНК, транскрипции, трансляции и посттрансляционных модификаций. Существует только одна копия мтДНК, унаследованная от матери, по сравнению с двумя копиями ядерной ДНК, одна от матери, а другая от отца. Митохондрии не только ответственны за окислительное фосфорилирование, но также играют важную роль в метаболизме и передаче сигналов, включая синтез жирных кислот, метаболизм кетоновых тел, гомеостаз кальция и апоптоз. В частности, митохондрии обеспечивают большую часть клеточной энергии в форме АТФ. Они генерируют и регулируют активные формы кислорода, буферизуют уровни кальция внутри клетки и контролируют апоптоз (Wallace, 2005, 2010).
Митохондрии не только ответственны за окислительное фосфорилирование, но также играют важную роль в метаболизме и передаче сигналов, включая синтез жирных кислот, метаболизм кетоновых тел, гомеостаз кальция и апоптоз. В частности, митохондрии обеспечивают большую часть клеточной энергии в форме АТФ. Они генерируют и регулируют активные формы кислорода, буферизуют уровни кальция внутри клетки и контролируют апоптоз (Wallace, 2005, 2010).
Митохондриальные дефекты обнаруживаются при патологических исследованиях всех основных нейродегенеративных заболеваний, сказал Вамси Мутха из Гарвардской медицинской школы. Диапазон митохондриальных дефектов включает фрагментацию и другие морфологические изменения, повышенную частоту мутаций в мтДНК, изменения проницаемости митохондриальных мембран, изменения окислительно-восстановительного потенциала, накопление мутантных белков и нарушение окислительного фосфорилирования (Reddy and Reddy, 2011). Но являются ли эти митохондриальные дефекты причиной нейродегенеративных заболеваний, является фундаментальным вопросом, сказал Мутха. Потенциальные роли митохондрий в нейродегенеративных заболеваниях, по его мнению, троякие: (1) они содержат первичные поражения и, таким образом, служат первичным источником патологии болезни; (2) они функционируют должным образом, но служат медиаторами или усилителями болезни; или (3) они являются сторонними наблюдателями, которые не способствуют патологии. Даже если митохондриальные дефекты не являются причиной, они, вероятно, способствуют этому, отмечает Нил Коуэлл из Бостонского университета, и поэтому любая терапия, которая сохраняет, улучшает или корректирует митохондриальную функцию, вероятно, будет полезна для предотвращения гибели клеток и прогрессирования заболевания.
Потенциальные роли митохондрий в нейродегенеративных заболеваниях, по его мнению, троякие: (1) они содержат первичные поражения и, таким образом, служат первичным источником патологии болезни; (2) они функционируют должным образом, но служат медиаторами или усилителями болезни; или (3) они являются сторонними наблюдателями, которые не способствуют патологии. Даже если митохондриальные дефекты не являются причиной, они, вероятно, способствуют этому, отмечает Нил Коуэлл из Бостонского университета, и поэтому любая терапия, которая сохраняет, улучшает или корректирует митохондриальную функцию, вероятно, будет полезна для предотвращения гибели клеток и прогрессирования заболевания.
В этой главе обобщаются презентации семинаров, в которых приводятся доказательства митохондриальной дисфункции при основных нейродегенеративных заболеваниях. По словам нескольких участников, поскольку нет четких данных о том, является ли митохондриальная дисфункция причиной, может быть полезно взглянуть на первичные митохондриальные заболевания и применить системный подход к исследованиям.
МИТОХОНДРИАЛЬНАЯ ДИСФУНКЦИЯ И НЕЙРОДЕГЕНЕРАТИВНЫЕ ЗАБОЛЕВАНИЯ
Как отмечалось выше, митохондриальная дисфункция обнаруживается при основных нейродегенеративных заболеваниях. В этом разделе представлены презентации семинаров о митохондриальной дисфункции при болезни Паркинсона, боковом амиотрофическом склерозе (БАС), болезни Гентингтона и болезни Альцгеймера.
Болезнь Паркинсона
Болезнь Паркинсона характеризуется потерей дофаминсодержащих нейронов в области мозга, известной как черная субстанция. Патологические и другие исследования убедительно показали, что дефицит митохондрий накапливается в этой области мозга с возрастом, сказал Ричард Юл из Национального института неврологических расстройств и инсульта. Выступление Юла было сосредоточено на функции двух белков, которые мутируют при семейной болезни Паркинсона с ранним началом: Parkin и PINK1 (предполагаемая киназа 1, индуцированная PTEN).
Нормальные функции Parkin и PINK1 до недавнего времени не были хорошо изучены, сказал Юл. Накапливаются данные от нескольких видов о том, что эти белки обычно работают вместе, чтобы вызвать очищение поврежденных митохондрий, процесс, известный как митофагия. Само собой разумеется, что в случае мутации они могут не индуцировать митофагию, в результате чего дисфункциональные митохондрии накапливаются внутри клетки и вызывают гибель. Таким образом, нарушение митофагии связано с этиологией болезни Паркинсона с ранним началом (Narendra and Youle, 2011).
Накапливаются данные от нескольких видов о том, что эти белки обычно работают вместе, чтобы вызвать очищение поврежденных митохондрий, процесс, известный как митофагия. Само собой разумеется, что в случае мутации они могут не индуцировать митофагию, в результате чего дисфункциональные митохондрии накапливаются внутри клетки и вызывают гибель. Таким образом, нарушение митофагии связано с этиологией болезни Паркинсона с ранним началом (Narendra and Youle, 2011).
Когда митохондрии находятся в состоянии стресса или повреждены, заметил Юл, они накапливают PINK1. PINK1 представляет собой митохондриальный белок, обычно прикрепленный к внешней мембране митохондрии в низких концентрациях. Когда митохондриальная мембрана теряет свой электрический потенциал — из-за мутаций ДНК, активных форм кислорода (АФК), 1 или других возмущений — PINK1 увеличивается. Увеличение концентрации PINK1, в свою очередь, способствует рекрутированию паркина, который представляет собой убиквитинлигазу, из цитозоля. Паркин помечает поврежденную митохондрию убиквитином, процесс, запускающий образование аутофагосомы (см. также главу 3). Аутофагосома поглощает поврежденную митохондрию, затем сливается с лизосомой, которая разрушает ее. По словам Юла, результаты исследований PINK1/Parkin, которые были воспроизведены в нескольких лабораториях, открыли новый путь контроля качества митохондрий. Он отметил, что большая часть ранней работы в этой области была выполнена на культивируемых клеточных линиях, потому что соединения, используемые для индукции этого пути в культивируемых клеточных линиях, были слишком токсичны для нейронов. Однако совсем недавно две группы показали этот путь в нейронах (Cai et al., 2012; Wang et al., 2011).
Паркин помечает поврежденную митохондрию убиквитином, процесс, запускающий образование аутофагосомы (см. также главу 3). Аутофагосома поглощает поврежденную митохондрию, затем сливается с лизосомой, которая разрушает ее. По словам Юла, результаты исследований PINK1/Parkin, которые были воспроизведены в нескольких лабораториях, открыли новый путь контроля качества митохондрий. Он отметил, что большая часть ранней работы в этой области была выполнена на культивируемых клеточных линиях, потому что соединения, используемые для индукции этого пути в культивируемых клеточных линиях, были слишком токсичны для нейронов. Однако совсем недавно две группы показали этот путь в нейронах (Cai et al., 2012; Wang et al., 2011).
Юл сообщил, что его лаборатория начала программу скрининга наркотиков для выявления соединений, которые стимулируют путь PINK1/Parkin. Хотя он признал, что людям с болезнью Паркинсона с ранним началом может не помочь стимуляция пути, потому что их PINK1 или PARKIN мутированы, люди со спорадической болезнью Паркинсона могут получить пользу, как и другие люди с нейродегенеративным заболеванием, чьи митохондрии дисфункциональны.
Боковой амиотрофический склероз
БАС преимущественно поражает двигательные нейроны, что приводит к прогрессирующей мышечной атрофии и параличу. В животных моделях БАС митохондриальные аномалии предшествуют симптомам заболевания (Manfredi and Xu, 2005). Электронная микроскопия выявила структурные аномалии в митохондриях спинномозговых мотонейронов и в моторной коре у больных БАС. Нил Коуэлл из Бостонского университета сосредоточил свое выступление на SOD1 (супероксиддисмутаза Cu, Zn), первом идентифицированном гене, ответственном за возникновение БАС. Соответствующий белок мутирует примерно в 20% семейных случаев БАС. 2 Наиболее широко используемой животной моделью БАС является трансгенная мышь, несущая мутантный ген SOD1. У мыши развивается атрофия мышц, аналогичная таковой при БАС.
Митохондрии из двигательных нейронов в этой животной модели демонстрируют меньший размер, меньшее количество, дефект мембранного потенциала и нарушение слияния. Слияние митохондрий предназначено для распространения мтДНК среди популяции митохондрий и сохранения способности к окислительному фосфорилированию. Эти морфологические и физиологические изменения в мотонейронах mutSOD1 не наблюдаются в мотонейронах SOD1 дикого типа (Magrane et al., 2012). mutSOD1 также изменяет уровни по крайней мере 50 различных митохондриальных белков, включая белки, участвующие в цепи переноса электронов и в их слиянии, указывая на возможный широко распространенный эффект mutSOD1 (Karbowski and Neutzner, 2012).
Эти морфологические и физиологические изменения в мотонейронах mutSOD1 не наблюдаются в мотонейронах SOD1 дикого типа (Magrane et al., 2012). mutSOD1 также изменяет уровни по крайней мере 50 различных митохондриальных белков, включая белки, участвующие в цепи переноса электронов и в их слиянии, указывая на возможный широко распространенный эффект mutSOD1 (Karbowski and Neutzner, 2012).
mutSOD1 также вызывает повреждение митохондрий, о чем свидетельствует увеличение содержания цитохрома с в цитозоле. Поскольку цитохром с является важным компонентом электрон-транспортной цепи, расположенной во внутренней мембране митохондрий, его выход в цитоплазму свидетельствует о разрушении мембран митохондрий. Но этот токсический эффект возникает только в присутствии белка Bcl-2, который может изменить свой функциональный фенотип и стать токсичным белком (Pedrini et al., 2010). Идентификация Bcl-2 как необходимого фактора токсичности SOD1 предполагает, что Bcl-2 можно использовать в качестве молекулярной мишени для препаратов, предназначенных для ингибирования его действия (Pedrini et al. , 2010). Bcl-2 также может быть важной мишенью не только при семейном БАС, но, возможно, и при спорадическом БАС, сказал Коуэлл. Это связано с тем, что исследования недавно показали, что в подгруппе пациентов с БАС с бульбарным началом SOD1 дикого типа становится гиперокисленной. Вместе с Bcl-2 гиперокисленный wtSOD1 проявляет митохондриальную токсичность, подобную наблюдаемой с mutSOD1. Таким образом, Bcl-2 представляет собой обычное связующее звено между семейным и подтипом спорадического БАС и, таким образом, является хорошей мишенью для терапевтических средств, которые его ингибируют.
, 2010). Bcl-2 также может быть важной мишенью не только при семейном БАС, но, возможно, и при спорадическом БАС, сказал Коуэлл. Это связано с тем, что исследования недавно показали, что в подгруппе пациентов с БАС с бульбарным началом SOD1 дикого типа становится гиперокисленной. Вместе с Bcl-2 гиперокисленный wtSOD1 проявляет митохондриальную токсичность, подобную наблюдаемой с mutSOD1. Таким образом, Bcl-2 представляет собой обычное связующее звено между семейным и подтипом спорадического БАС и, таким образом, является хорошей мишенью для терапевтических средств, которые его ингибируют.
Болезнь Гентингтона
Болезнь Хантингтона — аутосомно-доминантное заболевание, при котором мутантный белок мхантингтин (mHTT) содержит избыточные полиглутаминовые повторы. mHTT локализуется на внешней митохондриальной мембране, где он оказывает обширное и вредное воздействие на митохондрии и избирательную потерю нейронов в стриатуме. Коуэлл сказал, что большое количество доказательств показывает, что mHTT снижает подвижность митохондрий, изменяет митохондриальную морфологию, вызывает дисрегуляцию кальция, снижает окислительное фосфорилирование и деполяризует митохондриальную мембрану в лимфобластах пациентов с болезнью Гентингтона. Деполяризация увеличивается с увеличением числа полиглутаминовых повторов. mHTT также изменяет баланс между слиянием и делением митохондрий (Lin and Beal, 2006; Reddy and Reddy, 2011).
Деполяризация увеличивается с увеличением числа полиглутаминовых повторов. mHTT также изменяет баланс между слиянием и делением митохондрий (Lin and Beal, 2006; Reddy and Reddy, 2011).
В последнее время появилось несколько терапевтических стратегий для лечения болезни Гентингтона, отметил Коуэлл. Одним из путей является нацеливание на белок деления митохондрий 3 , с которым связывается mHTT, GTPase dynamin-related protein 1 (DRP1). Нацеленность на DRP1 подтверждается обнаружением того, что доминантно-негативный мутант DRP1K38A, который снижает активность DRP1, спасает митохондрии от следующих неблагоприятных эффектов mHTT: фрагментация митохондрий, дефекты антероградного и ретроградного транспорта митохондрий и гибель нейронов. Об этих результатах сообщалось в клетках людей с болезнью Хантингтона и мышей (Song et al., 2011). Другими словами, соединения, которые ингибируют DRP1, могут быть полезны в качестве потенциальной терапии.
Коуэлл описал еще два новых метода лечения. Первая направлена на детоксикацию HTT. Он включает внутрижелудочковую инфузию ганглиозида GM1, который фосфорилирует мутантный HTT по определенным аминокислотным остаткам серина. Такой подход не только снижал токсичность HTT, но и восстанавливал нормальную двигательную функцию у мышей с симптомами болезни Гентингтона (Di Pardo et al., 2012). Вторая терапия проводится уже одобренным препаратом меклизином. Этот препарат подавляет митохондриальное дыхание и активирует пути выживания клеток. В нескольких моделях болезни Хантингтона было обнаружено, что меклизин оказывает нейропротекторное действие (Gohil et al., 2011).
Первая направлена на детоксикацию HTT. Он включает внутрижелудочковую инфузию ганглиозида GM1, который фосфорилирует мутантный HTT по определенным аминокислотным остаткам серина. Такой подход не только снижал токсичность HTT, но и восстанавливал нормальную двигательную функцию у мышей с симптомами болезни Гентингтона (Di Pardo et al., 2012). Вторая терапия проводится уже одобренным препаратом меклизином. Этот препарат подавляет митохондриальное дыхание и активирует пути выживания клеток. В нескольких моделях болезни Хантингтона было обнаружено, что меклизин оказывает нейропротекторное действие (Gohil et al., 2011).
Болезнь Альцгеймера
Митохондриальная дисфункция предшествует патологическим изменениям, которые являются отличительными чертами болезни Альцгеймера (Yao et al., 2009). Дуглас Уоллес из Детской больницы Филадельфии предположил, что причиной болезни Альцгеймера и деменции в более широком смысле является основная дисфункция митохондрий. Начиная с 1993 года группа Уоллеса обнаружила мутацию в одном из генов митохондриальной тРНК.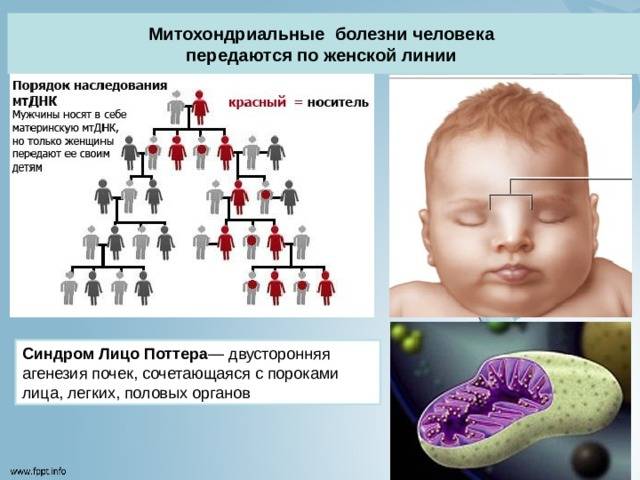 Мутация коррелировала с 3 процентами случаев болезни Альцгеймера с поздним началом, 5 процентами болезни Паркинсона и 7 процентами населения в целом. Вывод был позже подтвержден другими. Он утверждал, что тонкие дефекты в тРНК будут генерировать более глобальные дефекты синтеза митохондриальных белков. Впоследствии его группа начала изучать мутацию в положении 414 нуклеотида, которое примыкает к промотору контрольной области мтДНК. Ранее было показано, что мутация увеличивается с возрастом в фибробластах человека (Michikawa et al., 19).99). Команда Уоллеса обнаружила мутацию в 65% мозга больных Альцгеймером и в 57% мозга людей с синдромом Дауна и деменцией по сравнению с 0% контрольной группы того же возраста (Coskun et al., 2004).
Мутация коррелировала с 3 процентами случаев болезни Альцгеймера с поздним началом, 5 процентами болезни Паркинсона и 7 процентами населения в целом. Вывод был позже подтвержден другими. Он утверждал, что тонкие дефекты в тРНК будут генерировать более глобальные дефекты синтеза митохондриальных белков. Впоследствии его группа начала изучать мутацию в положении 414 нуклеотида, которое примыкает к промотору контрольной области мтДНК. Ранее было показано, что мутация увеличивается с возрастом в фибробластах человека (Michikawa et al., 19).99). Команда Уоллеса обнаружила мутацию в 65% мозга больных Альцгеймером и в 57% мозга людей с синдромом Дауна и деменцией по сравнению с 0% контрольной группы того же возраста (Coskun et al., 2004).
Совсем недавно команда Уоллеса исследовала более глобально контрольную область мтДНК в ткани, взятой из лобной коры головного мозга. Контрольная область отвечает за регуляцию транскрипции митохондриальных генов и помогает копировать мтДНК. Они обнаружили самый высокий уровень соматических мутаций в мозге людей с болезнью Альцгеймера (Coskun et al. , 2010). Частота мутаций также была повышена в случаях синдрома Дауна и деменции по сравнению с контрольной группой, но была ниже, чем при болезни Альцгеймера. В контрольной ткани действительно наблюдалось возрастное увеличение частоты мутаций, хотя уровень был ниже, чем в других группах. Повышенный уровень мутаций был также обнаружен в сыворотке и других тканях при болезни Альцгеймера и синдроме Дауна, что позволяет предположить, что это явление является системным. Но, по словам Уоллеса, мозг является наиболее пораженной тканью из-за его непропорционально высоких энергетических потребностей. Исследование также обнаружило снижение транскрипции мтДНК и уменьшение количества копий мтДНК, что указывает на снижение окислительного фосфорилирования.
, 2010). Частота мутаций также была повышена в случаях синдрома Дауна и деменции по сравнению с контрольной группой, но была ниже, чем при болезни Альцгеймера. В контрольной ткани действительно наблюдалось возрастное увеличение частоты мутаций, хотя уровень был ниже, чем в других группах. Повышенный уровень мутаций был также обнаружен в сыворотке и других тканях при болезни Альцгеймера и синдроме Дауна, что позволяет предположить, что это явление является системным. Но, по словам Уоллеса, мозг является наиболее пораженной тканью из-за его непропорционально высоких энергетических потребностей. Исследование также обнаружило снижение транскрипции мтДНК и уменьшение количества копий мтДНК, что указывает на снижение окислительного фосфорилирования.
Обращаясь к причинно-следственной связи нейродегенеративного заболевания, Уоллес выразил мнение, что образование бляшек Aβ не является причинной; скорее, предположил он, белок Aβ первоначально продуцируется клетками в качестве компенсаторного средства , защищающего митохондрий. Но поскольку белок продолжает вырабатываться, он начинает агрегировать с образованием олигомеров и более крупных агрегатов, которые ингибируют митохондрии, что приводит к повреждению и гибели клеток. Согласно этой модели, белковые агрегаты способствуют гибели нейронов при нейродегенеративном заболевании, но не являются причиной. Первичная причина, согласно его гипотезе, лежит в дисфункциональных митохондриях. Он высказал мнение, что «общим патофизиологическим механизмом всех этих нейродегенеративных заболеваний является биоэнергетика». Затем в ходе обсуждения его допросили несколько скептически настроенных участников, которые не согласились с его причинной атрибуцией. В ответ Уоллес рассказал, как его команда разработала способ введения точечной мутации цитохромоксидазы в мтДНК и обнаружила, что у животного развилась кардиомиопатия, миопатия и патологические изменения в нейронах гиппокампа, ганглиозных клетках сетчатки и зрительном нерве. «Эта конкретная точечная мутация — она не имеет ничего общего с ядром — показывает, что энергетика может влиять на все эти различные функции», — заявил он.
Но поскольку белок продолжает вырабатываться, он начинает агрегировать с образованием олигомеров и более крупных агрегатов, которые ингибируют митохондрии, что приводит к повреждению и гибели клеток. Согласно этой модели, белковые агрегаты способствуют гибели нейронов при нейродегенеративном заболевании, но не являются причиной. Первичная причина, согласно его гипотезе, лежит в дисфункциональных митохондриях. Он высказал мнение, что «общим патофизиологическим механизмом всех этих нейродегенеративных заболеваний является биоэнергетика». Затем в ходе обсуждения его допросили несколько скептически настроенных участников, которые не согласились с его причинной атрибуцией. В ответ Уоллес рассказал, как его команда разработала способ введения точечной мутации цитохромоксидазы в мтДНК и обнаружила, что у животного развилась кардиомиопатия, миопатия и патологические изменения в нейронах гиппокампа, ганглиозных клетках сетчатки и зрительном нерве. «Эта конкретная точечная мутация — она не имеет ничего общего с ядром — показывает, что энергетика может влиять на все эти различные функции», — заявил он.
БЕЛКОВЫЕ ДЕПОЗИТЫ И ТОКСИЧНОСТЬ ДЛЯ МИТОХОНДРИЙ
Многочисленные данные свидетельствуют о том, что токсичные белки, такие как Aβ, фрагменты аполипопротеина E (ApoE) и α-синуклеин, могут повредить митохондрии, сказал Леннарт Маке из Институтов Гладстона и Калифорнийского университета в Сан-Франциско. В этом случае поврежденные митохондрии не будут основной причиной заболевания, а скорее будут вторичными по отношению к действиям агрегированных белков, которые и будут основной причиной. Значительное количество исследований показывает, что пептиды Aβ накапливаются в митохондриях, где они вызывают дисфункцию и апоптоз (Manczak et al., 2006; Yao et al., 2009).).
Одним из возможных механизмов токсичности белковых отложений для нейронов является нарушение аксонального транспорта митохондрий. Митохондрии генерируются в основном в теле клетки и должны активно транспортироваться в синапс, где потребность в энергии высока. Без митохондрий синаптическая функция может быть нарушена. Mucke и его команда оценили эффекты белков Aβ и tau на аксональный транспорт митохондрий (Vossel et al., 2010). Они обнаружили, что добавление олигомеров Aβ в культуру быстро ингибирует аксональный транспорт митохондрий в здоровых нейронах, что подтверждается более ранними исследованиями. Их также интересовало определение того, играет ли роль тау. Снижение уровня тау предотвратило индуцированное олигомером Aβ нарушение транспорта аксонов, не влияя на исходный аксональный транспорт. Полное устранение тау путем нокдауна гена также имело тот же эффект. Они пришли к выводу, что «Aβ требует тау для нарушения аксонального транспорта, и что снижение уровня тау защищает от дефектов Aβ-индуцированного аксонального транспорта» (Vossel et al., 2010, стр. 19).8-а).
Mucke и его команда оценили эффекты белков Aβ и tau на аксональный транспорт митохондрий (Vossel et al., 2010). Они обнаружили, что добавление олигомеров Aβ в культуру быстро ингибирует аксональный транспорт митохондрий в здоровых нейронах, что подтверждается более ранними исследованиями. Их также интересовало определение того, играет ли роль тау. Снижение уровня тау предотвратило индуцированное олигомером Aβ нарушение транспорта аксонов, не влияя на исходный аксональный транспорт. Полное устранение тау путем нокдауна гена также имело тот же эффект. Они пришли к выводу, что «Aβ требует тау для нарушения аксонального транспорта, и что снижение уровня тау защищает от дефектов Aβ-индуцированного аксонального транспорта» (Vossel et al., 2010, стр. 19).8-а).
Другим белком, связанным с заболеванием, который повреждает митохондрии, является ApoE. Ген ApoE является основным геном предрасположенности, идентифицированным для болезни Альцгеймера с поздним началом, и он находится на хромосоме 19. Нейроны продуцируют ApoE, когда они подвергаются стрессу под действием множества факторов, включая старение, окислительный стресс, травму и отложение белка. Считается, что синтез ApoE защищает нейроны от повреждений, а также восстанавливает и реконструирует их. Однако исследования показали, что продукты расщепления ApoE повреждают митохондрии (Brecht et al., 2004). По словам Макке, аллель ApoE e4, связанный с болезнью Альцгеймера, наиболее чувствителен к расщеплению, в то время как другие аллели ApoE менее чувствительны.
Нейроны продуцируют ApoE, когда они подвергаются стрессу под действием множества факторов, включая старение, окислительный стресс, травму и отложение белка. Считается, что синтез ApoE защищает нейроны от повреждений, а также восстанавливает и реконструирует их. Однако исследования показали, что продукты расщепления ApoE повреждают митохондрии (Brecht et al., 2004). По словам Макке, аллель ApoE e4, связанный с болезнью Альцгеймера, наиболее чувствителен к расщеплению, в то время как другие аллели ApoE менее чувствительны.
МИТОХОНДРИАЛЬНЫЕ ЗАБОЛЕВАНИЯ И ИХ ПОЛЕЗНОСТЬ ПРИ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЯХ
Учитывая неопределенность в отношении того, какую роль митохондриальная дисфункция играет в нейродегенеративных заболеваниях, Мута предположил ценность изучения первичных митохондриальных заболеваний, которые относятся к почти 150 генетическим заболеваниям, при которых поражение лежит в ген, кодирующий белок, непосредственно участвующий в биологии митохондрий. Болезни неоднородны, десятки находятся в центре внимания исследований на протяжении многих десятилетий. Вызванные генетическими мутациями или делециями одного гена, они следуют менделевскому или материнскому типу наследования.
Вызванные генетическими мутациями или делециями одного гена, они следуют менделевскому или материнскому типу наследования.
Митохондриальные заболевания могут пролить свет на нейродегенеративные заболевания, сказал Мутха, отчасти потому, что фенотипы заболеваний схожи. Например, некоторые фенотипы митохондриальных заболеваний включают атаксию, невропатию, миопатию, глухоту и слепоту. Действительно, несколько последующих презентаций были посвящены митохондриальной патологии при нейродегенеративных заболеваниях, таких как болезнь Паркинсона и БАС. Еще одна причина, по которой митохондриальные заболевания играют важную роль в нейродегенеративных заболеваниях, заключается в том, что, как и при нейродегенеративных заболеваниях, вовлекаются многие системы органов, а их генетика лучше охарактеризована с помощью амбициозного проекта, известного как Mitocarta, который представляет собой перечень более 1000 мышиных генов, кодирующих белки. которые локализуются в митохондриях (Pagliarini et al. , 2008). Наконец, митохондриальные заболевания ценны, по его мнению, тем, что они обеспечивают «генетические крайности», которые могут помочь определить, может ли конкретное нейродегенеративное заболевание иметь митохондриальные дефекты в качестве основной причины. Мутха посоветовал искать связи между митохондриальными и нейродегенеративными заболеваниями, когда есть хотя бы какие-то точки соприкосновения, например, в патогенезе, патологии или биомаркерах.
, 2008). Наконец, митохондриальные заболевания ценны, по его мнению, тем, что они обеспечивают «генетические крайности», которые могут помочь определить, может ли конкретное нейродегенеративное заболевание иметь митохондриальные дефекты в качестве основной причины. Мутха посоветовал искать связи между митохондриальными и нейродегенеративными заболеваниями, когда есть хотя бы какие-то точки соприкосновения, например, в патогенезе, патологии или биомаркерах.
Несмотря на то, что митохондрии выглядят одинаково при микроскопии, внешний вид обманчив. Мутха отметил огромную неоднородность митохондрий в разных тканях. Он сообщил, что после изучения 14 различных тканей исследования показали, что митохондрии из 2 разных тканей имеют только 75 процентов общих белков, тогда как остальные митохондриальные белки являются тканеспецифичными. Существует даже физиологическая неоднородность внутри отдельной клетки — митохондрии, например, могут иметь разные модели использования топлива. Учитывая разнообразие фенотипов и генотипов, Мутха выступал за системный подход к изучению митохондриальной функции. Такой подход сочетает в себе геномику, протеомику, метаболомику, биохимию и компьютерное моделирование, чтобы охватить динамический диапазон сложных взаимодействий внутри клеток и между тканями. Он заметил, что применение системной биологии к нейродегенеративным заболеваниям потребует определения составных частей, построения схем соединений для соединения этих частей, определения схем, вызывающих заболевание, и использования знаний для разработки методов лечения.
Такой подход сочетает в себе геномику, протеомику, метаболомику, биохимию и компьютерное моделирование, чтобы охватить динамический диапазон сложных взаимодействий внутри клеток и между тканями. Он заметил, что применение системной биологии к нейродегенеративным заболеваниям потребует определения составных частей, построения схем соединений для соединения этих частей, определения схем, вызывающих заболевание, и использования знаний для разработки методов лечения.
МИТОХОНДРИИ И СМЕРТЬ КЛЕТОК
Общим для нейродегенеративных заболеваний является то, что все они характеризуются высокой степенью гибели клеток. Здесь основное внимание уделяется митохондриям; митохондрии играют ключевую роль в регуляции гибели клеток, которая происходит в определенных областях мозга при всех нейродегенеративных заболеваниях. Гибель клеток бывает трех типов: (1) некроз, представляющий собой наиболее хаотичную форму гибели, которая включает набухание цитоплазмы, растворение ядра и лизис; (2) апоптоз, упорядоченная форма смерти, зависящая от АТФ, которая производит клеточные фрагменты, которые фагоцитирующие клетки способны поглощать и удалять до того, как содержимое клетки извергнется на окружающие клетки и вызовет повреждение; и (3) аутофагия, при которой клетка разрушает свою цитоплазму и органеллы с помощью лизосом (Martin et al. , 2010). Митохондрии — это места, где взаимодействуют антиапоптотические и проапоптотические белки, и они регулируют сигналы клеточной гибели.
, 2010). Митохондрии — это места, где взаимодействуют антиапоптотические и проапоптотические белки, и они регулируют сигналы клеточной гибели.
Ли Мартин из Университета Джона Хопкинса предупредил, что гибель клеток в моделях нейродегенеративных заболеваний у людей и животных может происходить по разным механизмам. Он сообщил о различиях между видами мышей и людей в факторах, контролирующих переход митохондриальной проницаемости (MPT), то есть увеличение проницаемости митохондриальных мембран для молекул с малой молекулярной массой. MPT возникает в результате открытия поры перехода митохондриальной проницаемости, белковой поры, образующейся в митохондриальных мембранах при определенных патологических состояниях. Индукция поры перехода проницаемости может привести к набуханию митохондрий и некрозу, а также играет важную роль в некоторых типах апоптоза. Мартин также отметил видовые различия в механизмах передачи сигналов каспаз, которые представляют собой ферменты, находящиеся под контролем митохондрий, которые имеют решающее значение для апоптоза, различия в субстратах касп, различия в механизмах слияния митохондрий и в механизмах передачи сигналов для репарации и метаболизма ДНК, среди прочего. Он заметил, что межвидовые различия в гибели клеток мешают переводу результатов, полученных с животных моделей, в клинические испытания на людях. Он предложил изменить дизайн доклинических исследований, чтобы меньше полагаться на мыши в качестве моделей и больше на нейроны, полученные из нервных стволовых клеток человека.
Он заметил, что межвидовые различия в гибели клеток мешают переводу результатов, полученных с животных моделей, в клинические испытания на людях. Он предложил изменить дизайн доклинических исследований, чтобы меньше полагаться на мыши в качестве моделей и больше на нейроны, полученные из нервных стволовых клеток человека.
ПОТЕНЦИАЛЬНЫЕ БИОМАРКЕРЫ И ТЕРАПИИ
Нет установленных биомаркеров или методов лечения для лечения митохондриальной дисфункции при нейродегенеративных заболеваниях. Уоллес сказал, что его лаборатория работает над их разработкой. Одним из разрабатываемых биомаркеров является спектроскопия кожи в ближнем инфракрасном диапазоне с использованием различных инфракрасных диодов, которые исследуют окислительно-восстановительный потенциал дыхательных цепей. Уоллес сказал, что его лаборатория также разрабатывает биомаркер с использованием анализа дыхания микроорганизмов. Они надеются получить некоторые суррогатные переменные, которые изменяются в режиме реального времени, а затем перейти к фазе I клинических испытаний и иметь по крайней мере показания безопасности/эффективности.
Что касается методов лечения, в этой главе уже упоминались некоторые из них, относящиеся к конкретным нейродегенеративным заболеваниям. Вместо этого сосредоточившись на родовых методах лечения митохондриальной дисфункции, Уоллес сказал, что его первоочередной задачей в терапии будет стимуляция образования большего количества митохондрий. Препараты для создания митохондрий тестируются на различных животных моделях и в системах клеточных культур. В частности, он отметил, что препарат безафибрат увеличивает биогенез митохондрий в раковых клетках и улучшает митохондриальную дисфункцию (Wang and Moraes, 2011). Он еще не был испытан на клетках головного мозга.
Другие варианты лечения, объяснил Уоллес, включают (1) каталитические антиоксиданты для защиты от АФК; (2) регуляторы внутриклеточного кальция; и (3) регуляторы окислительно-восстановительного потенциала через митохондриальную мембрану. Поддержание окислительно-восстановительного потенциала имеет решающее значение для целостности митохондрий и контроля окислительного фосфорилирования. Один участник отметил, что антиоксидантная терапия в клинических испытаниях всегда оказывалась неэффективной, но Уоллес ответил, что дозы, возможно, были недостаточно высокими. Другой участник посоветовал нацеливать митохондриальную терапию в случаях пороговых эффектов, то есть в момент, когда происходит значительное нарушение функции митохондрий. Участник также отметил, что митохондриальная терапия может иметь вторичные недостатки.
Один участник отметил, что антиоксидантная терапия в клинических испытаниях всегда оказывалась неэффективной, но Уоллес ответил, что дозы, возможно, были недостаточно высокими. Другой участник посоветовал нацеливать митохондриальную терапию в случаях пороговых эффектов, то есть в момент, когда происходит значительное нарушение функции митохондрий. Участник также отметил, что митохондриальная терапия может иметь вторичные недостатки.
ПОТРЕБНОСТИ В ИССЛЕДОВАНИЯХ И СЛЕДУЮЩИЕ ШАГИ, ПРЕДЛОЖЕННЫЕ ОТДЕЛЬНЫМИ УЧАСТНИКАМИ
Спикеры семинара определили множество вопросов для будущих исследований и другие возможности для будущих действий. Предложения, связанные с митохондриальной дисфункцией, собраны здесь, чтобы дать представление о диапазоне сделанных предложений. Предложения отождествляются с докладчиком, который их сделал, и не должны рассматриваться как отражение консенсуса на семинаре или одобрение Институтом медицины.
Развивать более глубокое понимание энергетической биологии и взаимодействия между биоэнергетикой и влиянием окружающей среды.
 (Уоллес)
(Уоллес)Определите биомаркеры для отслеживания функционирования митохондрий. (Ли, Мутха)
Найдите биомаркеры угасания митохондрий. (Mootha)
Определить новые методы лечения, которые усиливают митохондриальный биогенез. (Wallace)
Определить методы лечения, которые препятствуют митохондриальному вкладу в патогенез нейродегенеративного заболевания, включая методы лечения, которые усиливают митофагию или стимулируют активность PINK1 и паркина. (Мута, Юл)
Найдите методы лечения, которые детоксифицируют агрегаты мутантных белков, которые взаимодействуют с митохондриями. (Kowall)
Сноски
- 1
АФК образуются как побочный продукт окислительного фосфорилирования.
- 2
Примерно от 5 до 10 процентов случаев БАС являются семейными.
- 3
Деление митохондрий — это механизм контроля качества, при котором митохондрия делится на две части, одна здоровая, а другая содержит поврежденную часть митохондрий.

