Метод пцр что это как берется у женщин: что это такое? Диагностика инфекционных заболеваний методом полимеразной цепной реакции
тестирование — что это такое, как работает метод ПЦР, показания, подготовка к проведению ПЦР-теста, как проводится ПЦР-анализ, результаты теста
Опубликовано: 10.02.2021 13:07:00 Обновлено: 18.02.2021 Просмотров: 257885
ПЦР – высокоточный метод диагностики и одно из самых главных открытий в области биологии за последние десятилетия. ПЦР-анализ применяется уже почти 40 лет и считается наиболее точным и чувствительным способом диагностики инфекционных заболеваний.
ПЦР – уникальный и универсальный метод, тест используется не только в клинической лабораторной диагностике, но также в биологии, криминалистике, археологии и многих других научных областях. Все, что нужно для проведения анализа – небольшое количество любого биоматериала пациента.
Суть метода ПЦР
ПЦР – полимеразная цепная реакция. Метод основан на обнаружении даже небольших концентраций искомого элемента диагностики. Для определения изначально крайне малых концентраций РНК или ДНК, которые необходимо определить в процессе проведения основного этапа исследования, используется метод искусственного увеличения количества РНК или ДНК. А поскольку они специфичны и строго индивидуальны для каждого микроорганизма или живого существа за счет уникальности последовательности нуклеотидов во фрагментах, ошибка в определении целевого ДНК или РНК исключена.
Для определения изначально крайне малых концентраций РНК или ДНК, которые необходимо определить в процессе проведения основного этапа исследования, используется метод искусственного увеличения количества РНК или ДНК. А поскольку они специфичны и строго индивидуальны для каждого микроорганизма или живого существа за счет уникальности последовательности нуклеотидов во фрагментах, ошибка в определении целевого ДНК или РНК исключена.
Генетическая информация любого живого организма записывается в ДНК. Эта молекула состоит из двух цепочек, сплетающихся в единую спираль. Некоторые вирусы (например, COVID-19) хранят свой код в РНК – одной нити нуклеотидов.
Для каждого организма, включая вирусы, бактерии и грибки, последовательность нуклеотидов уникальна. Ее можно сравнить с отпечатком пальца или сканом сетчатки глаза человека. Укороченные последовательности нуклеотидов, характерные для каждого вида патогена (возбудителя опасных заболеваний), хранятся в базах научных лабораторий в виде праймеров – отдельных участков ДНК, типичных для только конкретного возбудителя.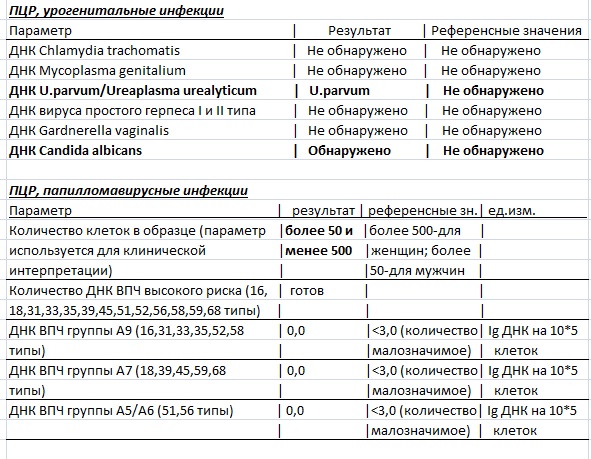 Эти участки значительно короче любой молекулы ДНК. Такие праймеры присоединяются к ДНК возбудителя в пробе и под действием катализаторов многократно воспроизводят свои дубли. Этот процесс называются «репликация» – многократное увеличение, дублирование искомого участка до тех пор, пока он не станет доступен для определения. Процесс репликации возможен только при наличии в пробе ДНК возбудителя.
Эти участки значительно короче любой молекулы ДНК. Такие праймеры присоединяются к ДНК возбудителя в пробе и под действием катализаторов многократно воспроизводят свои дубли. Этот процесс называются «репликация» – многократное увеличение, дублирование искомого участка до тех пор, пока он не станет доступен для определения. Процесс репликации возможен только при наличии в пробе ДНК возбудителя.
Преимущества метода ПЦР
- Высокая специфичность. Метод ПЦР определяет заданную последовательность нуклеотидов, присущую конкретному патогену. Таким образом, специфичность теста стремится к 100%. Исключен риск ложноположительных результатов.
- Чувствительность. Для ПЦР достаточно всего несколько молекул ДНК патогена (или даже уже неактивных – разрушенных вирусных частиц, сохранивших специфические участки ДНК в достаточном количестве), чтобы он был обнаружен в ходе исследования.
- Скорость проведения. Лаборатория получает результат ПЦР-теста через несколько часов, клиент – уже на следующий день.
 Скорость диагностики имеет принципиально важное значение для своевременного лечения. Например, при диагностике бактериальных инфекций классический посев занимает от нескольких дней, а с ПЦР-анализом пациент сможет принять меры и начать лечение уже через сутки.
Скорость диагностики имеет принципиально важное значение для своевременного лечения. Например, при диагностике бактериальных инфекций классический посев занимает от нескольких дней, а с ПЦР-анализом пациент сможет принять меры и начать лечение уже через сутки. - Универсальность. Для исследования подходит любой биоматериал: кровь, моча, сперма, мокрота, гной, жидкости из абсцессов и пр. Кроме этого, ПЦР применяется в самых разных областях науки и медицины, работая даже там, где другие методы бессильны.
- Диагностика латентных инфекций. ПЦР-диагностика определяет возбудителя инфекции даже в инкубационном периоде и при скрытом течении заболевания.
Какие есть недостатки
Единственный серьезный недостаток, связанный с методом полимеразной цепной реакции, — его высокая технологичность. Исследования ПЦР требуют строжайших соблюдений правил и серьезной оснащенности лабораторного комплекса. Не каждая лаборатория может позволить себе все необходимое оборудование.
Показания к проведению ПЦР-анализа
ПЦР – один из наиболее востребованных способов диагностики в медицине, и применяется он в самых разных областях:
- Диагностика инфекционных заболеваний (гепатит, ВИЧ, TORCH-инфекции и огромное множество других видов патогенов).
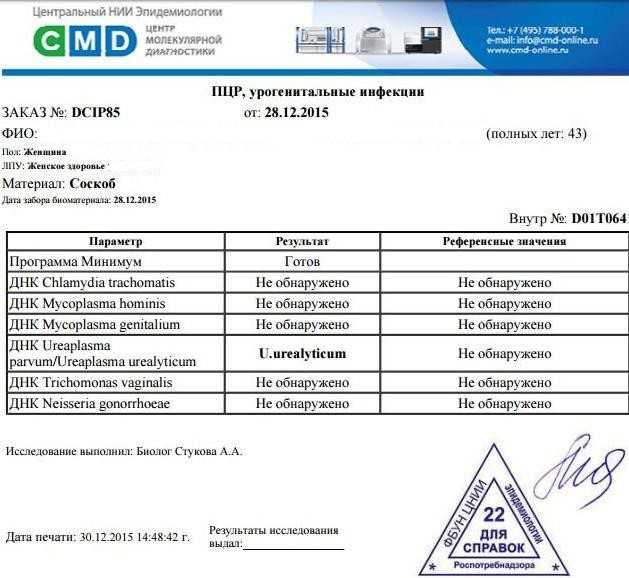
- Урогинекология (диагностика инфекций, передающихся половым путем: хламидиоз, уреаплазма, микоплазма, кандиды, гарднерелла, герпесвирусы). Важное значение для женского и мужского здоровья играет ВПЧ – вирус папилломы человека. Доказано, что у женщин онкогенные штаммы этого вируса способны вызывать рак шейки матки.
- Неонатология. Существует целый ряд инфекций, способных поражать плод еще в материнской утробе. Среди них вирусы герпеса, токсоплазмы, краснухи. ПЦР-диагностика позволяет правильно определить тактику ведения и риски внутриутробной инфекции.
- Респираторные заболевания. Диагностика методом ПЦР стала в 2020 году актуальной как никогда и продемонстрировала свою незаменимость и эффективность.
 ПЦР-анализ – главный тест и «золотой стандарт» диагностики коронавирусной инфекции Sars-Cov-2 (COVID-19), ставшей причиной самой масштабной пандемии последних десятилетий.
ПЦР-анализ – главный тест и «золотой стандарт» диагностики коронавирусной инфекции Sars-Cov-2 (COVID-19), ставшей причиной самой масштабной пандемии последних десятилетий. - Генетика. Наследственные заболевания и отцовство также диагностируются при помощи метода ПЦР.
ПЦР-тесты применяются везде, где нужен быстрый, точный и надежный результат.
Подготовка к проведению ПЦР-теста
Еще одно немаловажное преимущество ПЦР-анализов – это отсутствие специфической подготовки к проведению тестов. Достаточно следовать стандартным рекомендациям специалиста:
- Анализ сдается утром натощак. При этом ряд генетических исследований проводится в произвольное время, удобное пациенту.
-
При сдаче анализа по мазку из ротоглотки необходимо выдержать интервал с приемом пищи и воды в 3-4 часа перед тестом. -
Перед анализом на венерические инфекции необходимо воздержаться от половой активности в течение суток.
-
Перед анализом нельзя использовать никакие противовирусные препараты.
Подробную инструкцию по правилам подготовки к каждому анализу вы всегда можете получить у лечащего врача или у консультантов на нашей горячей линии.
Как проводится ПЦР-анализ
С 1983 года, когда был изобретен данный метод, прошло много времени, и технологии не стоят на месте. Сегодня существует несколько различных методик для проведения ПЦР-теста:
- С обратной транскрипцией. Самый распространенный способ идентификации известной последовательности РНК, включающий амплификацию, определение патогена и его идентификации среди образцов, хранящихся в научной картотеке.
- Вложенная ПЦР (или «гнездовая») — используется для снижения количества неспецифичных продуктов реакции и имеет две стадии с использованием двух видов праймеров.
- Изотермические методы – не требуют повторяющихся температурных циклов, менее энергозатратны.

- Инвертированная ПЦР — применяется, если имеется только короткий фрагмент известной последовательности, но необходимо определить соседние последовательности после вставки ДНК в геном.
- ПЦР в реальном времени — метод, позволяющий определить не только присутствие целевой нуклеотидной последовательности в образце, но и измерять количество ее копий после каждого цикла амплификации, что дает возможность для проведения тестов с количественным результатом
Это далеко не все существующие на сегодняшний день разновидности ПЦР-технологий. Ученые активно развивают эту важную и перспективную область лабораторной диагностики, совершенствуют методы ПЦР, оттачивают техники и изобретают новые подходы.
Результаты ПЦР-теста
Результаты анализов, проведенных методом ПЦР, известны уже через один день. Иногда возможно проведение экстренного теста – его часто используют при оказании срочной медицинской помощи при госпитализации.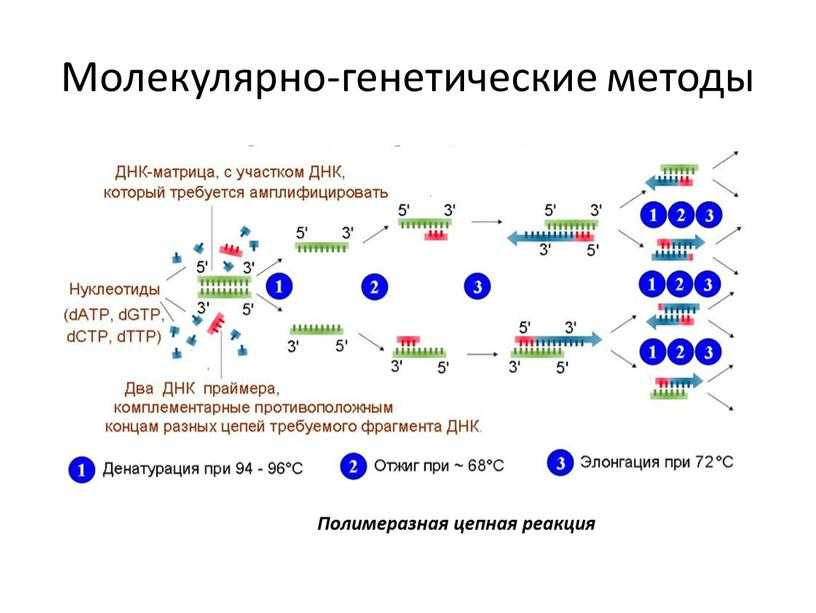 Тогда срок готовности результата сокращается до считанных часов.
Тогда срок готовности результата сокращается до считанных часов.
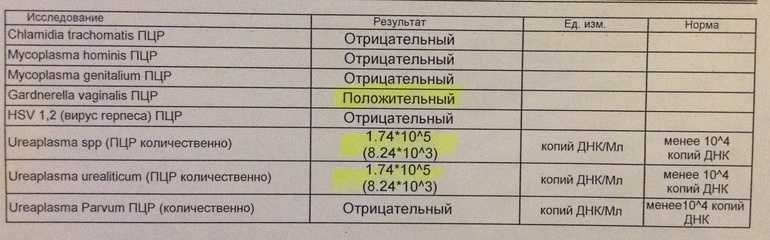
Результаты ПЦР-теста дадут точную информацию о том, какая инфекция была обнаружена. При количественном тестировании анализ определит также вирусную или бактериальную нагрузку на организм. В этом случае в результатах будет значиться титр обнаруженного патогена (его количество в одном миллилитре пробы). Количественный анализ особенно важен при диагностике заболеваний, спровоцированных условно-патогенными микроорганизмами, которые присутствуют в норме практически у каждого человека. Такие микроорганизмы представляют угрозу только при большой численности, а в остальных случаях мирно сосуществуют с носителем.
Метод ПЦР: описание, симптомы, диагностика и лечение
Миссия и ценности
Благодарственные письма от наших партнеров и дружественных организаций
Врачи
Администрация
Отдел продаж
Руководство
Лаборатория
12 причин выбрать ЛабСтори
Система качества и награды
Лицензии и сертификаты
СОУТ
Вакансии
Новости
Правила использования промокодов
Правила проведения промоакций
Как получить налоговый вычет в ЛабСтори
Часто задаваемые вопросы
Книга знаний
Документы и страховые компании
Партнёры
Общие правила подготовки пациентов к сдаче анализов
Отзывы
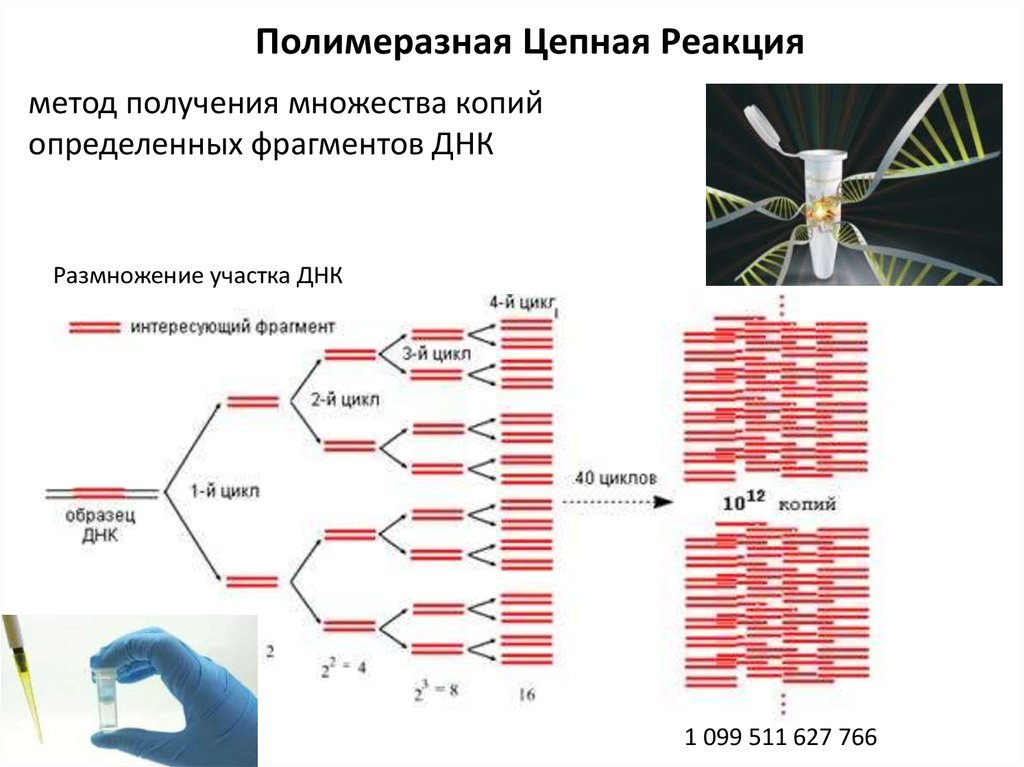
Метод ПЦР (полимеразно цепной реакции) – это высоко специфический метод молекулярной диагностики, позволяющий определить в биоматериале содержание фрагментов ДНК или РНК возбудителя инфекции.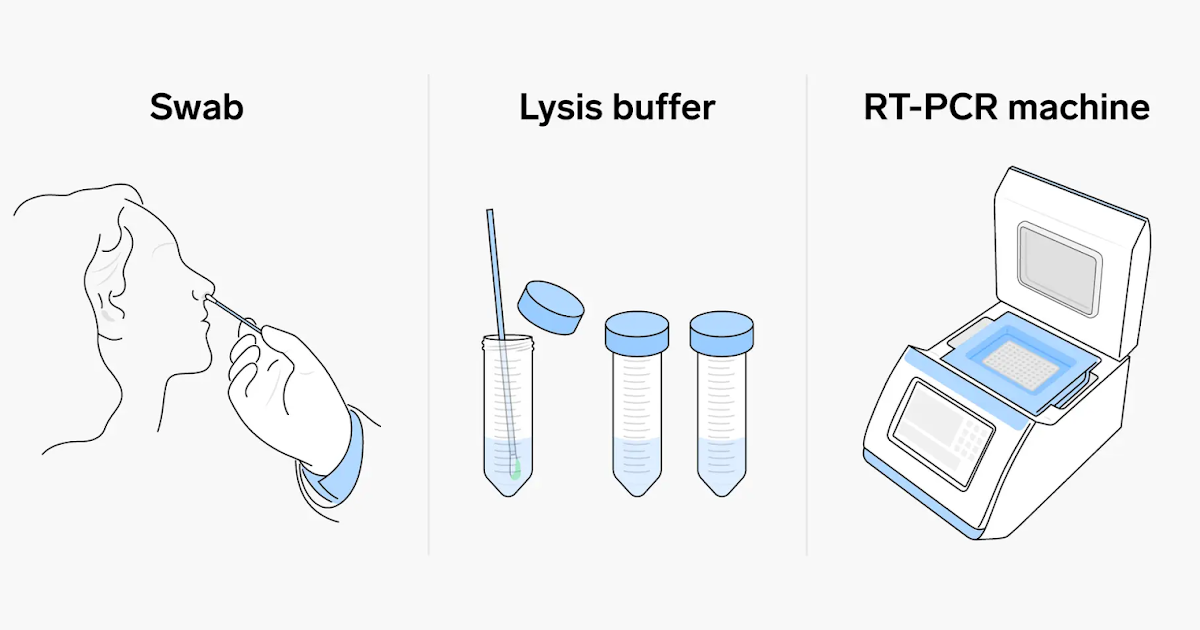 В основе метода ПЦР лежит многократное удвоение определенного участка ДНК при помощи ферментов в искусственных условиях (in vitro). В результате нарабатывается такое количество ДНК, которое является достаточным для обнаружения. При этом происходит копирование только того участка ДНК, который заранее запрограммирован и если он присутствует в исследуемом образце. Этот процесс называется амплификацией. Метод ПЦР стал для ряда инфекций «золотым стандартом» диагностики. Такой анализ позволяет определить наличие возбудителя заболевания, даже если в мазке или другом биоматериале присутствует всего несколько молекул ДНК вируса.
В основе метода ПЦР лежит многократное удвоение определенного участка ДНК при помощи ферментов в искусственных условиях (in vitro). В результате нарабатывается такое количество ДНК, которое является достаточным для обнаружения. При этом происходит копирование только того участка ДНК, который заранее запрограммирован и если он присутствует в исследуемом образце. Этот процесс называется амплификацией. Метод ПЦР стал для ряда инфекций «золотым стандартом» диагностики. Такой анализ позволяет определить наличие возбудителя заболевания, даже если в мазке или другом биоматериале присутствует всего несколько молекул ДНК вируса.
Методом ПЦР можно диагностировать:
- внутриклеточных паразитов (малярия, лейшманиозы, токсоплазмозы), диагностировать кишечные протозоозы, например, бластоцистоз, лямблиоз, криптоспоридиоз, дизентерийный амебиаза, протозойные инфекции: аскаридоз, описторхоз, трихинеллез, дифиллоботриоз и др.;
- трудно культивируемые, некультивируемые и скрыто существующие формы микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях;
- возбудителей с высокой антигенной изменчивостью;
- внутриклеточных паразитов.

Чаще всего ПЦР метод применяется при диагностике:
- листериоза;
- цитомегаловирусной инфекции;
- туберкулеза;
- кандидоза;
- гепатитов;
- мононуклеоза;
- различных половых инфекций;
- вируса иммунодефицита человека;
- вируса гриппа;
- коронавирусной инфекции COVID-19;
- герпеса;
- вируса папилломы человека;
- клещевого энцефалита и др.
Преимущества метода ПЦР
В случае, если ДНК инфекции в биоматериале не обнаружена – инфицирование маловероятно.
Для ПЦР-диагностики заболеваний на анализ берут разные виды биоматериала. Выбор зависит от типа инфекции.
ПЦР проводят в амплификаторе – приборе, который обеспечивает попеременное охлаждение и нагревание пробирок, обычно с точностью не менее 0,1 градуса C. Чтобы избежать испарения смеси для проведения реакции, в пробирку добавляют высококипящее масло, например, вазелиновое.
ПЦР дает возможность существенно ускорить и облегчить исследование генетических и вирусных заболеваний, проведение скрининга. Вирусные инфекции можно обнаруживать сразу после заражения, за недели или месяцы (в зависимости от величины инкубационного периода) до того, как проявятся симптомы заболевания.
Результаты ПЦР-теста дают точную информацию, возбудитель какой инфекции был обнаружен в мазке или другом исследуемом материале и его количество, что очень важно для оценки проводимого лечения и при диагностике заболеваний.
- Высокая специфичность. Метод ПЦР определяет заданную последовательность нуклеотидов, присущую конкретному патогену. Таким образом специфичность теста стремится к 100%. Исключен риск ложноположительных результатов анализа.
- Чувствительность. Для ПЦР достаточно всего несколько молекул ДНК патогена (даже разрушенных вирусных частиц в биоматериале, сохранивших специфические участки ДНК в достаточном количестве), чтобы он был обнаружен в ходе исследования.
- Скорость проведения. Лаборатория получает результат ПЦР-теста через несколько часов, пациент – уже на следующий день. Скорость диагностики имеет принципиально важное значение для скрининга и своевременного лечения.
- Универсальность. Для исследования подходит любой биоматериал: кровь, моча, сперма, гной, мокрота и пр.
- Диагностика латентных инфекций. ПЦР- диагностика определяет возбудителя инфекции даже в инкубационном периоде и при скрытом течении заболевания, или когда из-за низкого иммунного ответа не удается найти антитела в крови.
Эффективность анализа полимеразной цепной реакции амниотической жидкости беременных женщин для диагностики врожденного токсоплазмоза: систематический обзор и метаанализ
1. Hill D, Dubey J. Toxoplasma gondii: передача, диагностика и профилактика. Клин Микробиол Инфект. 2002 г.; 8: 634–640. [PubMed] [Google Scholar]
2. Ремингтон Дж. С., редактор. Инфекционные болезни плода и новорожденного. 6-е изд.
С., редактор. Инфекционные болезни плода и новорожденного. 6-е изд.
Филадельфия: Эльзевир Сондерс; 2006. [Google Scholar]
3. Авелино М.М., Кампос Д. Джуниор, Парада Х.Б. де, Кастро А.М. де. Факторы риска заражения Toxoplasma gondii у женщин детородного возраста. Braz J Infect Dis. 2004; 8: 164–174. [PubMed] [Google Scholar]
4. Wallon M, Franck J, Thulliez P, Huissoud C, Peyron F, Garcia-Meric P, et al.
Точность полимеразной цепной реакции в реальном времени на токсоплазму гондии в амниотической жидкости: Obstet Gynecol. 2010; 115: 727–733. 10.1097/АОГ.0b013e3181d57b09
[PubMed] [CrossRef] [Google Scholar]
5. Bastien P. Молекулярная диагностика токсоплазмоза. Trans R Soc Trop Med Hyg. 2002 г.; 96: С205–С215. 10.1016/С0035-9203(02)
-7
[PubMed] [CrossRef] [Google Scholar]
6. Kieffer F, Wallon M. Врожденный токсоплазмоз. Handb Clin Neurol. 2013; 112: 1099–1101. 10.1016/В978-0-444-52910-7.00028-3
[PubMed] [CrossRef] [Google Scholar]
7. Sterkers Y, Varlet-Marie E, Marty P, Bastien P. Разнообразие и эволюция методов и практик молекулярной диагностики врожденного токсоплазмоза во Франции: 4-летний обзор . Клин Микробиол Инфект. 2010; 16: 1594–1602. 10.1111/j.1469-0691.2009.03101.х
Разнообразие и эволюция методов и практик молекулярной диагностики врожденного токсоплазмоза во Франции: 4-летний обзор . Клин Микробиол Инфект. 2010; 16: 1594–1602. 10.1111/j.1469-0691.2009.03101.х
[PubMed] [CrossRef] [Google Scholar]
8. Lopes-Mori FMR, Mitsuka-Breganó R, Capobiango JD, Inoue IT, Reiche EMV, Morimoto HK, et al.
Программы борьбы с врожденным токсоплазмозом. Rev Assoc Médica Bras. 2011; 57: 594–599. [PubMed] [Google Scholar]
9. McLeod R, Kieffer F, Sautter M, Hosten T, Pelloux H. Зачем предотвращать, диагностировать и лечить врожденный токсоплазмоз?
Мем Инст Освальдо Круз. 2009; 104: 320–344. [Бесплатная статья PMC] [PubMed] [Google Scholar]
10. Wallon M, Peyron F, Cornu C, Vinault S, Abrahamowicz M, Kopp CB, et al.
Врожденная токсоплазменная инфекция: ежемесячный пренатальный скрининг снижает скорость передачи инфекции и улучшает клинический исход в возрасте 3 лет. Clin Infect Dis Off Publ Infect Dis Soc Am. 2013; 56: 1223–1231. 10.1093/cid/cit032 [PubMed] [CrossRef] [Google Scholar]
11. Перес П., Рудин С., Гилберт Р., Петерсен Э. Выполнение тестов, используемых для скрининга и диагностики острого материнского токсоплазмоза во время беременности и врожденной инфекции Систематический обзор, 1985–2005. 2006 г.; [Google Scholar]
Перес П., Рудин С., Гилберт Р., Петерсен Э. Выполнение тестов, используемых для скрининга и диагностики острого материнского токсоплазмоза во время беременности и врожденной инфекции Систематический обзор, 1985–2005. 2006 г.; [Google Scholar]
12. Дюпуи-Каме Дж., Буну М., Лавареда де С.С., Туллиез П., Доммерг М., Мандельброт Л. и др.
Сравнительная ценность полимеразной цепной реакции и традиционных биологических тестов для пренатальной диагностики врожденного токсоплазмоза. 1991. С. 315–319. [PubMed] [Google Scholar]
13. Foulon W, Pinon J-M, Stray-Pedersen B, Pollak A, Lappalainen M, Decoster A, et al.
Пренатальная диагностика врожденного токсоплазмоза: многоцентровая оценка различных диагностических параметров. Am J Obstet Gynecol. 1999;181: 843–847. [PubMed] [Google Scholar]
14. Kompalic-Cristo A, Nogueira SA, Guedes AL, Frota C, Gonzalez LF, Brandão A, et al.
Отсутствие технической специфичности в молекулярной диагностике токсоплазмоза. Trans R Soc Trop Med Hyg. 2004; 98: 92–95. [PubMed] [Google Scholar]
2004; 98: 92–95. [PubMed] [Google Scholar]
15. Burg JL, Grover CM, Pouletty P, Boothroyd J. Прямое и чувствительное обнаружение патогенного простейшего Toxoplasma gondii с помощью полимеразной цепной реакции. Дж. Клин Микробиол. 1989; 27: 1787–1792. [Бесплатная статья PMC] [PubMed] [Google Scholar]
16. Bastien P, Procop GW, Reischl U. Количественная ПЦР в реальном времени не более чувствительна, чем «обычная» ПЦР. Дж. Клин Микробиол. 2008; 46: 1897–1900. 10.1128/JCM.02258-07
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
17. Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al.
QUADAS-2: пересмотренный инструмент для оценки качества исследований диагностической точности. Энн Интерн Мед. 2011; 155: 529–536. 10.7326/0003-4819-155-8-201110180-00009
[PubMed] [CrossRef] [Академия Google]
18. [R] Цитирование в литературе [Интернет]. [По состоянию на 16 сентября 2015 г.]. Доступно: https://stat.ethz.ch/pipermail/r-help/2008-May/161481.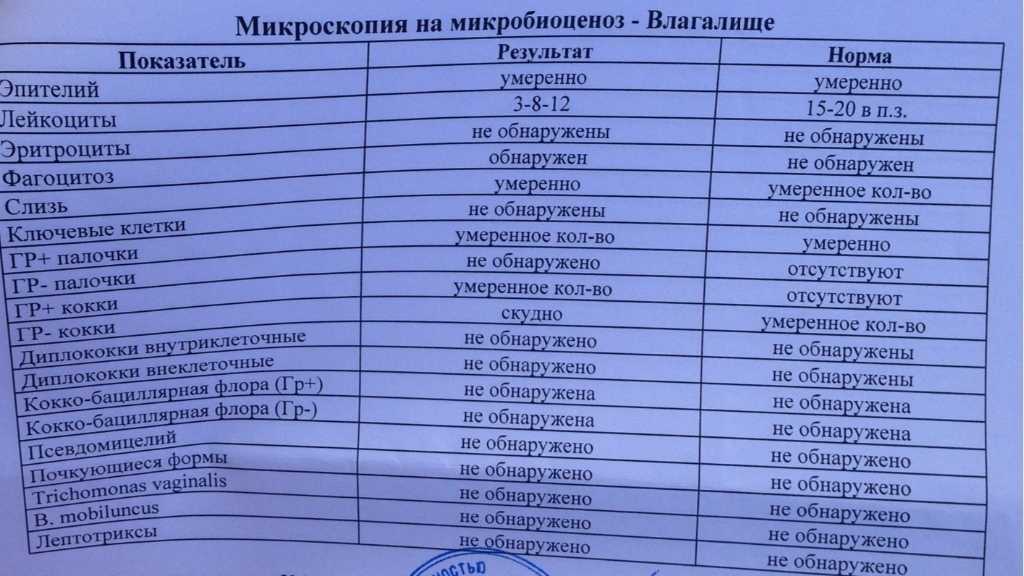 html
html
19. Cazenave J, Forestier F, Bessieres MH, Broussin B, Begueret J. Вклад нового метода ПЦР Пренатальная диагностика врожденного токсоплазмоза. Пренат Диагн. 1992 год; 12: 119–127. [PubMed] [Google Scholar]
20. Jenum P, HOLBERG-PETERSEN M, Melby K, STRAY-PEDERSEN B. Диагностика врожденной инфекции Toxoplasma gondii с помощью полимеразной цепной реакции (ПЦР) на образцах амниотической жидкости. Апмис. 1998; 106: 680–686. [PubMed] [Google Scholar]
21. Robert-Gangneux F, Gavinet M-F, Ancelle T, Raymond J, Tourte-Schaefer C, Dupouy-Camet J. Значение пренатальной диагностики и ранней постнатальной диагностики врожденного токсоплазмоза: ретроспективное исследование 110 дел. Дж. Клин Микробиол. 1999; 37: 2893–2898. [Бесплатная статья PMC] [PubMed] [Google Scholar]
22. Романд С., Валлон М., Франк Дж., Туллиез П., Пейрон Ф., Дюмон Х. Пренатальная диагностика врожденного токсоплазмоза с использованием полимеразной цепной реакции на амниотической жидкости. Акушерство Гинекол.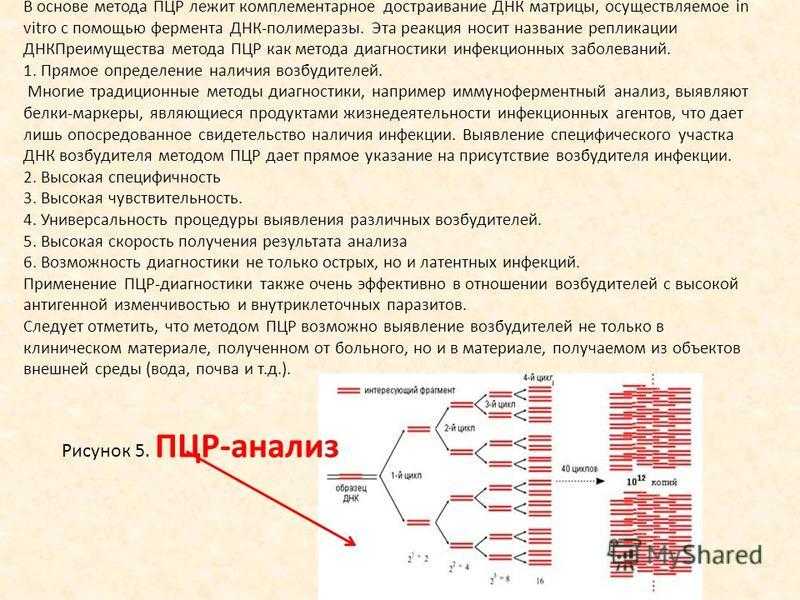 2001;97: 296–300. [PubMed] [Google Scholar]
2001;97: 296–300. [PubMed] [Google Scholar]
23. Castro FC, Castro MJBV, Cabral ACV, Brasileiro Filho G, Vitor RW de A, Lana AMA и др.
Сравнение методов диагностики врожденного токсоплазмоза. Rev Bras Ginecol E Obstetricia. 2001; 23: 277–282. [Google Scholar]
24. Andrade GMQ de, Carvalho AL, Carvalho IR, Tibúrcio FR, Castro FC. Toxoplasmose na gestante e no recém-nascido estudo de 86 pares de mãe-filho atendidos no period de 1996–99 no Ambulatorio de Infectologia Pediátrica do HC-UFMG. Преподобный Мед Минас-Жерайс. 2001; 11: 202–207. [Академия Google]
25. Антсаклис А., Даскалакис Г., Папантониу Н., Ментис А., Михалас С. Пренатальная диагностика врожденного токсоплазмоза. Пренат Диагн. 2002 г.; 22: 1107–1111. [PubMed] [Google Scholar]
26. Bessieres M, Cassaing S, Berrebi A, Seguela J. Значение теста полимеразной цепной реакции на амниотической жидкости для пренатальной диагностики врожденного токсоплазмоза. Иммуноанал Биол Спец. 2002; 17: 358–362. [Google Scholar]
27. Vidigal PVT, Santos DVV, Castro FC, Couto JC de F, Vitor RW de A, Brasileiro Filho G. Пренатальная диагностика токсоплазмоза по амниотической жидкости методом ПЦР. Rev Soc Bras Med Trop. 2002 г.; 35: 1–6. [PubMed] [Академия Google]
Vidigal PVT, Santos DVV, Castro FC, Couto JC de F, Vitor RW de A, Brasileiro Filho G. Пренатальная диагностика токсоплазмоза по амниотической жидкости методом ПЦР. Rev Soc Bras Med Trop. 2002 г.; 35: 1–6. [PubMed] [Академия Google]
28. Thalib L, Gras L, Romand S, Prusa A, Bessieres M, Petersen E, et al.
Прогнозирование врожденного токсоплазмоза методом полимеразно-цепной реакции амниотической жидкости. BJOG Int J Obstet Gynaecol. 2005; 112: 567–574. [PubMed] [Google Scholar]
29. Figueiró-Filho EA, Lopes AHA, Senefonte FR de A, Souza VG de Júnior, Botelho CA, Figueiredo MS, et al.
Острый токсоплазмоз: изучение частоты, скорости вертикальной передачи и взаимосвязи между диагностическими тестами матери и плода во время беременности в центрально-западном штате Бразилии. Rev Bras Ginecol E Obstetricia. 2005; 27: 442–449.. [Google Scholar]
30. Bessieres M, Berrebi A, Cassaing S, Fillaux J, Cambus J, Berry A, et al.
Диагностика врожденного токсоплазмоза: пренатальная и неонатальная оценка методов, используемых в Университетской больнице Тулузы, и заболеваемость врожденным токсоплазмозом. Мем Инст Освальдо Круз. 2009; 104: 389–392. [PubMed] [Google Scholar]
Мем Инст Освальдо Круз. 2009; 104: 389–392. [PubMed] [Google Scholar]
31. Rabilloud M, Wallon M, Peyron F. Диагноз врожденного токсоплазмоза внутриутробно и при рождении: использование отношения правдоподобия для клинического ведения. Pediatr Infect Dis J. 2010; 29: 421–425. 10.1097/INF.0b013e3181c80493
[PubMed] [CrossRef] [Google Scholar]
32. Sterkers Y, Pratlong F, Albaba S, Loubersac J, Picot M-C, Pretet V, et al.
Новая интерпретация молекулярной диагностики врожденного токсоплазмоза в зависимости от гестационного возраста на момент инфицирования матери. Дж. Клин Микробиол. 2012; 50: 3944–3951. 10.1128/JCM.00918-12
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
33. Teixeira LE, Kanunfre KA, Shimokawa PT, Targa LS, Rodrigues JC, Domingues W, et al.
Эффективность четырех молекулярных методов лабораторной диагностики врожденного токсоплазмоза в образцах амниотической жидкости. Rev Soc Bras Med Trop. 2013; 46: 584–588. [PubMed] [Академия Google]
34. Prusa A-R, Kasper DC, Pollak A, Olischar M, Gleiss A, Hayde M. Амниоцентез для выявления врожденного токсоплазмоза: результаты общенациональной австрийской программы пренатального скрининга. Clin Microbiol Infect Off Publ Eur Soc Clin Microbiol Infect Dis. 2015;21: 191e1–8. 10.1016/j.cmi.2014.09.018 [PubMed] [CrossRef] [Google Scholar]
Prusa A-R, Kasper DC, Pollak A, Olischar M, Gleiss A, Hayde M. Амниоцентез для выявления врожденного токсоплазмоза: результаты общенациональной австрийской программы пренатального скрининга. Clin Microbiol Infect Off Publ Eur Soc Clin Microbiol Infect Dis. 2015;21: 191e1–8. 10.1016/j.cmi.2014.09.018 [PubMed] [CrossRef] [Google Scholar]
35. Ordinaire I, Simon A, Fréalle E, Soula F, Valat A, Rouland V, et al. [Количественная ПЦР в реальном времени для диагностики токсоплазмоза]. 2004. С. 67–73. [PubMed] [Академия Google]
36. Бакеро-Артигао Ф., дель Кастильо Мартин Ф., Фуэнтес Коррипио И., Гонсе Меллгрен А., Фортуни Гуаш С., де ла Калле Фернандес-Миранда М. и другие. [Руководящие принципы Испанского общества детских инфекционных болезней по диагностике и лечению врожденного токсоплазмоза]. An Pediatría Barc Испания 2003. 2013; 79: 116.е1–116.е16. 10.1016/j.anpedi.2012.12.001 [PubMed] [CrossRef] [Google Scholar]
37. Foulon W, Villena I, Stray-Pedersen B, Decoster A, Lappalainen M, Pinon J-M, et al.
Лечение токсоплазмоза во время беременности: многоцентровое исследование влияния на передачу плода и последствия у детей в возрасте 1 года. Am J Obstet Gynecol. 1999; 180: 410–415. [PubMed] [Google Scholar]
38. Kieffer F, Wallon M, Garcia P, Thulliez P, Peyron F, Franck J. Факторы риска ретинохориоидита в течение первых 2 лет жизни у детей с леченным врожденным токсоплазмозом. Pediatr Infect Dis J. 2008; 27: 27–32. [PubMed] [Google Scholar]
39. Авелино М.М., Амарал В.Н., Родригес И.М., Расси А.Р., Гомес М.Б., Коста Т.Л. и соавт.
Государственные программы врожденного токсоплазмоза и дородовой помощи. BMC Infect Dis. 2014;14:33
10.1186/1471-2334-14-33
[Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
40. Исследовательская группа SYROCOT (Систематический обзор врожденного токсоплазмоза). Эффективность пренатального лечения врожденного токсоплазмоза: метаанализ данных отдельных пациентов. Ланцет. 2007; 369: 115–122. [PubMed] [Google Scholar]
41. Bossuyt PM, Reitsma JB, Bruns DE, Gatsonis CA, Glasziou PP, Irwig LM, et al.
Bossuyt PM, Reitsma JB, Bruns DE, Gatsonis CA, Glasziou PP, Irwig LM, et al.
Заявление STARD для отчетов об исследованиях диагностической точности: объяснение и разработка. Энн Интерн Мед. 2003; 138: W1–12. [PubMed] [Академия Google]
42. Исследовательская группа SYROCOT (Систематический обзор врожденного токсоплазмоза). Эффективность пренатального лечения врожденного токсоплазмоза: метаанализ данных отдельных пациентов. Ланцет. 2007; 369: 115–122. [PubMed] [Google Scholar]
43. Paquet C, Yudin MH, Общество акушеров и гинекологов Канады. Токсоплазмоз беременных: профилактика, скрининг и лечение. J Акушерство и гинекология Can JOGC J Акушерство и гинекология Can JOGC. 2013; 35: 78–81. [PubMed] [Академия Google]
44. Tomasoni LR, Meroni V, Bonfanti C, Bollani L, Lanzarini P, Frusca T, et al.
Мультидисциплинарный подход к врожденной токсоплазменной инфекции: общенациональное исследование в Италии. Новый микробиол. 2014; 37: 347–354. [PubMed] [Google Scholar]
45. Cao Y, Qiu L, Zhang Q. [Исследование взаимосвязи между историей аномальной беременности и TORCH-инфекцией у беременной женщины]. Чжунхуа Фу Чан Кэ За Чжи. 1999; 34: 517–520. [PubMed] [Google Scholar]
Cao Y, Qiu L, Zhang Q. [Исследование взаимосвязи между историей аномальной беременности и TORCH-инфекцией у беременной женщины]. Чжунхуа Фу Чан Кэ За Чжи. 1999; 34: 517–520. [PubMed] [Google Scholar]
46. Чермакова З., Плишкова Л., Прасил П., Рыскова О. Метод полимеразной цепной реакции в диагностике токсоплазмоза. Acta Medica Hradec Kralove Suppl Univ Carol Fac Medica Hradec Kralove. 2003; 47: 71–73. [PubMed] [Академия Google]
47. Czuba B, Pendzich J, Gola J, Mazurek U, Sławska H, Kamiński K, et al. Пренатальная диагностика инвазии Toxoplasma gondii количественным методом ПЦР-TaqMann. Виад Паразитол. 2000; 47: 91–97. [PubMed] [Google Scholar]
48. Geerts I, Ranst MV, Lagrou K. Пренатальная диагностика врожденного токсоплазмоза: rol van PCR op amnionvocht. Tijdschr Voor Geneeskd. 2008;64: 920. [Google Scholar]
49. Gołab E, Nowakowska D, Waloch M, Dzbeński T, Szaflik K, Wilczyński J. [Выявление врожденного токсоплазмоза in utero с помощью полимеразной цепной реакции на амниотической жидкости]. Виад Паразитол. 2001; 48: 311–315. [PubMed] [Академия Google]
Виад Паразитол. 2001; 48: 311–315. [PubMed] [Академия Google]
50. Гола Дж., Чуба Б., Мазурек У., Славска Х., Каминский К., Вильчок Т. [Полезность количественной оценки генома Toxoplasma gondii с использованием ПЦР-TaqMan в амниотической жидкости, материнской и неонатальной крови при отдельных осложнениях беременности]. Гинекол пол. 2000; 71: 954–958. [PubMed] [Google Scholar]
51. Gołab E. [Использование полимеразной цепной реакции (ПЦР) для диагностики токсоплазмоза]. Med Dośw Mikrobiol. 1996; 48: 189–196. [PubMed] [Google Scholar]
52. Knerer B, Hayde M, Gratzl R, Strobl W, Pollak A, Gratz G. [Прямое обнаружение Toxoplasma gondii с помощью полимеразной цепной реакции в диагностике токсоплазменной инфекции плода]. Вена Клин Wochenschr. 1994;107: 137–140. [PubMed] [Google Scholar]
53. Li S, Ding Z, Liang Y. [Предварительное исследование по антенатальной диагностике и профилактике заражения токсоплазмозом плода]. Чжунхуа Фу Чан Кэ За Чжи. 1995; 30: 200–202.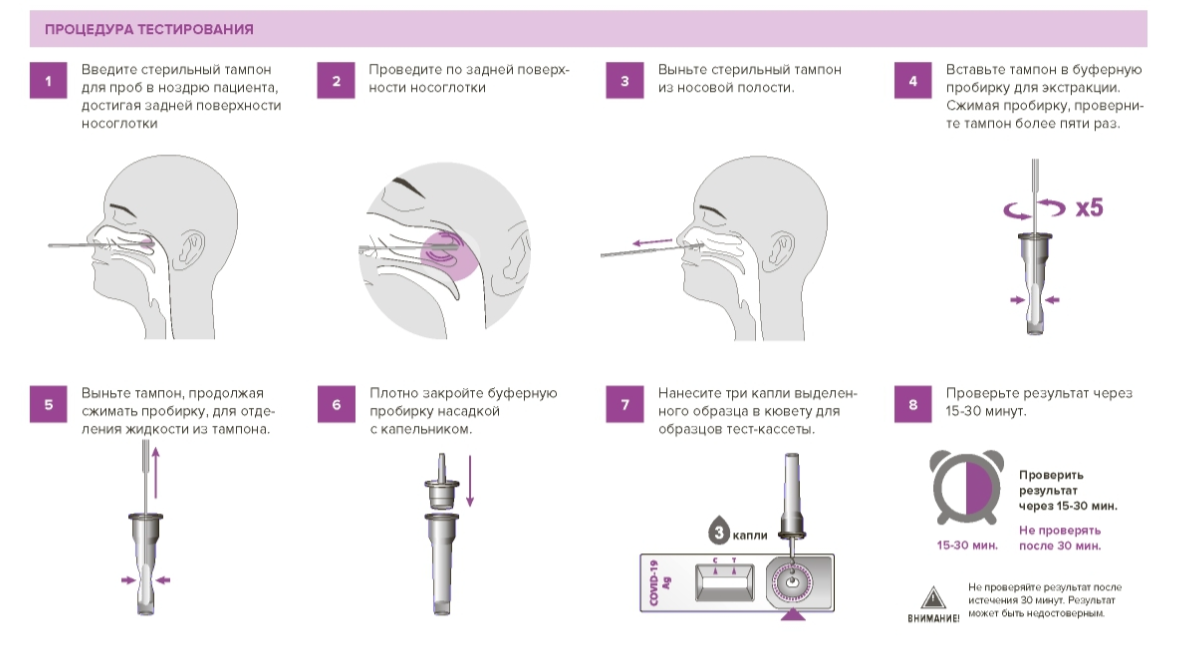 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
54. Ma Y, Mu R, Wang L, Jiang S. [Исследование пренатальной диагностики врожденного токсоплазмоза с использованием количественной полимеразной цепной реакции флуоресценции]. Чжунхуа Фу Чан Кэ За Чжи. 2003; 38: 8–10. [PubMed] [Google Scholar]
55. Nagy B, Bán Z, Beke A, Csaba Á, Joó JG, Váradi J, et al.
Выявление Toxoplasma gondii из околоплодных вод методами флуоресцентной ПЦР и анализа фрагментов ДНК. Маги Ноорвосок Лапья. 2005;68:95–100. [Google Scholar]
56. Sławska H, Pendzich J, Czuba B, Mazurek U, Gola J, Wilczok T, et al. Обнаружение ДНК Toxoplasma gondii методом ПЦР в крови матери, амниотической жидкости и крови ребенка в отдельных случаях патологической беременности. Виад Паразитол. 2000; 47: 99–105. [PubMed] [Google Scholar]
57. Szenborn L. [Значение диагностики и лечения в профилактике врожденных инфекций, вызванных Toxoplasma gondii (Tg), цитомегаловирусом (CMV) и парвовирусом B19 (PVB19)]. Пшегль Лек. 2009 г.;67: 54–57.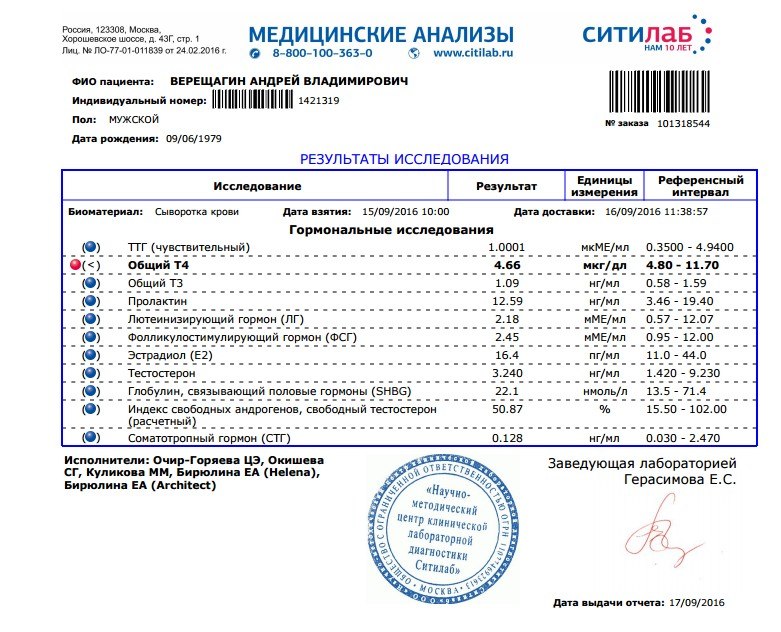 [PubMed] [Google Scholar]
[PubMed] [Google Scholar]
58. Tuma W, Weber E, Hassl A, Buenger G. Обнаружение нуклеиновой кислоты Toxoplasma gondii во время беременности. Лаборатория мед. 1994; 18: 512–512. [Google Scholar]
59. Xia A, Wang K, Dong T, Zhang H, Wu Z, Yang H, et al. Диагностика токсоплазмоза методом полимеразной цепной реакции. Чжунго Цзи Шэн Чун Сюэ Юй Цзи Шэн Чун Бин За Чжи. 1991; 10: 171–175. [PubMed] [Google Scholar]
60. Prasil P, Cermakova Z, Plisek S. Значение динамики данных серологической и ПЦР-диагностики для вероятности врожденного токсоплазмоза у детей, рожденных от токсоплазмозных серопозитивных матерей. Чешско-словацкий педиатр. 2010; 65: 432–440. [Академия Google]
61. Sławska H, Czuba B, Gola J, Mazurek U, Włoch A, Wilczok T, et al. Диагностические трудности инфекции Toxoplasma gondii у беременных. Можно ли объяснить сомнения полимеразной цепной реакцией? Гинекол пол. 2005; 76: 536–542. [PubMed] [Google Scholar]
62. Эйда О., Эйда М., Ахмед А. Оценка полимеразной цепной реакции на амниотической жидкости для диагностики врожденного токсоплазмоза. J Египет Soc Параситол. 2009; 39: 541–550. [PubMed] [Google Scholar]
Оценка полимеразной цепной реакции на амниотической жидкости для диагностики врожденного токсоплазмоза. J Египет Soc Параситол. 2009; 39: 541–550. [PubMed] [Google Scholar]
63. Фаверо А., Маркетти Д., Таска А., Гирарделли М. Лабораторная диагностика второго уровня токсоплазменной инфекции во время беременности. Diagn Lab Secondo Livello Infez Toxoplasmica Gravidanza. 1997;12: 459–64. [Google Scholar]
64. Nagaty I, Ibrahim K, Abdel-Tawab A, Hassan A. Диагностика Toxoplasma gondii с помощью ИФА и ПЦР у матерей и их детей. J Египет Soc Параситол. 2009; 39: 625–632. [PubMed] [Google Scholar]
Что такое ПЦР-тест и как он работает?
Тест полимеразной цепной реакции (ПЦР) позволяет обнаружить генетический материал из образца патогена или аномальной клетки. Способы сбора образцов включают мазок из носа, мазок слюны или взятие образца крови.
ПЦР-тестирование позволяет исследователям делать множество копий небольшого участка ДНК или РНК в процессе, который некоторые называют «молекулярным фотокопированием».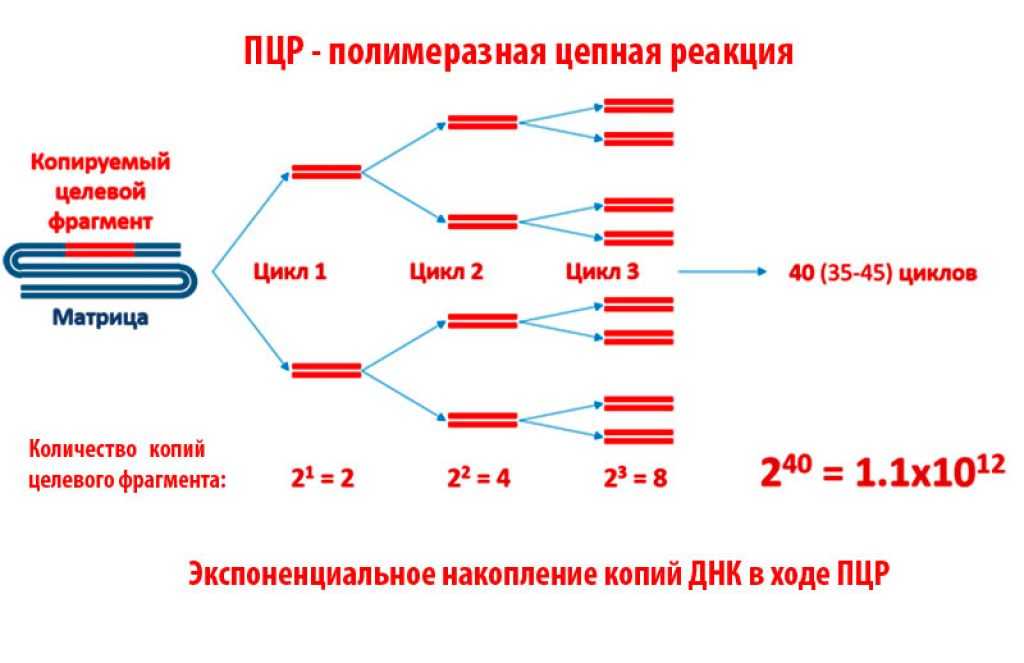
Этот метод имеет множество применений. Эксперты в области здравоохранения могут использовать ПЦР-тесты как быстрый и точный способ диагностики инфекционных заболеваний, выявления генетических изменений, которые могут вызывать заболевания, и выявления небольшого количества раковых клеток.
В этой статье мы более подробно рассмотрим, что такое тесты ПЦР, в том числе как они работают и как врачи интерпретируют результаты.
Поделиться на PinterestJulian Stratenschulte/picture Alliance через Getty Images
Американский биохимик доктор Кэри Маллис разработал метод ПЦР в 1983 году. Это быстрый и недорогой способ копирования небольших сегментов генетического материала.
Обычно для молекулярного и генетического тестирования необходимы большие количества ДНК, но метод ПЦР позволяет ученым создавать миллионы копий из очень небольшого количества ДНК.
ПЦР является распространенным методом в медицинских и биологических исследовательских лабораториях, и существует множество приложений.
Однако «тест ПЦР» обычно относится к быстрому и точному диагностическому тесту на ранние признаки инфекционного заболевания. Например, это один из способов тестирования на SARS-CoV-2, вирус, вызывающий COVID-19.
Из-за пандемии COVID-19 многие люди познакомились с термином «ПЦР-тест». Но этот метод имеет множество медицинских применений, помимо тестирования на COVID-19.
Эксперты в области здравоохранения также могут использовать тест ПЦР для обнаружения небольшого количества раковых клеток и генетических изменений, которые могут вызвать заболевание. ПЦР-тесты также могут обнаруживать другие патогены, вызывающие такие заболевания, как:
- грипп
- туберкулез
- ВИЧ
- Эбола
- гепатит С
ПЦР-тест амплифицирует последовательности ДНК. Он включает в себя праймеры ДНК, основания ДНК, ферменты, буферный раствор и термоциклирование, чтобы помочь воспроизвести эти последовательности.
Первый шаг — взять образец у человека, проходящего тест. Мы опишем допустимые типы образцов ниже.
Мы опишем допустимые типы образцов ниже.
Затем исследователь лаборатории использует специальную машину для нагрева образца. Это разделяет ДНК внутри на две части одноцепочечной ДНК. Затем реакционная смесь охлаждается, чтобы праймеры могли прикрепиться к последовательностям матричной ДНК. Затем он снова нагревается, чтобы позволить ферменту, известному как полимераза Taq, добавить основания ДНК к матрицам. Этот процесс дублирует исходный образец ДНК, создавая две нити.
Машина может автоматизировать весь этот процесс и повторять его столько раз, сколько необходимо для создания множества точных копий исходного сегмента ДНК.
В диагностическом тесте ПЦР машина может обнаружить присутствие патогена после репликации генетического материала. Однако некоторые вирусы, в том числе SARS-CoV-2, состоят из РНК, а не из ДНК. Для этих вирусов РНК подвергается процессу, называемому ПЦР с обратной транскрипцией (rtPCR). Это превращает РНК в ДНК перед ее копированием.
Время, необходимое для получения результатов теста ПЦР, может варьироваться от нескольких минут до нескольких дней. Анализатор на месте дает быстрые результаты. Получение результатов может занять больше времени, когда врачи отправляют образцы в стороннюю лабораторию из-за задержек обработки.
Анализатор на месте дает быстрые результаты. Получение результатов может занять больше времени, когда врачи отправляют образцы в стороннюю лабораторию из-за задержек обработки.
ПЦР-тесты надежно обнаруживают наличие SARS-CoV-2. Систематический обзор и метаанализ 2021 года показали, что тесты на этот вирус были точными в 97,2% случаев.
В зависимости от причины проведения ПЦР-теста положительный результат может свидетельствовать о наличии возбудителя, раковых клеток или генетических изменений. Отрицательный результат говорит об их отсутствии.
На примере COVID-19 положительный результат ПЦР указывает на то, что тест обнаружил в образце SARS-CoV-2. Это говорит о том, что у человека может развиться COVID-19. У некоторых людей вирусная инфекция протекает без развития симптомов заболевания.
Отрицательный результат теста указывает на отсутствие SARS-CoV-2 в образце. Однако ложноотрицательный результат может возникнуть, если в образце было недостаточно вирусного материала, чтобы тест мог его обнаружить.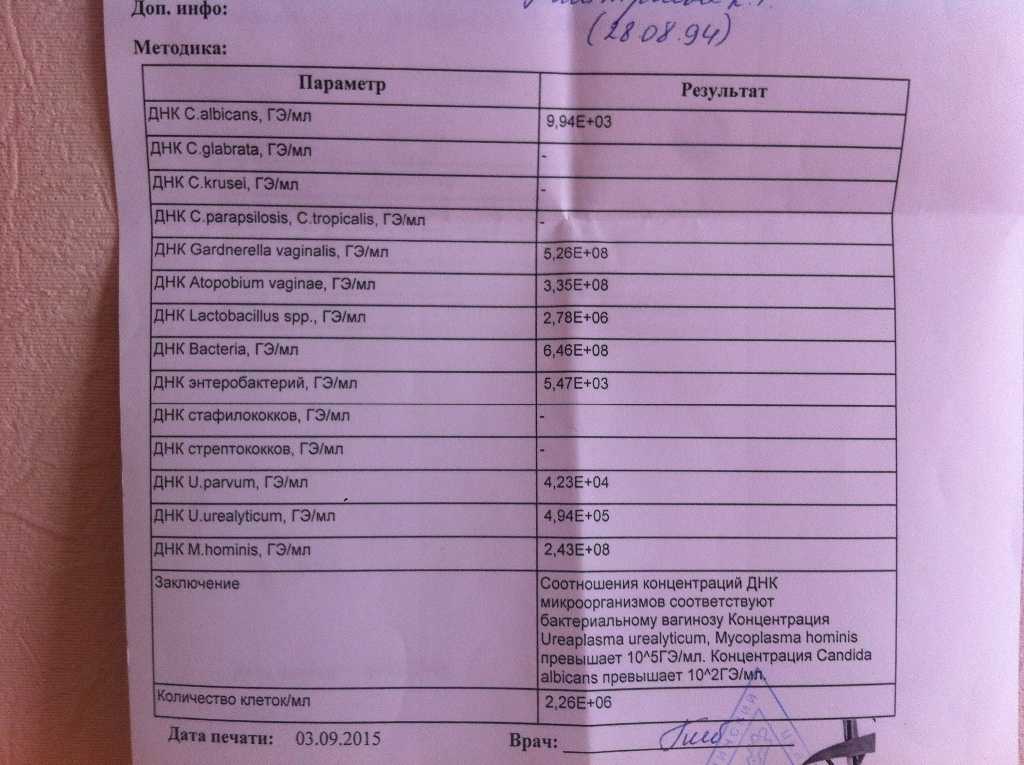 Это может произойти, если человек проходит тест слишком рано после контакта с вирусом.
Это может произойти, если человек проходит тест слишком рано после контакта с вирусом.
Типы ПЦР-тестов различаются в зависимости от используемого образца. К распространенным типам относятся:
- Мазок из носа: Включает мазок для взятия образца из задней части носа и горла.
- Мазок со средней носовой раковины: Часто называемый мазком NMT, он включает взятие образца из глубины ноздри.
- Слюна: Сдача этой пробы предполагает выплевывание слюны в пробирку.
- Кровь: Для некоторых типов ПЦР-тестов требуется образец крови, взятый из вены.
Сдача образца для ПЦР-теста обычно занимает всего несколько минут и не требует подготовки. Человеку может потребоваться заполнить форму, указав, например, свое имя и дату рождения.
Следующие шаги зависят от типа образца, который требуется для теста. Например, медицинскому работнику может потребоваться ввести длинный тампон в ноздрю человека, или человек может сделать это самостоятельно. Человек, берущий образец, вращает тампон в ноздре в течение 10–15 секунд, прежде чем вынуть его и сделать то же самое во второй ноздре.
Человек, берущий образец, вращает тампон в ноздре в течение 10–15 секунд, прежде чем вынуть его и сделать то же самое во второй ноздре.
ПЦР-тесты обычно представляют небольшой риск, если таковой имеется.
Побочные эффекты могут зависеть от типа пробы. Например, после сдачи крови могут появиться небольшие боли или кровоподтеки, но они, как правило, быстро проходят.
Мазок из носа, горла или того и другого может вызвать легкий кашель, дискомфорт и легкое рвотное ощущение. Они должны быть легкими и временными.
С помощью ПЦР можно проверить наличие патогена, например вируса, раковых клеток или генетических изменений.
Во время продолжающейся пандемии COVID-19 человек может пройти тест ПЦР, чтобы проверить наличие основного вируса SARS-CoV-2.
Текущие рекомендации предполагают, что человек должен пройти тест на SARS-CoV-2, если у него есть:
- симптомы COVID-19, даже после вакцинации
- был тесный контакт с человеком, у которого был положительный результат теста
- принимал участие в мероприятиях которые повышают риск развития инфекции
- вас попросили пройти обследование у медицинского работника или в отделе здравоохранения
Многие тесты позволяют выявить наличие патогенов, включая SARS-CoV-2.
