Лимфогранулематоз и беременность: МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VI РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
БЕРЕМЕННОСТЬ И РОДЫ У ЖЕНЩИН С ЛИМФОМОЙ ХОДЖКИНА
Г.С. Шмаков, Т.Д. Комова, Е.А. Демина
НЦ АГиП РАМН, Москва ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Заболеваемость лимфогранулематозом, по современной классификации — лимфома Ходжкина (ЛХ), в России составляет 2,3 на 100000. В отличие от других онкологических заболеваний, первый пик заболеваемости лимфомой Ходжкина приходится на возраст 25-35 лет, и среди этих больных преобладают женщины репродуктивного возраста. За вторую половину прошедшего века в лечении лимфомы Ходжкина были достигнуты большие успехи: если в 1940 г., по данным Graft C.B., 5 лет переживало лишь 5% больных, и надежды на выздоровление не мог предоставить ни один вид лечения, то к концу ХХ века возможность выздоровления и полноценной жизни у больных в ранних стадиях достигла 80%, а при распространенных стадиях — 40% [5].
Одним из показателей качества жизни женщин, перенесших лимфому Ходжкина, может служить возможность нормальной беременности и родов. Однако работ, посвященных проблеме беременности и родов у женщин с лимфомой Ходжкина как в Российской, так и в зарубежной литературе, немного, и все они основаны на ограниченном числе наблюдений, а многие работы носят лишь описательный характер [1, 4]. В обычной акушерской практике сочетание беременности и лимфомы Ходжкина встречается редко. Так, по данным Henry Ford Hospital [16], за 10 лет из 18000 беременных женщин с лимфомой Ходжкина было только 3, а по данным Palacios Costa с соавт. — лишь 5 женщин из 30000 беременных [15]. Вместе с тем, интерес к этой проблеме возрастает, так как с каждым годом увеличивается число излеченных от лимфомы Ходжкина женщин.
Проблема беременности и лимфомы Ходжкина имеет четыре основных аспекта:
- определение влияния беременности на течение лимфомы Ходжкина;
- выработка совместной тактики онколога и акушера, особенно если беременность сочетается с активным течением лимфомы Ходжкина и возникает необходимость специфического лечения женщины;
- определение рациональной врачебной тактики при беременности у излеченных больных;
- изучение патологии плода и здоровья ребенка при проводимом специфическом лечении лимфомы Ходжкина.

Долгое время считалось, что беременность отягощает течение лимфомы Ходжкина [3, 15, 16], однако работы конца 50-х гг. и последующих лет опровергли это мнение [6, 12, 14]. В Memorial Sloan-Kettering Hospital за период наблюдения с 1910 по 1960 гг. из 347 женщин с лимфомой Ходжкина в возрасте от 18 до 40 лет 84 женщины сохранили беременность. Медиана выживаемости оказалась одинаковой и составила 90 мес. как в группе беременных женщин, так и в контрольной группе, скорректированной по полу и возрасту [11]. Еще в начале 50-х гг. Stewart HL и Montoro RW [16] показали, что лимфома Ходжкина не влияет на акушерскую тактику у этих женщин во время беременности, родов и послеродовом периоде. Эти данные были впоследствии подтверждены М.М. Шехтманом, который также указал, что беременность и роды при лимфоме Ходжкина протекают нормально [7, 8].
По данным исследователей ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России беременность и роды у женщин, перенесших лимфогранулематоз и рожавших в полной ремиссии, не отягощают прогноза заболевания [2]. Сроки возникновения рецидивов в этой группе женщин также соответствуют срокам возникновения рецидивов в общей популяции больных. Частота рецидивов лимфогранулематоза у женщин, рожавших в полной ремиссии лимфомы Ходжкина, составляет 14%, что не превышает частоты рецидивов в общей популяции больных лимфогранулематозом. Количество рецидивов лимфогранулематоза после родов достоверно ниже (9%) в группе женщин, находившихся в полной ремиссии более 3-х лет, по сравнению с женщинами, у которых были более короткие сроки полной ремиссии (44%). Это распределение рецидивов соответствует и популяционной частоте рецидива: две трети рецидивов лимфомы Ходжкина возникают именно в первые 3 года после окончания лечения, и, что особенно важно, не зависит от наличия беременности [5]. Целесообразно лишь предупреждать женщин о большей вероятности рецидива в первые 3-5 лет после окончания лечения и нежелательности наступления беременности в эти сроки.
Сроки возникновения рецидивов в этой группе женщин также соответствуют срокам возникновения рецидивов в общей популяции больных. Частота рецидивов лимфогранулематоза у женщин, рожавших в полной ремиссии лимфомы Ходжкина, составляет 14%, что не превышает частоты рецидивов в общей популяции больных лимфогранулематозом. Количество рецидивов лимфогранулематоза после родов достоверно ниже (9%) в группе женщин, находившихся в полной ремиссии более 3-х лет, по сравнению с женщинами, у которых были более короткие сроки полной ремиссии (44%). Это распределение рецидивов соответствует и популяционной частоте рецидива: две трети рецидивов лимфомы Ходжкина возникают именно в первые 3 года после окончания лечения, и, что особенно важно, не зависит от наличия беременности [5]. Целесообразно лишь предупреждать женщин о большей вероятности рецидива в первые 3-5 лет после окончания лечения и нежелательности наступления беременности в эти сроки.
Следует отметить, что беременность и роды препятствуют полноценному обследованию при впервые диагностируемой лимфоме Ходжкина. При этом возникают две проблемы. Во-первых, беременность препятствует адекватному лечению и может осложнить течение самого заболевания. Во-вторых, нельзя не учитывать возможность мутагенного воздействия противоопухолевых препаратов и лучевой терапии, что часто заставляет акушеров прерывать беременность, особенно если лимфома Ходжкина диагностируется в первом триместре [10, 13, 17]. На поздних сроках беременности (III триместр) в случае отсутствия симптомов интоксикации, быстрого прогрессирования болезни и компрессионного синдрома, предпочтительна и возможна выжидательная тактика и донашивание беременности до сроков, близких к срокам родов [17]. Однако сразу после родов необходимо прерывать лактацию и начать лечение лимфомы Ходжкина.
При этом возникают две проблемы. Во-первых, беременность препятствует адекватному лечению и может осложнить течение самого заболевания. Во-вторых, нельзя не учитывать возможность мутагенного воздействия противоопухолевых препаратов и лучевой терапии, что часто заставляет акушеров прерывать беременность, особенно если лимфома Ходжкина диагностируется в первом триместре [10, 13, 17]. На поздних сроках беременности (III триместр) в случае отсутствия симптомов интоксикации, быстрого прогрессирования болезни и компрессионного синдрома, предпочтительна и возможна выжидательная тактика и донашивание беременности до сроков, близких к срокам родов [17]. Однако сразу после родов необходимо прерывать лактацию и начать лечение лимфомы Ходжкина.
Наиболее сложна и неоднозначна для принятия решения о тактике ведения больной ситуация, когда болезнь выявляется во втором триместре беременности. Если женщина настаивает на сохранении беременности, для адекватной терапии лимфомы Ходжкина следует выбирать химиопрепараты, не проникающие через плацентарный барьер (антрациклины, алкалоиды — винкристин, винбластин, производные пуриновых оснований — метотрексат) и прервать лечение за 3 недели до планируемых родов, чтобы избежать миелосупрессивного влияния лечения на кроветворную систему ребенка [13, 17].
Традиционные взгляды, согласно которым лечение женщин во время II и/или III триместров беременности может негативно сказаться на состоянии плода и ребенка, поддерживают целый ряд исследователей [15, 16]. Однако имеются работы, в частности Aviles с соавт [9], которые провели анализ здоровья и уровня развития 43 детей, матери которых были больны лимфомой Ходжкина и получали химиотерапию во время беременности. Различий по сравнению с контрольной группой детей не выявлено [9].
Цель исследования состояла в анализе исходов беременности и родов у женщин с лимфомой Ходжкина при современных подходах к лечению данного заболевания.
Течение беременности проанализировано у 41 женщины в возрасте от 19 до 39 лет, наблюдавшихся в НЦ АГиП РАМН с 1986 по 2002 гг. Из них у 34 женщин беременность наступила в период от 1 года до 16 лет с момента диагностирования лимфомы Ходжкина, а у 7 женщин лимфома Ходжкина была впервые диагностирована во время беременности.
Из 41 женщины у 7 беременность была прервана. По медицинским показаниям: у 3-х женщин в связи с началом заболевания во время данной беременности, у 2 — при обострении болезни, у 1 с коротким сроком ремиссии и еще у 1 — по желанию женщины. Следует особо подчеркнуть, что из 7 женщин, заболевание у которых было впервые выявлено во время данной беременности, у 3 беременность прервана по состоянию болезни, у 2 беременных в сроки после 16 недель проведена химиотерапия и лучевая терапия, и роды закончились при доношенной беременности; еще у 1 пациентки начало заболевания диагностировано в 30 недель беременности, и женщина родоразрешена по поводу преждевременной отслойки плаценты в 36 недель; 1 женщина отказалась от прерывания беременности, и роды произошли при доношенной беременности. Общие репродуктивные потери во время анализируемой беременности составили 16,8%. У 34 женщин беременность была пролонгирована и закончилась родами, из них 30 женщин рожали в полной ремиссии лимфомы Ходжкина, а 4 — на фоне заболевания и лечения.
Специфическое лечение по поводу лимфомы Ходжкина до родов получали 30 женщин. Из рожавших впоследствии женщин 13 (43,3%) девочек получали лечение по поводу лимфомы Ходжкина в возрасте от 5 до 14 лет, 3 (10%) пациентки — в возрасте с 15 до 17 лет. У 11 (36,7%) женщин лечение проведено в возрастном интервале от 18 до 25 лет, и 3 (10%) женщины были старше 25 лет. Спленэктомия произведена у 29 женщин, и у 6 из них выполнена фиксация яичников.
Из 13 девочек, заболевших до начала менструального цикла (до 14 лет), после специфического лечения дисфункция яичников различной длительности наблюдалась у каждой третьей девочки сроком от 6 месяцев до 3 лет, из них у одной — в течение 13 лет. Из 3-х девочек, заболевших в возрасте от 15 до 17 лет, дисфункция яичников отмечалась у 2 сроком до 2 лет. Из 11 взрослых женщин в возрасте 18-25 лет с лимфомой Ходжкина дисфункция яичников после лечения наблюдалась у 5 (45,4%), из них у 3 женщин аменорея была длительностью до 3 лет.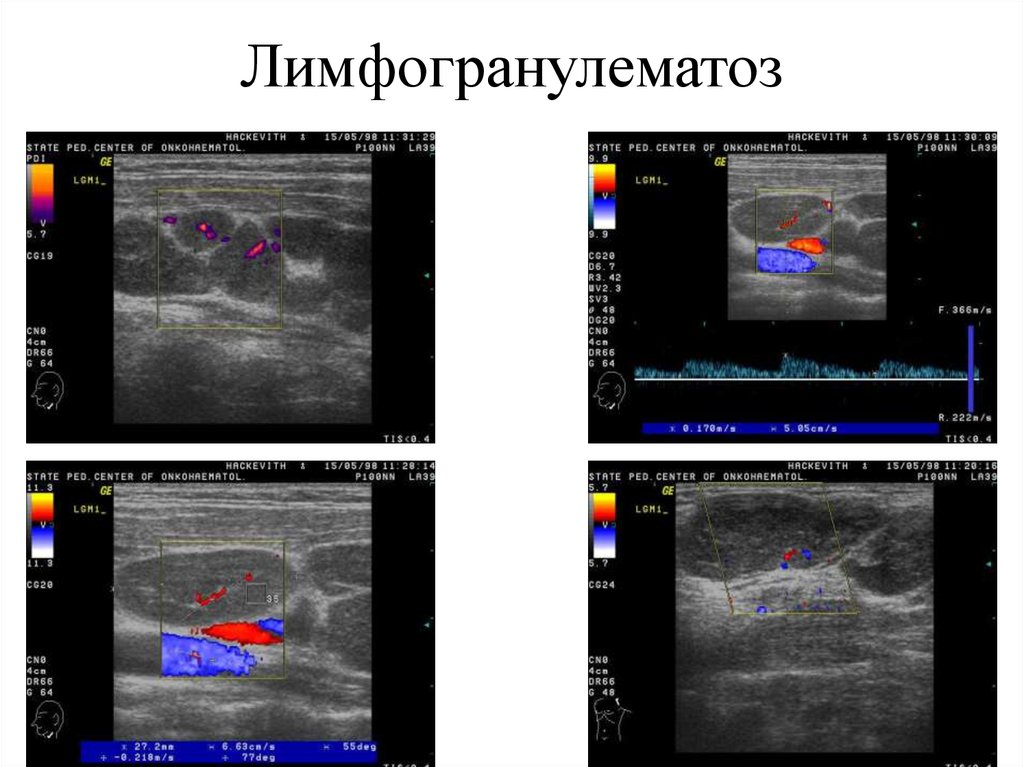 Из 3 женщин старше 25 лет у 2 наблюдалась дисфункция яичников. У 6 (42,8%) женщин старше 18 лет наблюдалось бесплодие длительностью от 4 до 8 лет.
Из 3 женщин старше 25 лет у 2 наблюдалась дисфункция яичников. У 6 (42,8%) женщин старше 18 лет наблюдалось бесплодие длительностью от 4 до 8 лет.
Из 34 беременных женщин, вошедших в группу наблюдения, первородящих было 27, повторнородящих — 7, из них у 4 женщин первая беременность закончилась абортами, у 2 — своевременными родами и у 1 — самопроизвольным выкидышем.
После лечения лимфомы Ходжкина в первые 2 года беременность наступила и была прервана у 8 из 30 (26,6%) впоследствии рожавших женщин: у 2 женщин произошел самопроизвольный выкидыш на ранних сроках беременности, у 1 — неразвивающаяся беременность, 3 женщины были направлены на прерывание беременности по медицинским показаниям, из них 1 — дважды, а другая — 4 раза. Еще две женщины после лечения до наступления настоящей беременности произвели 3 и 4 аборта.
Кроме того, из осложнений беременности наиболее часто наблюдались: водянка беременных — у 8 (22,8%) женщин, анемия беременных у 8(22,8%), пиелонефрит беременных у 7 (20%), гестоз — у 2 женщин, хроническая вирусная инфекция — у 3 беременных, истмико-цервикальная недостаточность отмечена у 1 беременной и у 3 — варикозное расширение вен ног.
По результатам функционального исследования (УЗИ, кардиотокография) было выявлено: гипотрофия плода — у 3 беременных, хроническая гипоксия плода — у одной. У 4 женщин наблюдалось одно из осложнений беременности, у 18 беременных отмечалось сочетание различных осложнений У 12 (35,3%) остальных женщин течение беременности было не осложненным.
Родоразрешение путем операции кесарева сечения было проведено у 9 женщин. Показаниями к операции у 5 женщин явились анатомические особенности строения таза, у 3 женщин — гипоксия плода, и только у одной преждевременное родоразрешение проведено в связи с необходимостью лечения лимфомы Ходжкина. Осложнений в послеоперационном периоде не было ни у одной родильницы. Средняя кровопотеря не отличалась от величины кровопотери здоровых женщин и составила 600,0±75,5 мл.
Роды через естественные родовые пути произошли у 25 женщин, причем только у 1 из них (4%) — осложнившиеся вторичной слабостью родовой деятельности. Средняя продолжительность родов не отличалась от здоровых женщин и составила у первородящих 7,5±0,7 часа, повторнородящих 5,5±0,4 часа. Послеродовой период протекал без осложнений у всех родильниц.
Средняя продолжительность родов не отличалась от здоровых женщин и составила у первородящих 7,5±0,7 часа, повторнородящих 5,5±0,4 часа. Послеродовой период протекал без осложнений у всех родильниц.
Родилось 37 детей, из числа родившихся детей мальчиков было 21, девочек 16, из них — три двойни. Недоношенным родился один новорожденный. Внутриутробная задержка плода, оцененная по перцентилям (при Р10 и менее), отмечена у 3 (7,85%), из них у 2 детей — из двойни. Морфофункциональная незрелость отмечена у 5 (13,1%) новорожденных, что было выше, чем в общей популяции. Уровень физического развития был в пределах нормы, различия между росто-весовыми показателями были закономерны. Средний вес мальчиков составил 3390,0±26,7г, рост 51,5±0,3см, девочек — 3150,0±53,7г, рост 50,5±0,3см., что было несколько ниже показателей физического развития детей, родившихся от здоровых матерей. Среди доношенных детей в состоянии гипоксии (оценка по шкале Апгар 6-7 баллов) родилось 4 (10,5%). Аномалии развития отмечены у 2 (5,2%) новорожденных: у одного — шестипалость, у другого — косолапость. Кожно-геморрагический синдром развился у 4 (10,5%) детей, незаращение овального окна — у 1 ребенка, кисты головного мозга диагностированы также у 1 ребенка. В связи с малым числом наблюдений трудно оценить достоверность частоты аномалий. Степень физиологического падения массы новорожденных в первые дни неонатального периода составила 6,4%. Все дети были выписаны домой.
Аномалии развития отмечены у 2 (5,2%) новорожденных: у одного — шестипалость, у другого — косолапость. Кожно-геморрагический синдром развился у 4 (10,5%) детей, незаращение овального окна — у 1 ребенка, кисты головного мозга диагностированы также у 1 ребенка. В связи с малым числом наблюдений трудно оценить достоверность частоты аномалий. Степень физиологического падения массы новорожденных в первые дни неонатального периода составила 6,4%. Все дети были выписаны домой.
Дальнейшее наблюдение за этими женщинами показало, что у 4 женщин в дальнейшем произошли вторые, а у одной — третьи роды.
Течение беременности у женщин, перенесших лимфому Ходжкина, было осложнено несколько чаще, чем в популяции, однако при своевременной коррекции осложнений беременность донашивается до сроков родов. На современном этапе требует пересмотра положение о необходимости прерывания беременности, если заболевание возникло во время беременности. Проведение адекватного лечения после того, как сформировался плод, позволяет получить полноценную ремиссию лимфомы Ходжкина у матери, не причиняя вреда ребенку. Физическое развитие новорожденных, рожденных женщинами, которые получали лечение по поводу лимфомы Ходжкина, их адаптация в первые дни неонатального периода не отличались от детей, рожденных здоровыми матерями.
Физическое развитие новорожденных, рожденных женщинами, которые получали лечение по поводу лимфомы Ходжкина, их адаптация в первые дни неонатального периода не отличались от детей, рожденных здоровыми матерями.
Список литературы:
1. Байсоголов Г.В., Шишкин И.П.// Мед. радиология, 1985, N 5, стр. 5-37.
2. Демина Е.А., Сусулева Н.А., Каверзнева М.М., Ильяшенко В.В., Червонобаб Ю.В. //Вестник ОНЦ АМН России, 1995, N1, стр.39-42.
3. Зонштейн И.Р // Акушерство и гинекология, 1958, №4, стр.46-49.
4. Корчмару И.Ф., Параскова Л.М.// Вопр. онкологии, 1982, N 7, стр. 34-38.
5. Клиническая онкогематология под ред. проф. Волковой М.А.// Медицина, 2001г., 314-335.
6. Перельштейн А.Э. // Акушерство и гинекология, 1958, №2, стр. 86-89.
7. Шехтман М.М., Соколова М.Ю.// Акушерство и гинекология, 1991, N 3, стр. 22-24.
8. Шехтман М.М. // Руководство по экстрагенитальной патологии у беременных, Москва ,1999.
9. Aviles A., Dias-Maquero J.C., Talavera A. et al // Am J Hematol 1991; 36: 243-248.
Aviles A., Dias-Maquero J.C., Talavera A. et al // Am J Hematol 1991; 36: 243-248.
10. Barnicl M.M.// Sem Oncol Nurs 1992; 8: 124-132.
11. Barry R.M., Diamond H.D., Carver L.F.// Am. J. Obstet. Gynecol. 1962; 84:445-454.
12. Bichel J.// Acta Radiol. 1950; 33: 427-434.
13. Cordon-Cardo C., O’Brien J.P., Casals D et al // Proc Natl Acad Sci USA 1989; 86: 695-698.
14. Hennessy J.P., Rottino A.// Am. J. Obstet. Gynecol. 1963; 87: 851-853.
15. Palacios Costa N., Chavanne F.C., Zebel Fernancdes D.// An de atenio. Buenos Aires, 1945:127.
16. Stewart H.L., Monto R.W.// Am. J. Obstet. Gynecol. 1952; 63:570-578.
17. Yahalom J. //Leuk Lymphoma 1990; 2:151-161.
Лимфома Ходжкина у беременных — причины, симптомы, диагностика и лечение
Лимфома Ходжкина у беременных — это злокачественное лимфопролиферативное заболевание с поражением B-лимфоцитов лимфатических узлов, лимфоидных структур и экстранодулярных тканей, перенесенное до гестации, возникшее или рецидивировавшее во время беременности. Проявляется увеличением лимфоузлов, беспричинной лихорадкой, ночной потливостью, снижением веса, слабостью, кожным зудом, признаками сдавления различных органов. Диагностируется с помощью МРТ, УЗИ, рентгенографии грудной клетки, биопсии лимфоидной ткани. Для лечения используют моно- или полихимиотерапию, дополненную облучением пораженных областей.
Проявляется увеличением лимфоузлов, беспричинной лихорадкой, ночной потливостью, снижением веса, слабостью, кожным зудом, признаками сдавления различных органов. Диагностируется с помощью МРТ, УЗИ, рентгенографии грудной клетки, биопсии лимфоидной ткани. Для лечения используют моно- или полихимиотерапию, дополненную облучением пораженных областей.
Общие сведения
В структуре злокачественных неоплазий, выявляемых у беременных, лимфома Ходжкина (лимфогранулематоз, злокачественная гранулема, болезнь Ходжкина) занимает четвертое место. Заболевание выявляется с частотой 1:1 000 — 1:6 000 беременностей и поражает преимущественно молодых женщин европеоидной расы в возрасте 20-29 лет. Применение современных методов лечения гемобластозов с достижением стойкой ремиссии или полного выздоровления привело к увеличению числа ситуаций, когда под наблюдение акушеров-гинекологов попадают пациентки, ранее перенесшие лимфогранулематоз. При этом риск рецидива лимфомы у беременных с полной ремиссией, длящейся более 3 лет, составляет 9%, а у больных, забеременевших менее чем через 3 года после окончания терапии, достигает 44%.
Лимфома Ходжкина у беременных
Причины
Этиология лимфогранулематоза окончательно не установлена. Большинство специалистов в сфере онкогематологии, акушерства и гинекологии не считают гестацию причиной или провоцирующим фактором возникновения либо рецидива болезни Ходжкина. Локальная трансформация B-клеток, характерная для злокачественной гранулемы, вероятно, может быть спровоцирована действием таких факторов, как:
- Инфицирование вирусами Эпштейна-Барр. В 40-70% случаев В-клеточная лимфома EBV-позитивна. Возбудитель является герпесвирусом 4-го типа (HHV4), тропен к B-лимфоцитам, в результате длительного латентного персистирования способен оказывать на иммунные клетки трансформирующий эффект с экспрессией мембранных белков и запуском механизмов апоптоза. Некоторые авторы в числе возбудителей, вызывающих онкотрансформацию B-клеток, также называют микобактерии туберкулеза, герпесвирусы 6-го типа, ВИЧ.
- Воздействие мутагенов.
 При EBV-негативных формах лимфомы не исключено влияние других неблагоприятных факторов внешней среды. Генные аберрации, способствующие малигнизации лимфоидной ткани, могут происходить под влиянием профессиональных вредностей (работа с производственными ядами), химио- и лучевой терапии, некоторых лекарственных средств (фенитоина и аналогов). Предположительно у ряда пациенток возможен генетически наследуемый дефект систем сдерживания опухолевой трансформации и роста.
При EBV-негативных формах лимфомы не исключено влияние других неблагоприятных факторов внешней среды. Генные аберрации, способствующие малигнизации лимфоидной ткани, могут происходить под влиянием профессиональных вредностей (работа с производственными ядами), химио- и лучевой терапии, некоторых лекарственных средств (фенитоина и аналогов). Предположительно у ряда пациенток возможен генетически наследуемый дефект систем сдерживания опухолевой трансформации и роста.
Вероятность возникновения В-клеточной лимфомы повышается при приеме иммунодепрессантов после трансплантации органов. В группу риска также входят беременные с врожденными нарушениями иммунитета (болезнью Вискотта-Олдрича) и аутоиммунными расстройствами (ревматоидным артритом, синдромом Шегрена, системной красной волчанкой, целиакией).
Патогенез
Механизм развития лимфомы Ходжкина у беременных аналогичен онкогенезу, происходящему вне гестационного периода. Под влиянием вирусов Эпштейна-Барр и других мутагенных факторов происходит ряд иммуногистохимических процессов, позволяющих перерожденным B-клеткам избегать апоптоза и цитолитического действия Т-киллеров, подавлять иммунную реакцию тканевого микроокружения на неоплазию.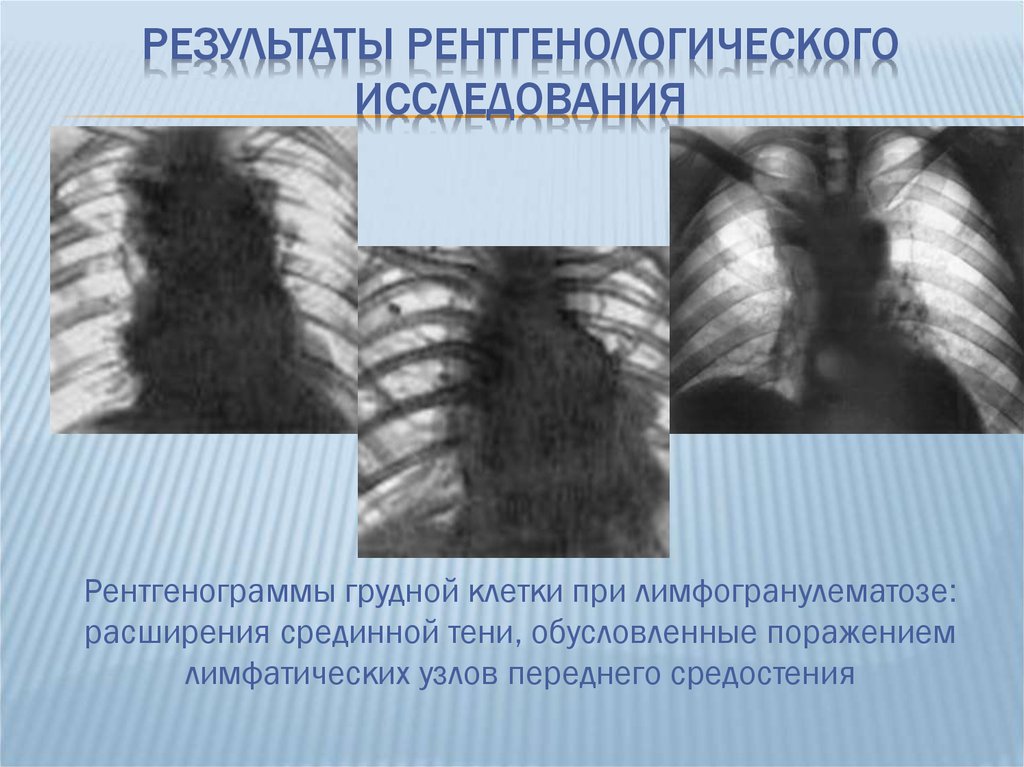 По мнению большинства онкогематологов, перерождению подвергаются герминативные лимфоидные B-клетки, которые происходят из зародышевого центра фолликула лимфатического узла.
По мнению большинства онкогематологов, перерождению подвергаются герминативные лимфоидные B-клетки, которые происходят из зародышевого центра фолликула лимфатического узла.
Патогенез болезни Ходжкина представлен сложными изменениями на уровне транскрипционных факторов, TNF-белков, хемокинов, цитокинов. Утрата регуляторных механизмов апоптоза приводит к неконтролируемому размножению перерожденных B-лимфоцитов — одноклеточных клеток-предшественников Ходжкина и гигантских многоядерных клеток Рид-Березовского-Штернберга. Раковая пролиферация сопровождается ухудшением гуморального иммунитета и реактивным ответом в виде разрастания соединительной ткани. У большинства беременных с лимфогранулематозом прогрессирует недостаточность T-клеточного иммунитета, что впоследствии приводит к развитию интеркуррентных бактериальных, вирусных, грибковых, протозойных инфекций, осложняющихся септическими состояниями.
Классификация
При систематизации вариантов лимфомы Ходжкина учитывают гистологические особенности неоплазии, стадию заболевания, выраженность интоксикационных явлений.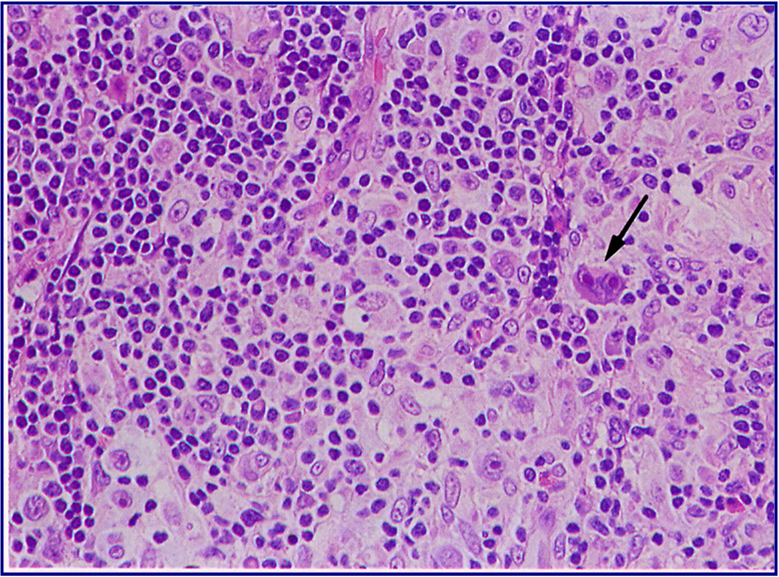 Такой подход позволяет наиболее точно прогнозировать течение злокачественной гранулемы и предложить женщине оптимальное решение с учетом возможной пролонгации беременности. Исход заболевания и гестации во многом зависит от типа опухоли. Онкологи различают:
Такой подход позволяет наиболее точно прогнозировать течение злокачественной гранулемы и предложить женщине оптимальное решение с учетом возможной пролонгации беременности. Исход заболевания и гестации во многом зависит от типа опухоли. Онкологи различают:
- Лимфогранулематоз с нодулярным склерозом. Определяется у 60,3% беременных со злокачественной гранулемой. Поражаются преимущественно лимфоузлы средостения, лимфоидная ткань делится на отдельные участки («узлы») фиброзными тяжами. Заболевание обычно имеет благоприятный прогноз. В препарате определяются классические многоядерные и лакунарные клетки.
- Смешанноклеточный вариант болезни Ходжкина. При беременности диагностируется у 32,8% заболевших пациенток, протекает менее благоприятно. Как правило, в процесс вовлечены несколько групп лимфоузлов в разных областях, выражена общеклиническая симптоматика. Гистологически проявляется полиморфизмом клеточных элементов.
- Лимфоидное истощение.
 Редкий неблагоприятный вариант лимфогранулематоза у беременных. Выявляется в 1,4% случаев. Характерна диссеминация онкоклеток с экстралимфатическими повреждениями и значительным угнетением иммунитета. В биоптате присутствуют пласты малигнизированных клеток и фиброзные тяжи, отсутствует нормальная лимфоидная ткань.
Редкий неблагоприятный вариант лимфогранулематоза у беременных. Выявляется в 1,4% случаев. Характерна диссеминация онкоклеток с экстралимфатическими повреждениями и значительным угнетением иммунитета. В биоптате присутствуют пласты малигнизированных клеток и фиброзные тяжи, отсутствует нормальная лимфоидная ткань.
Низкопрогредиентная и прогностически наиболее благоприятная лимфома с лимфоидным преобладанием (лимфогистиоцитарный вариант заболевания) и недифференцированные типы неоплазии при гестации возникают крайне редко. При разработке тактики сопровождения беременности акушеры-гинекологи обязательно учитывают стадию онкологического процесса. С учётом количества и локализации поражённых областей, структур (селезенки, вилочковой железы, лимфатического окологлоточного кольца, пейеровых бляшек, аппендикса), экстранодулярных тканей, выраженности клинических симптомов, размеров неоплазии различают 4 стадии болезни Ходжкина. В целом прогноз беременности ухудшается по мере прогрессирования заболевания.
Симптомы ЛХ у беременных
В большинстве случаев первым признаком лимфогранулематоза являются увеличенные безболезненные плотноэластичные лимфатические узлы, которые не спаяны с окружающими тканями и могут образовывать конгломераты. У 70-75% пациенток поражаются шейная и надключичная области, у 15-20% — подмышечная и средостение, у 10% — пах. Позднее всего выявляется поражение медиастинальных лимфоузлов, которые при значительном увеличении сдавливают бронхолегочную ткань, вызывая кашель и затруднение дыхания. Возможно возникновение генерализованного кожного зуда и транзиторной болезненности пораженных лимфоузлов после приема алкоголя.
У 20-30% беременных с ходжкинской лимфомой III-IV стадии выявляются системные общеинтоксикационные симптомы — беспричинное повышение температуры более 38° С, профузные ночные поты, снижение веса на 10% и более, ухудшение аппетита, слабость, что служит прогностически неблагоприятным признаком. У части пациенток отмечаются тяжесть и распирание в левом подреберье, свидетельствующие об увеличении селезенки.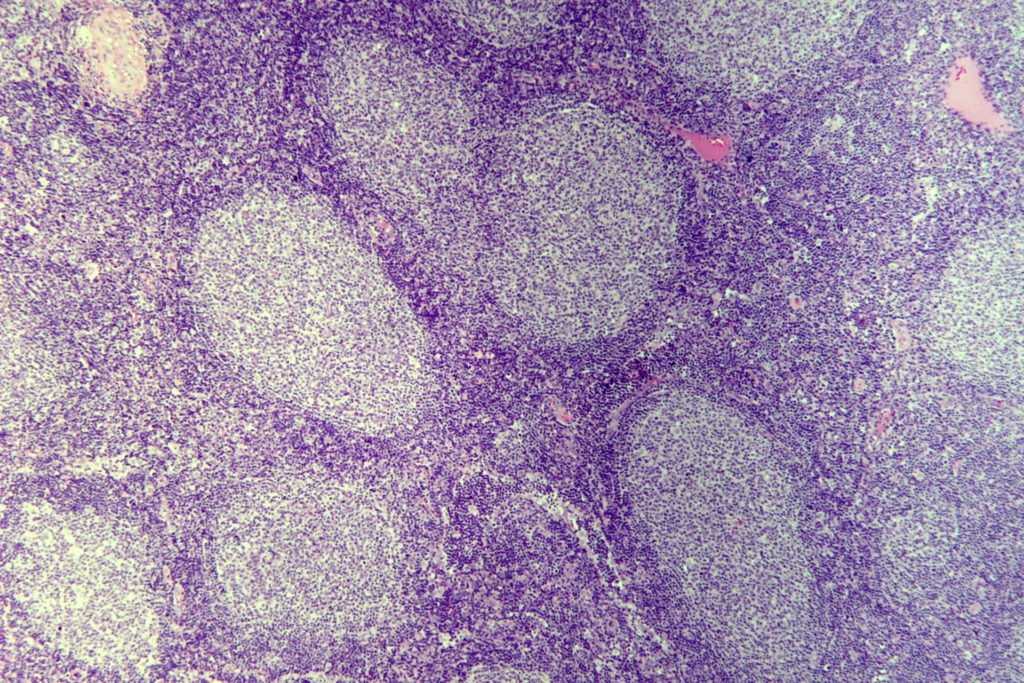 При вовлечении в процесс печени часто возникает желтуха, при сдавливании сосудов пораженными паховыми и тазовыми лимфоузлами отекают нижние конечности. У женщин с компрессией верхних дыхательных путей определяются хрипы и одышка. В редких случаях возникают невралгии, паралич верхних или нижних конечностей с утратой двигательной функции, нарушение глотания и речи.
При вовлечении в процесс печени часто возникает желтуха, при сдавливании сосудов пораженными паховыми и тазовыми лимфоузлами отекают нижние конечности. У женщин с компрессией верхних дыхательных путей определяются хрипы и одышка. В редких случаях возникают невралгии, паралич верхних или нижних конечностей с утратой двигательной функции, нарушение глотания и речи.
Осложнения
Осложненное течение беременности определяется у 64,7% женщин с лимфомой Ходжкина. Наиболее часто гестация осложняется вирусно-бактериальными инфекциями. У 19,6% беременных обостряется герпетическая инфекция, из них у 10,8% определяется генитальный герпес, у 9,8% часто возникают ОРВИ, у 8,8% наблюдается гестационный пиелонефрит или рецидивирует хронический пиелонефрит. У 18,6% пациенток выявляется анемия. Угроза прерывания беременности в одном или всех трех триместрах диагностируется у 30,4% заболевших, гестозы — почти у 20%. Частота развития фетоплацентарной недостаточности составляет 8,8%, задержки развития плода — 2,9%, у новорожденного возможны нейтропения и тромбоцитопения.
Медикаментозное и лучевое лечение лимфогранулематоза на протяжении первых 2 недель после зачатия провоцирует спонтанный выкидыш. В период органогенеза (на 2-8 неделях гестации) препараты с низкой молекулярной массой индуцируют врожденные аномалии развития, начиная с 3-го месяца гестационного срока – вызывают задержку роста плода. Частота тяжелых полиорганных пороков при проведении полихимиотерапии в 1 триместре беременности достигает 10-25%. Вероятность радиационно-индуцированных генетических дефектов увеличивается на 1% с каждым 1 Гр поглощенной дозы ионизирующего излучения. Экранирование брюшной полости позволяет уменьшить риск мутагенеза вдвое. У женщин после химиолучевой терапии частота последующих многоплодных беременностей достигает 12%, что в 10-20 раз выше по сравнению с общей популяцией.
Диагностика
При рецидиве лимфомы Ходжкина постановка диагноза не представляет особых трудностей. Однако даже в случае первичного заболевания, несмотря на ограниченное применение исследований с использованием ионизирующего излучения (компьютерной томографии, лимфангиографии), современные методы диагностики позволяют вовремя выявить лимфогранулематоз и корректно установить его стадию.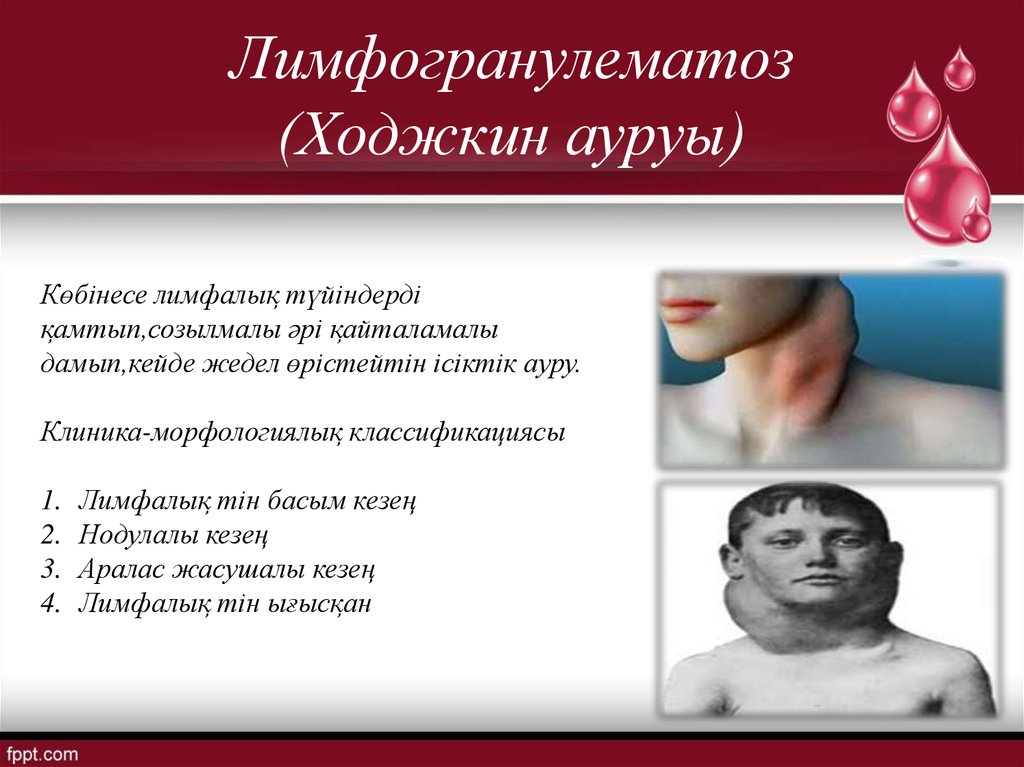 Наиболее информативными методами являются:
Наиболее информативными методами являются:
- Магнитно-резонансная томография. При обнаружении лимфаденопатии МРТ по информативности сопоставима с КТ, однако несколько хуже определяет пораженные узлы в средостении. Трехмерная визуализация органов грудной и брюшной полости, забрюшинного пространства, таза, мягких тканей, сосудов дает возможность точно установить распространенность патологического процесса. При необходимости выполняется МРТ всего тела.
- Ультразвуковое исследование. Эхография — наиболее безопасный метод обследования для беременной и плода. УЗИ брюшной полости и забрюшинного пространства назначают при подозрении на злокачественное перерождение забрюшинных лимфоузлов. Для корректного определения стадии болезни производят УЗИ селезенки, которая может вовлекаться в онкопроцесс. При поверхностном расположении проводят УЗИ лимфатических узлов.
- Рентгенологическое исследование. Рентгенография ОГК в двух проекциях применяется ограниченно при возможном поражении внутригрудных (медиастинальных) лимфоузлов.
 Для исключения негативного влияния на плод обязательно экранируется брюшная полость. При наличии показаний выполняется КТ грудной полости без использования контраста.
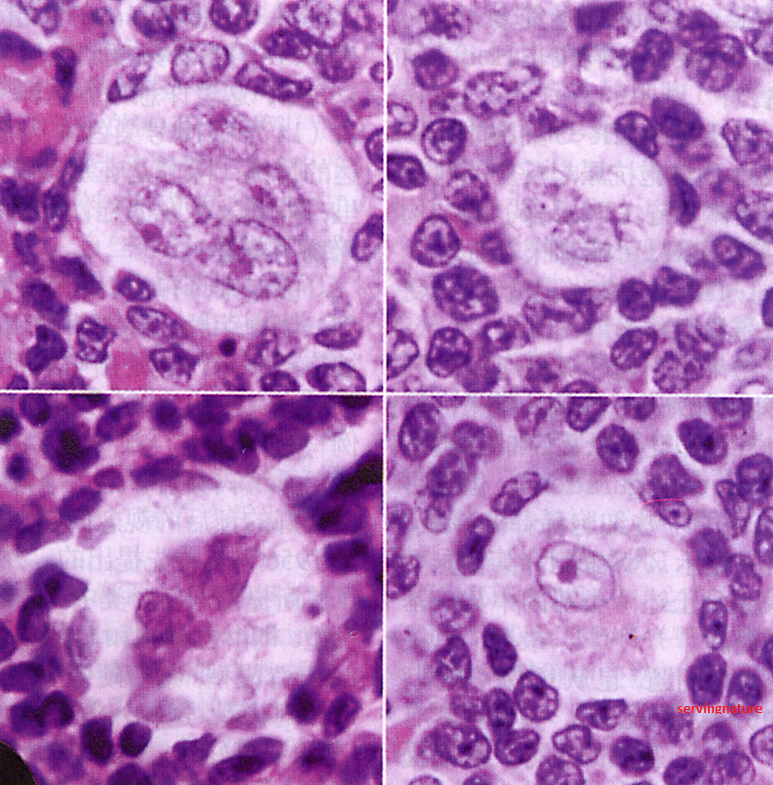
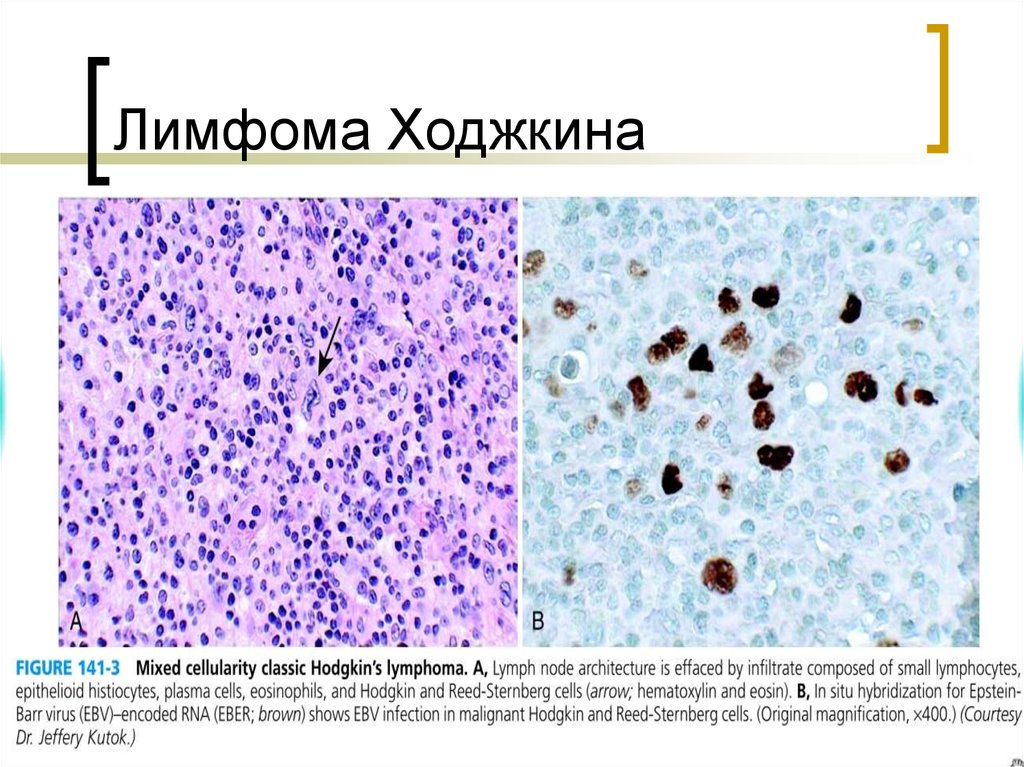
Для исключения негативного влияния на плод обязательно экранируется брюшная полость. При наличии показаний выполняется КТ грудной полости без использования контраста. - Гистологическое исследование биоптата. Достоверными маркерами лимфогранулематоза являются опухолевые клетки — одноядерные Ходжкина и многоядерные Рид-Штернберга. В зависимости от гистологического варианта заболевания они могут быть единичными, располагаться очагами между фиброзными тяжами или полностью замещать нормальную лимфоидную ткань. В препарате также могут присутствовать лакунарные клетки.
В общем анализе крови обычно отсутствуют какие-либо специфические изменения, повышение СОЭ свидетельствует о неблагоприятном течении процесса. При наличии экстранодулярных симптомов лимфомы показано определение уровней щелочной фосфатазы, АлТ, АсТ, креатинина, общего белка, других лабораторных маркеров поражения печени и почек, биопсия костного мозга. Болезнь Ходжкина у беременных дифференцируют с вирусными лимфаденитами при краснухе, кори, инфекционном мононуклеозе, цитомегаловирусной инфекции, паразитарными поражениями лимфоузлов (токсоплазмозом, гистоплазмозом, эхинококкозом, дирофиляриозом, лейшманиозом), лейкозами, неходжкинскими лимфомами, туберкулезом, саркоидозом, раком легких. По показаниям пациентку кроме акушера-гинеколога и онкогематолога консультируют инфекционист, фтизиатр, пульмонолог, онколог, гастроэнтеролог, невропатолог, неонатолог.
По показаниям пациентку кроме акушера-гинеколога и онкогематолога консультируют инфекционист, фтизиатр, пульмонолог, онколог, гастроэнтеролог, невропатолог, неонатолог.
Лечение ЛХ у беременных
При выборе терапевтической тактики учитывают агрессивность неоплазии, гестационный срок, желания пациентки. Вне зависимости от формы и стадии опухоли может быть принято одно из трех возможных решений: прерывание беременности, выжидательно-наблюдательный подход, активное противоопухолевое медикаментозно-лучевое лечение по общим принципам. В соответствии с рекомендациями Министерства здравоохранения и социального развития России, медицинский аборт до 12-недельного срока рекомендован больным с лимфомой 3-4-й стадии. На более поздних сроках при агрессивном течении онкопроцесса вопрос прерывания гестации решается консилиумом с учетом мнения беременной и ее родственников.
При индолентном (медленно прогрессирующем) нодулярном склерозе IA-IIA стадий возможно успешное ведение большинства пациенток без назначения лечения на протяжении некоторого времени. В таких случаях беременность пролонгируется до достижения плодом жизнеспособности, обеспечивается регулярный УЗИ- или МРТ-контроль, а терапия болезни Ходжкина откладывается до II-III триместров и даже на послеродовый период. Женщинам с массивным поражением, наличием общеклинической B-симптоматики, экстранодулярным поражением, поддиафрагмальным распространением процесса, быстрым прогрессированием лимфогранулематоза назначаются:
В таких случаях беременность пролонгируется до достижения плодом жизнеспособности, обеспечивается регулярный УЗИ- или МРТ-контроль, а терапия болезни Ходжкина откладывается до II-III триместров и даже на послеродовый период. Женщинам с массивным поражением, наличием общеклинической B-симптоматики, экстранодулярным поражением, поддиафрагмальным распространением процесса, быстрым прогрессированием лимфогранулематоза назначаются:
- Химиотерапия. До II триместра предпочтительна монохимиотерапия алкалоидными цитостатиками. Далее применяется протокол ABVD без алкилирующих препаратов либо CHOP-подобные режимы. При рефрактерных формах болезни Ходжкина и рецидиве заболевания после I триместра возможно назначении более активных MOPP и MOPP-подобных схем. Миелосупрессивное лечение должно быть завершено не позднее, чем за 3 недели до предполагаемых родов.
- Радиотерапия. Обычно лучевую терапию откладывают до конца гестации, но не дольше 9 недель после последней химиотерапии.
 При клинически диагностированном химиорезистентном лимфогранулематозе или невозможности проведения химиотерапии выполняется облучение мантиевидными либо мини-мантиевидными полями, обеспечивается защита плода с помощью свинцового фартука. Суммарная полученная доза не должна превышать 10 Гр.
При клинически диагностированном химиорезистентном лимфогранулематозе или невозможности проведения химиотерапии выполняется облучение мантиевидными либо мини-мантиевидными полями, обеспечивается защита плода с помощью свинцового фартука. Суммарная полученная доза не должна превышать 10 Гр.
B-клеточная лимфома не является показанием для оперативного родоразрешения. При отсутствии акушерских противопоказаний беременность завершают естественными родами. Больным с выраженной постхимиотерапевтической тромбоцитопенией (менее 100∙109/л) из-за повышенного риска образования пункционных гематом противопоказаны спинальная и эпидуральная анальгезия. Кесарево сечение может производиться при наличии осложнений противоопухолевой терапии — постлучевого кардиофиброза, сердечно-легочной недостаточности II-III степени, патологических переломов поясничных позвонков, асептического некроза тазобедренного сустава. Пациенткам в состоянии ремиссии не противопоказано грудное вскармливание, при активной лимфоме лактацию рекомендуется подавить.
Прогноз и профилактика
По данным исследований, гестация и ее сохранение не влияют на течение лимфогранулематоза. Применение полихимиотерапии самостоятельно или в комбинации с лучевой терапией позволяет достичь излечения у 70-80% беременных с впервые выяв ленной лимфомой Ходжкина. Прогностически неблагоприятными признаками являются массивное поражение лимфоузлов средостения, вовлечение в процесс 3 и более областей (лимфоидных структур), наличие экстралимфатических поражений, значительное ускорение СОЭ (при отсутствии общеклинических симптомов — свыше 50 мм/ч, а при их наличии — свыше 30 мм/ч).
Пациенткам, получавшим противолимфогранулематозное лечение, рекомендуется воздержаться от зачатия в течение 3 лет после завершения терапии. Менструальная функция, которая часто нарушается после применения химиопрепаратов, обычно восстанавливается за 2-3 года. Если больной назначались протоколы с использованием больших доз глюкокортикоидов, перед планируемой беременностью желательно провести денситометрию для исключения остеопении или остеопороза. Беременных, пролеченных по поводу злокачественной гранулемы, относят в группу высокого акушерского риска. После постановки на учет в женской консультации их должен не менее 12 раз осмотреть онкогематолог (онколог). В связи с недостаточной изученностью этиологии специальных мер профилактики болезни Ходжкина не предложено.
Беременных, пролеченных по поводу злокачественной гранулемы, относят в группу высокого акушерского риска. После постановки на учет в женской консультации их должен не менее 12 раз осмотреть онкогематолог (онколог). В связи с недостаточной изученностью этиологии специальных мер профилактики болезни Ходжкина не предложено.
Онкогематология — цены на услуги, запись на прием врача онкогематолога в Москве
Злокачественные заболевания кроветворной и лимфоидной ткани (онкогематологические заболевания, гемобластозы) занимают важное место в онкологии и требуют особого внимания на всех этапах течения болезни (диагностики, лечения, наблюдения). Группа этих заболеваний достаточно разнообразна. Сюда включают различные виды неходжкинских лимфом, лимфому Ходжкина (лимфогранулематоз), множественную миелому (миеломная болезнь), хронические лейкозы.
Онкогематология в Москве:
Клинический госпиталь Лапино-1 «Мать и дитя»Онкоцентр «Лапино-2»
Факторы развития заболеваний
Все онкогематологические заболевания происходят из разных клеток крови и костного мозга, по-разному протекают и
лечатся. Большое число разнородных болезней объединяет злокачественная природа и четкая клональность — поражение
Большое число разнородных болезней объединяет злокачественная природа и четкая клональность — поражение
только определенной популяции клеток.
Заболевания в онкогематологии:
- Лимфома Ходжкина
- программное лечение лимфомы Ходжкина (ЛХ) проводится с учетом международных и российских рекомендаций.
- лечение больных с рецидивом или рефрактерным течением ЛХ включает проведение терапии II линии с использованием
новых противоопухолевых агентов, с дальнейшей подготовкой к проведению аутологичной трансплантации костного мозга
(консультация в ведущих Центрах страны). - большое внимание уделяется качеству жизни больных, периоду реабилитации и социальной адаптации. Наиболее яркой
иллюстрацией качества жизни излеченных больных стало большое число женщин, родивших и воспитавших здоровых детей
после излечения от ЛХ. - Неходжкинские лимфомы
- неходжкинские лимфомы (НХЛ) объединяет разные по происхождению и клиническому течению нозологические формы.
 При
При
неходжкинских лимфомах адекватная программа терапии определяется только достоверно установленным
иммуногистохимическим вариантом опухоли. Для проведения противоопухолевой терапии индолентных лимфом и лимфом
высокой степени злокачественности используются программы стандартной и интенсифицированной химиотерапии. - Плазмоклеточные опухоли (множественная миелома, плазмоцитома)
- лечение плазмоклеточных опухолей, в частности, множественной миеломы, носит мультидисциплинарный характер -
участие вертебральных хирургов, специалистов по детоксикации, а также использование методов экстракорпоральной
детоксикации. - Хронический лимфолейкоз (ХЛЛ, лимфома из малых лимфоцитов или лимфоцитарная лимфома)
- 15-20% пациентов с хроническим лимфолейкозом не нуждаются в лечении. Для пациентов с начальными
проявлениями болезни (стадия А/0/I) предпочтительна выжидательная тактика — «Наблюдай и жди».
- Выбор одного вариантов терапии может зависеть от возраста и соматического состояния пациента, доступности
лекарств, молекулярного и цитогенетического профиля лейкоза
Симптомы онкогематологических заболеваний:
- Частая переутомляемость и усталость
- Склонность к инфекционным заболеваниям.
- Гипертермия
- Кровотечения
- Потеря веса и аппетита
- Боль в костях
- Потливость
- Увеличение лимфоузлов (периферических, внутригрудных, забрюшинных)
Диагностика Онкогематологических заболеваний в «Мать и дитя»
Врачи Клинического госпиталя «Лапино» уделяют диагностике особое внимание. Современное оборудование и индивидуальный
подход позволяет выявить отклонения на ранних стадиях и вовремя приступить к лечению, что повышает эффективность
лечения.
Диагностические процедуры, проводимые в клинике для постановки или исключения онкогематологического
заболевания:
- Лабораторные исследования крови
- Пункция и биопсия лимфатического узла, мягких тканей, молочных желез, некоторых внутренних органов
- Пункция и трепанобиопсия костного мозга
- Цитологическое, гистологическое, а также иммуногистохимическое исследование взятого материала
- УЗИ (ультразвуковое исследование)
- Люмбальная пункция
- Рентген, КТ, МРТ
- Эндоскопические исследования (гастроскопия, колоноскопия)
- Направление на ПЭТ/КТ
- Консультации специалистов разного профиля (невролог, терапевт, окулист, ЛОР)
Лечение онкогематологических заболеваний
Врачи-онкогематологи Клинического госпиталя «Лапино» используют самые современные протоколы, применяя новейшие
технологии в лечении онкогематологических заболеваний. Протоколы лечения разрабатываются для каждого пациента
Протоколы лечения разрабатываются для каждого пациента
индивидуально.
В отделении онкогематологии Клинического госпиталя «Лапино 2» возможна консультация пациенток на разных сроках
беременности, у которых выявлены онкогематологические заболевания. Тактика ведения таких пациенток успешно решается в
нашей клинике совместно с врачом акушером-гинекологом. Согласно накопленному раннее опыту, такая тактика позволяет в
большинстве случаев сохранить беременность, а после родоразрешения провести женщине полноценное противоопухолевое
лечение.
В нашу клинику может обратиться любой пациент для очной консультации, во время которой будет определена дальнейшая
тактика. Диагностика заболевания проводится по самым современным стандартам, а правильно поставленный диагноз — залог
успешного лечения.
Решение о начале программного лечения в нашей клинике принимается руководителем отделения по рекомендации
врача- онкогематолога только при очной консультации после оценки состояния пациента. На амбулаторном этапе проводятся
На амбулаторном этапе проводятся
также заочные консультации по представленным медицинским документам.
При лечении злокачественных заболеваний могут быть использованы:
- химиотерапия
- лучевая терапия
- радиохирургия
- экстракорпоральная детоксикация (диализный центр)
Наши преимущества:
- Лечение у ведущих врачей-онкологов Москвы и Московской области
- Персонализированный подход к каждому пациенту
- Проведение онкологического консилиума для каждого пациента
- Минимизация рисков осложнений
- Онлайн консультации специалистов
- Новейшее оборудование последнего поколения
- Органосохраняющие операции
- Современные схемы и протоколы (согласно международным и российским рекомендациям)
- Высококвалифицированный уход
- Комфортные палаты
Диагностика и лечение онкологических заболеваний в «Мать и дитя» — это гарант оказания медицинских услуг высокого
качества и комфорта!
Записаться на приём
услуги — Онкогематология
Клинический госпиталь MD GROUPКлинический госпиталь Лапино-1 «Мать и дитя»Онкоцентр «Лапино-2»Ковидный госпиталь «Лапино-4»Клиника КГ «Лапино» в г. Одинцово (филиал)Детская клиника КГ «Лапино» на Новой Риге (филиал)Центр амбулаторной онкологической помощи (филиал КГ Лапино-2)Клиника «Мать и дитя» КунцевоКлиника «Мать и дитя» Ходынское полеКлиника «Мать и дитя» СавёловскаяКлиника «Мать и дитя» Юго-ЗападКлиника «Мать и дитя» ЛефортовоКлиника «Мать и дитя» НовогиреевоСеть медицинских лабораторий MD LabКлиника «Мать и дитя» БутовоКлиника «Мать и дитя» Мытищи — СКОРО ОТКРЫТИЕ
Одинцово (филиал)Детская клиника КГ «Лапино» на Новой Риге (филиал)Центр амбулаторной онкологической помощи (филиал КГ Лапино-2)Клиника «Мать и дитя» КунцевоКлиника «Мать и дитя» Ходынское полеКлиника «Мать и дитя» СавёловскаяКлиника «Мать и дитя» Юго-ЗападКлиника «Мать и дитя» ЛефортовоКлиника «Мать и дитя» НовогиреевоСеть медицинских лабораторий MD LabКлиника «Мать и дитя» БутовоКлиника «Мать и дитя» Мытищи — СКОРО ОТКРЫТИЕ
Онкогематология
Нажимая на кнопку отправить, я даю согласие на обработку персональных данных
Лимфогранулематоз — Справочник заболеваний
Лимфогранулематоз (болезнь Ходжкина) — это злокачественное новообразование из лимфатической ткани.
Общая информация
Основная причина возникновения лимфогранулематоза до сих пор неизвестна. При лимфогранулематозе в одной из клеток лимфатического узла возникает мутация, которая является началом опухоли. Со временем мутировавшие клетки по лимфатическим путям распространяются в другие лимфатические узлы. Лимфогранулематоз может возникнуть в любом возрасте. Однако существует два пика заболеваемости — в возрасте 20-29 лет и в возрасте 60 лет и старше. И мужчины, и женщины, за исключением детей до 10 лет (чаще болеют мальчики) болеют лимфогранулематозом одинаково часто.
Лимфогранулематоз может возникнуть в любом возрасте. Однако существует два пика заболеваемости — в возрасте 20-29 лет и в возрасте 60 лет и старше. И мужчины, и женщины, за исключением детей до 10 лет (чаще болеют мальчики) болеют лимфогранулематозом одинаково часто.
Основным проявлением болезни Ходжкина является поражение лимфатических узлов, что в свою очередь проявляется их увеличением и уплотнением. При лимфогранулематозе могут увеличиваться любые группы лимфоузлов. Увеличенные лимфоузлы могут встречаться на шее, в подмышечных областях, брюшной и грудной полости, паховых и других областях. Пораженный лимфатический узел достаточно больших размеров (до нескольких сантиметров и больше), безболезненный при ощупывании. Заболевание обычно начинается с поражения шейных и надключичных лимфатических узлов.
Симптомы
Различают два варианта течения болезни — с симптомами интоксикации и без. К симптомам интоксикации относят слабость, похудание, обильный пот. Подобные признаки могут встречаться и при ряде других болезней, например, при туберкулезе, что требует тщательного обследования больного и обязательного гистологического исследования пораженных лимфоузлов. При отсутствии какого-либо лечения процесс постепенно переходит от одних групп лимфоузлов к другим. Смерть наступает от интоксикации.
При отсутствии какого-либо лечения процесс постепенно переходит от одних групп лимфоузлов к другим. Смерть наступает от интоксикации.
Диагностика
Лимфатические узлы увеличиваются постепенно, могут достигать больших размеров, образуя опухолевый конгломерат. Узлы конгломерата не спаяны с окружающими тканями, отсутствуют местные признаки воспаления (покраснение кожи над опухолью, боль).
С диагностической целью производится исследование лимфоузла с помощью пункции (биопсия). Только после обнаружения специфических клеток, которые характерны для лимфогранулематоза, возможно лечение. Для оценки распространенности болезни проводится целый ряд исследований, выбор которых основан на месторасположении первичного очага. Стандартный объем исследований включает рентгенографию грудной клетки, биопсию костного мозга, сканирование печени и селезенки.
Нередко требуется диагностическая лапаротомия (операция, предполагающая вскрытие брюшной полости с помощью разреза передней брюшной стенки) с целью выяснения состояния лимфатических узлов брюшной полости и забрюшинного пространства. Необходимы также анализ крови, ультразвуковое исследование органов брюшной полости, компьютерная рентгеновская или магниторезонансная томография органов грудной клетки.
Необходимы также анализ крови, ультразвуковое исследование органов брюшной полости, компьютерная рентгеновская или магниторезонансная томография органов грудной клетки.
Установление точного диагноза позволяет правильно планировать вид и объем лечения, что в свою очередь положительно отражается на результатах.
Лечение лимфогранулематоза
Наиболее перспективным и эффективным методом лечения локальных форм болезни является комбинированная химио-лучевая терапия, которая позволяет получить длительные, 10-20-летние ремиссии более чем у 90 процентов больных, что равноценно полному излечению. Как правило, большинство больных лимфогранулематозом начинают первый курс лечения в стационаре, а затем, при условии хорошей переносимости лекарств, продолжают получать лечение в амбулаторных условиях, не прекращая учебы или работы.
При 1-2 стадии лимфогранулематоза лечение, как правило, включает только облучение. Лучевая терапия проводится на специальных аппаратах. Облучаются определенные группы лимфатических узлов. Действие облучения на другие органы нейтрализуется с помощью специальных защитных фильтров. При 3-4 стадии лечение дополняют химиотерапией. В основные схемы химиотерапии, проводимой при лимфогранулематозе, входят Циклофосфан, Винкристин, Прокарбазин, Винбластин, Адриабластин, Преднизолон.
Действие облучения на другие органы нейтрализуется с помощью специальных защитных фильтров. При 3-4 стадии лечение дополняют химиотерапией. В основные схемы химиотерапии, проводимой при лимфогранулематозе, входят Циклофосфан, Винкристин, Прокарбазин, Винбластин, Адриабластин, Преднизолон.
Лимфогранулематоз и беременность
По данным проф. В. Курмашова, к. м. н. Ю. Червонобаба (НИИ детской онкологии и гематологии РОНЦ им. Н. Н. Блохина РАМН) В Российском онкологическом научном центре им. Н. Блохина за более чем 30-летний период наблюдалось свыше 2 300 больных лимфогранулематозом, включая более 600 пациентов в возрасте моложе 15 лет. Среди этих больных 292 (142 женщины и 150 мужчин) находились в детородном возрасте, из них у 103 родились дети, при этом 8 женщин рожали дважды. Следует особо подчеркнуть, что все дети родились здоровыми и на протяжении всей своей жизни (возраст детей на начало 1999 года от 8 мес. до 16 лет) находятся под специальным наблюдением врачей. У абсолютного большинства женщин беременность протекала гладко, без осложнений. Рецидив лимфогранулематоза, связанный с беременностью, развился лишь у четырех женщин, которые забеременели в сроки менее трех лет от окончания специфического лечения.
Рецидив лимфогранулематоза, связанный с беременностью, развился лишь у четырех женщин, которые забеременели в сроки менее трех лет от окончания специфического лечения.
Жизнь после лимфомы | Газета «День»
В отделении онкогематологии Национального института рака, ожидая Ирину Анатолиевну, изучаем распорядок дня пациентов. В семь — подъем, почти весь день — выполнение врачебных назначений, отход ко сну в десять вечера. Красок в больничные будни добавляет выставка картин и художественной фотографии, созданных теми, кто поборол болезнь. «Несколько наших пациентов после выздоровления начали писать картины и выставляют свои работы в Украине и даже за рубежом», — говорит Ирина КРЯЧЕК, заведующая отделением химиотерапии гемобластозов НИР, доктор медицинских наук, профессор.
В советское время существовал приказ, согласно которому рекомендовалось прерывать беременность всем, у кого нашли рак. Как объясняет Ирина Анатолиевна, когда у пациентки на сносях диагностировали онкологию, ее немедленно отправляли на прерывание беременности. Сейчас ситуация в мире изменилась, и новейшие разработки понемногу доходят до Украины. Сегодня в Национальном институте рака промотируют подход, когда беременная пациентка с лимфомой (тип злокачественных опухолей, которые возникают из лимфоцитов) может родить. Для этого в НИР развивают собственные разработки, которые базируются на зарубежном опыте. Собственно, с пани Ириной мы общаемся незадолго до международной конференции, посвященной современным подходам к диагностике и лечению лимфопролиферативных заболеваний, — она проходит в учреждении 5—6 октября. Ирина Крячек рассказала «Дню» о том, почему лимфома — не повод ставить крест на жизни, своей и своих детей, а также о диагностировании и лечении болезни в Украине и мире.
Сейчас ситуация в мире изменилась, и новейшие разработки понемногу доходят до Украины. Сегодня в Национальном институте рака промотируют подход, когда беременная пациентка с лимфомой (тип злокачественных опухолей, которые возникают из лимфоцитов) может родить. Для этого в НИР развивают собственные разработки, которые базируются на зарубежном опыте. Собственно, с пани Ириной мы общаемся незадолго до международной конференции, посвященной современным подходам к диагностике и лечению лимфопролиферативных заболеваний, — она проходит в учреждении 5—6 октября. Ирина Крячек рассказала «Дню» о том, почему лимфома — не повод ставить крест на жизни, своей и своих детей, а также о диагностировании и лечении болезни в Украине и мире.
«ЖЕНЩИНА С ЛИМФОМОЙ МОЖЕТ РОЖАТЬ»
— Ирина Анатолиевна, кому обычно диагностируют лимфому? Почему этот вопрос актуален для беременных?
— Если говорим о лимфоме Ходжкина, есть два пика заболеваемости: один — у лиц в возрасте до 30 лет, другой — у людей старше 60 лет. Молодая женщина может забеременеть во время постановки диагноза «лимфома» или уже имея это заболевание. Заболевание лимфомой и беременность могут случиться одновременно, но беременные не болеют лимфомой чаще других.
Молодая женщина может забеременеть во время постановки диагноза «лимфома» или уже имея это заболевание. Заболевание лимфомой и беременность могут случиться одновременно, но беременные не болеют лимфомой чаще других.
Вообще заболеваемость лимфомой Ходжкина в Украине составляет 2,6 человека на 100 000 населения, неходжкинскими формами болезни — около четырех случаев на 100 000 населения. Эти показатели сопоставимы с мировыми.
Когда диагностируются лимфома и беременность, это очень сложная клиническая ситуация, которую нужно решать с участием многих специалистов: гематолога или онколога, которые лечат лимфому, акушера-гинеколога. В первую очередь нужно ответить на вопрос, можно ли сохранить беременность у пациентки с лимфомой.
До последнего времени украинские врачи часто говорили таким женщинам, что беременность нужно быстро прервать. В последние годы ситуация в мире изменилась. Проведено много исследований, как дать пациентке доносить ребенка или лечить его от лимфомы во время беременности. Специалисты доказали, что детки, которые родились даже от женщин, которые во время беременности получали химиотерапию, являются здоровыми, развиваются умственно и физически так, как их одногодки, рожденные от женщин без лимфомы. Единственное, роды могут быть немного сложнее, а родившийся ребенок может иметь несколько меньшую массу тела — однако этот показатель быстро выравнивается, и дальше малыш развивается нормально.
Специалисты доказали, что детки, которые родились даже от женщин, которые во время беременности получали химиотерапию, являются здоровыми, развиваются умственно и физически так, как их одногодки, рожденные от женщин без лимфомы. Единственное, роды могут быть немного сложнее, а родившийся ребенок может иметь несколько меньшую массу тела — однако этот показатель быстро выравнивается, и дальше малыш развивается нормально.
В нашем отделении промотируется идея, что женщина с лимфомой может родить здорового ребенка. Когда мы диагностируем эту болезнь у беременной женщины, прежде всего определяем, насколько данная лимфома агрессивная. Мы знаем о существовании около ста вариантов лимфом, каждый — как отдельное заболевание. Некоторые виды лимфомы имеют доброкачественное течение, женщина может подождать девять месяцев и начинать химиотерапевтическое лечение после того, как родит ребенка. Часть лимфом являются очень агрессивными. Если женщина имеет такую форму болезни, ей срочно нужно проводить мощную химиотерапию, которая может негативно повлиять на развитие ребенка. Это случай, когда даже мы рекомендуем прерывать беременность. И есть категория больных с лимфомой средней агрессивности. Тогда мы тщательным образом наблюдаем за ходом заболевания, каждые две недели осматриваем пациентку. Если заболевание прогрессирует, придется начинать химиотерапию. Но даже здесь есть несколько вариантов. Химиотерапия может быть более или менее агрессивной, и мы знаем, какие схемы химиотерапии можно применять у беременных. Это может быть как монохимиотерапия, то есть лечение с помощью одного препарата, так и полихимиотерапия, но с применением препаратов, которые не навредят ребенку. Параллельно наблюдается беременность, то, как проходит развитие плода. Женщина может родить самостоятельно или с помощью кесарева сечения.
Это случай, когда даже мы рекомендуем прерывать беременность. И есть категория больных с лимфомой средней агрессивности. Тогда мы тщательным образом наблюдаем за ходом заболевания, каждые две недели осматриваем пациентку. Если заболевание прогрессирует, придется начинать химиотерапию. Но даже здесь есть несколько вариантов. Химиотерапия может быть более или менее агрессивной, и мы знаем, какие схемы химиотерапии можно применять у беременных. Это может быть как монохимиотерапия, то есть лечение с помощью одного препарата, так и полихимиотерапия, но с применением препаратов, которые не навредят ребенку. Параллельно наблюдается беременность, то, как проходит развитие плода. Женщина может родить самостоятельно или с помощью кесарева сечения.
«МЫ БОРЕМСЯ ЗА КАЖДОГО РЕБЕНКА»
— Как роды влияют на лечение?
— Как правило, мы определяем срок родов. Чаще это кесарево сечение, потому что так мы можем спланировать рождение ребенка. И, конечно, мы планируем все так, чтобы это произошло в промежутках между химиотерапией.
Мы знаем, что нужно очень внимательно отнестись к этим родам. Есть медицинские нюансы, на которые нужно обращать внимание специалисту.
— Насколько в Украине распространены методики, когда при лимфоме можно не прерывать беременность?
— Для нашей страны это относительно ново. Даже сегодня случаются ситуации, когда к нам на консультацию приезжают женщины, которым по месту жительства рекомендовали прервать беременность. В таких обстоятельствах в 90% случаев мы отменяем эту рекомендацию и начинаем наблюдать эту женщину. Как правило, все завершается хорошо.
Вообще в НИР этим направлением занимаются около десяти лет. За это время только те женщины, которые получали лечение у нас, родили 40 детей — это наша радость. В целом таких женщин намного больше.
Сейчас мы часто говорим о новых подходах в лечении, проводим конференции на тему лимфом и беременности. Мы тесно сотрудничаем со специалистами Института педиатрии, акушерства и гинекологии Национальной академии медицинских наук, с профессором Владимиром Медведем. Очень пропагандируем идею, что каждая женщина с лимфомой имеет право на беременность. Однако, конечно, это сложная ситуация. Все равно не всем таким пациенткам можно рожать во время лечения, но мы боремся за каждого ребенка.
Очень пропагандируем идею, что каждая женщина с лимфомой имеет право на беременность. Однако, конечно, это сложная ситуация. Все равно не всем таким пациенткам можно рожать во время лечения, но мы боремся за каждого ребенка.
ОПАСНЫЕ «ТРАВКИ»
— Каков уровень излечиваемости от лимфомы в Украине?
— Сегодня результаты лечения лимфом в Украине и мире намного улучшились. В целом в Украине результаты лечения, которые определяются по показателю пятилетней выживаемости, на 20—25% хуже мировых. Но в нашем Институте эти показатели сопоставимы с мировыми. Если мы говорим о лимфоме Ходжкина, то это полное излечение в 90% случаев. Если речь идет о неходжкинских формах — по последним данным, это около 70% пациентов. Мы лечим лимфому по мировым стандартам, и результаты лечения такие, как в ведущих странах мира.
— Что нужно понимать под термином «полное излечение»? Человек проходит химиотерапию и потом живет обычной жизнью?
— Базовое лечение лимфомы — химиотерапия или химиоиммунотерапия. В некоторых случаях после завершения такого лечения мы еще проводим лучевую терапию. Например, когда речь идет о ранних стадиях лимфомы Ходжкина или когда есть остаточная опухолевая масса при неходжкинских лимфомах.
В некоторых случаях после завершения такого лечения мы еще проводим лучевую терапию. Например, когда речь идет о ранних стадиях лимфомы Ходжкина или когда есть остаточная опухолевая масса при неходжкинских лимфомах.
После завершения лечения пациент переходит под наблюдение. Мы наблюдаем за ним первый год — каждые три месяца, со второго года — каждые шесть месяцев, в дальнейшем — раз в году. Во всем мире 20—30% больных могут иметь рецидив заболевания, который тоже лечится. Пациенты находятся под нашим наблюдением до десяти лет.
— На какой стадии, как правило, диагностируют лимфому? Ведь в Украине люди нередко обращаются к медикам очень поздно, когда лечить то или иное заболевание в лучшем случае значительно сложнее.
— Действительно, эффективность лечения лимфомы напрямую зависит от стадии заболевания. Излечиваемость лимфомы Ходжкина на первой-второй стадиях составляет 98%. На четвертой стадии выживаемость составляет всего 30%. Ситуация с неходжкинскими лимфомами варьирует в зависимости от вида болезни. Но в целом чем раньше мы диагностируем лимфому, тем лучше результаты лечения.
Но в целом чем раньше мы диагностируем лимфому, тем лучше результаты лечения.
Бывает, человек заподозрил у себя лимфому, нашел лимфатический узел как какое-то образование в теле и боится пойти к врачу, потому что ему страшно услышать тяжелый диагноз. Такое случается во всем мире, но в Украине, думаю, этих случаев несколько больше. Человек боится иметь дело с реалиями, не обращается к специалистам, а идет к представителям нетрадиционной медицины. У нас есть много показательных случаев, когда людям ставят диагноз на первой или второй стадии лимфомы, они не доверяют традиционной медицине и пробуют до десятка разных методик: антигельминтное лечение, керосин, травы и т.п. Через год эти пациенты возвращаются к нам с четвертой стадией заболевания. Лечить такую стадию намного тяжелее, потому что обычно речь идет об общей интоксикации организма, на фоне основного заболевания возникают осложнения.
К тому же, альтернативные методы лечения, как правило, не являются безопасными. Многие люди употребляют такие травы, как болиголов, чистотел, омелу, которые представляют собой яд. После такого «лечения» человек приходит к нам, мы начинаем химиотерапию, и токсичное действие тех ядов налагается на токсичное действие нашего лечения. Химиотерапия излечивает заболевание, но имеет побочные действия — и мы знаем, как предотвратить это влияние. А если человек получил много яда до того, может быть много осложнений.
После такого «лечения» человек приходит к нам, мы начинаем химиотерапию, и токсичное действие тех ядов налагается на токсичное действие нашего лечения. Химиотерапия излечивает заболевание, но имеет побочные действия — и мы знаем, как предотвратить это влияние. А если человек получил много яда до того, может быть много осложнений.
Поэтому всем нашим пациентам мы советуем не терять время. Когда есть подозрение на заболевание, лучше вместе с врачом побороть страх и иметь дело с реальностью.
ДИАГНОЗ СТАВЯТ ТОЛЬКО ПОСЛЕ БИОПСИИ
— Что можно назвать симптомами лимфомы?
— Какого-то специфического признака, характерного для лимфомы, нет. Но чаще всего это увеличение лимфатического узла где-нибудь. На шее, под руками, в паху. Это то, что человек может заметить. Как правило, нужно обращать внимание на это, когда лимфатический узел увеличен длительное время без признаков инфекционного заболевания. Потому что, напомню, лимфатические узлы создают барьер между инфекцией и нашим организмом. Поэтому нормально, когда лимфатический узел увеличивается, если человек имеет инфекционное заболевание, например ангину.
Поэтому нормально, когда лимфатический узел увеличивается, если человек имеет инфекционное заболевание, например ангину.
При лимфоме есть увеличение лимфатического узла без признаков инфекционного заболевания. Или это увеличение появляется при инфекционной болезни, а после выздоровления не исчезает. Размеры — более сантиметра-полутора, и новое образование не рассасывается, а даже увеличивается. Это первая ситуация, когда нужно немедленно обратиться к врачу. Специалист рассмотрит разные варианты. Возможно, это воспалительный процесс в лимфатическом узле, но, возможно, возникнет подозрение на лимфому, и человека отправят на биопсию.
Диагноз «лимфома» ставится только после биопсии, когда хирургическим методом изымают лимфатический узел и врач-патолог изучает его под микроскопом.
Лимфома достаточно часто локализуется в средостении. Больной чувствует это как одышку, немотивированный кашель. При наличии в грудной клетке большой опухолевой массы появляется венозная сетка на передней стенке грудной клетки, человеку трудно дышать. Достаточно часто мы диагностируем опухоль в средостении после того, как больной прошел профилактический осмотр, по результатам флюорографии, которую нужно делать раз в году.
Достаточно часто мы диагностируем опухоль в средостении после того, как больной прошел профилактический осмотр, по результатам флюорографии, которую нужно делать раз в году.
Когда лимфома есть в брюшной полости, может быть дискомфорт в животе. Нередко определенные виды лимфомы протекают с увеличением селезенки. Тогда человек чувствует дискомфорт и тяжесть в левом подреберье.
Из симптомов, также характерных для лимфомы, — так называемые симптомы интоксикации. Это уменьшение веса тела более чем на 10% за последние шесть месяцев без видимой причины. Другой симптом — немотивированное повышение температуры выше 38?С. То есть когда нет инфекции и ежедневно поднимается температура — как правило, вечером. Третье — сильная ночная потливость, тоже без видимой причины, когда больной просыпается, а у него мокрые подушка, футболка, простыня. Это патологические симптомы, которые могут указать, что человек, возможно, имеет лимфому.
ОСВОЕНИЕ ТРАНСПЛАНТАЦИИ
— Хватает ли у Института мощностей помогать всем, кто обращается с подозрением на лимфому?
— Больные лимфомами в Национальном институте рака лечатся в отделении онкогематологии, которое имеет 60 коек. Принимаем на лечение до тысячи больных в год. Это намного меньше, чем во всей Украине — в целом пациентов с лимфомами в стране насчитывается до 40 000. Но также мы оказываем мощную консультативную помощь. Консультируем свыше 20 000 людей в год, помогаем с диагностикой, даем рекомендации, которые пациенты выполняют по месту жительства.
Принимаем на лечение до тысячи больных в год. Это намного меньше, чем во всей Украине — в целом пациентов с лимфомами в стране насчитывается до 40 000. Но также мы оказываем мощную консультативную помощь. Консультируем свыше 20 000 людей в год, помогаем с диагностикой, даем рекомендации, которые пациенты выполняют по месту жительства.
К нам направляют сложные случаи — людей с рецидивами болезни, с рефрактерным первичным течением, то есть когда пациенты нуждаются не в стандартной, а более интенсивной и более сложной терапии.
— Относительно платы за лечение — на какую помощь государства может рассчитывать пациент?
— Длительное время в Украине существовала программа «Онкология», которая завершилась в 2016 году. Однако государство финансирует определенную часть расходов на закупку и закупает препараты для лечения онкобольных. Но, к сожалению, это финансирование покрывает не более чем 20-30% от потребности. Поэтому финансовый груз ложится и на плечи пациентов.
Наш Институт в настоящий момент в хорошей ситуации, мы достаточно хорошо обеспечены лекарствами. Сейчас у нас есть почти все препараты для лечения лимфомы. Но в целом, если брать потребности в этих препаратах на год, мы не можем обеспечить всех пациентов.
— Какие новые методики внедряются в НИР?
— Последнее наше новшество — в 2016 году на базе Института мы начали применять такой метод лечения, как аутологичная трансплантация ствольных клеток. Полное название методики — высокодозовая химиотерапия с поддержкой стволовыми клетками. При ее использовании у больного берут его клетки, проводят мощную химиотерапию и возвращают клетки в организм. До 2016 года единственным учреждением, которое использовало этот метод лечения для взрослых больных, был Киевский центр трансплантации костного мозга. Потребность в аутологичных трансплантациях в Украине составляет до 2000 таких операций в год, а мощности этого заведения обеспечивали до 5% этой потребности, то есть там делали около 100 трансплантаций в год. НИР стал вторым центром, который этим занимается. В конце 2016 года мы сделали шесть аутологичных трансплантаций и сейчас активно развиваем это направление, наши инициативы поддерживает Министерство здравоохранения.
НИР стал вторым центром, который этим занимается. В конце 2016 года мы сделали шесть аутологичных трансплантаций и сейчас активно развиваем это направление, наши инициативы поддерживает Министерство здравоохранения.
Также планируем, что в 2018 году начнем делать в Институте аллогенную трансплантацию. Это трансплантация от донора, такая процедура намного сложнее. В мире этот метод широко используют при лечении гематологических заболеваний, в частности лимфом. Украина пока немного отстает. Надеемся, что благодаря нашим усилиям и при поддержке Минздрава начнем аллогенную трансплантацию и в Украине.
ФЕНОМЕН БЫВШИХ ПАЦИЕНТОВ
— Пани Ирина, вы поддерживаете связь с бывшими пациентами, помимо того, что касается медицинских наблюдений?
— Иногда пациенты приходят порадовать нас своими детками или просто хорошими новостями. Многие люди, которые завершили лечение лимфомы, открывают для себя новую жизнь. Кое-кто из них даже говорил, что если бы мог повернуть свою жизнь назад, то, наверное, хотел бы прожить ее так, как прожил, — то есть победить лимфому и начать все заново. Потому что в этой жизни девушки родили деток, открыли в себе новые таланты. Для меня это феномен, который не могу объяснить.
Потому что в этой жизни девушки родили деток, открыли в себе новые таланты. Для меня это феномен, который не могу объяснить.
Одна наша пациентка после завершения лечения лимфомы открыла студию гармоничного развития. Там каждый может научиться рисовать, фотографировать, лепить, выучить язык — студия имеет около десяти направлений по творческому развитию. А один наш бывший пациент привозит медали, которые получает за участие в марафонах и полумарафонах. Кто-то занимается триатлоном, кто-то — другим спортом. Наши бывшие пациенты становятся успешными и говорят, что если бы не лимфома, они бы, наверное, и не пробовали новое: сидели бы на диване и ждали неизвестно чего. Поэтому жизнь после лимфомы продолжается, а во многих случаях даже начинается заново.
Мария ПРОКОПЕНКО, фото Руслана КАНЮКИ, «День»
Лимфома Ходжкина на фоне ВИЧ: лимфогранулематоз, симптомы у взрослых, лимфосаркома Ходжкина при ВИЧ
Заболеваемость лимфомой Ходжкина или лимфогранулематозом (ЛГМ) невысока — двое из 100 тысяч россиян, каждый год выявляют чуть меньше 3. 5 тысяч больных россиян, и преобладают молодые и очень молодые женщины. Вероятность ВИЧ-инфицированного пациента заболеть лимфомой повышается в 30 раз, контингент тоже изменяется — это зрелые мужчины.
5 тысяч больных россиян, и преобладают молодые и очень молодые женщины. Вероятность ВИЧ-инфицированного пациента заболеть лимфомой повышается в 30 раз, контингент тоже изменяется — это зрелые мужчины.
Активизация противовирусной терапии снизила частоту развития у инфицированных саркомы Капоши и других злокачественных лимфом, но заболеваемость болезнью Ходжкина при ВИЧ, наоборот, растёт. Основная причина в отсутствии корреляции злокачественного процесса с численностью популяции СD4-лимфоцитов, ЛГМ развивается и при вполне приемлемом уровне иммунных клеток.
Диагностика болезни Ходжкина при ВИЧ
Развитие злокачественной опухоли у ВИЧ-инфицированного — это уже СПИД, то есть терминальная стадия инфекции, что определяет усложнение борьбы со злокачественным процессом.
Диагностика поражения лимфатической системы болезнью Ходжкина проводится по стандартному протоколу, где обязательна включена очень дорогая ПЭТ, способная выявить все злокачественные очаги и, что тоже немаловажно, всего за одно обследование. Никакие другие исследования даже в комплексе не способы заменить высокую технологичность ПЭТ.
Никакие другие исследования даже в комплексе не способы заменить высокую технологичность ПЭТ.
Критерии диагностики лимфопролиферативного заболевания не отличаются от общей популяции, кроме обнаружения всех очагов болезни необходимо получение кусочка опухолевой ткани для микроскопии. Как правило, у инфицированных пациентов преобладают прогностически не очень благоприятные морфологические варианты смешанно-клеточный или лимфоидное истощение, последний совсем нечаст у не компрометированных вирусом пациентов.
Наличие хронической инфекции потребует дополнительных обследований по определению вирусной нагрузки и исходных иммунных показателей. Много выше, чем в обычной популяции больных, и частота выявления в клетках опухоли ответственного за инициацию мононуклеоза вируса Эпштейна—Барр из группы герпеса.
Клинические проявления лимфомы Ходжкина на фоне ВИЧ
Основное проявление болезни — конгломераты лимфатических узлов, замещённых опухолевой тканью, часто в нескольких анатомических зонах выше и ниже диафрагмы. У большинства инфицированных ВИЧ выявляется распространённый процесс, нередко с поражением внутренних органов и чаще всего — желудочно-кишечного тракта.
У большинства инфицированных ВИЧ выявляется распространённый процесс, нередко с поражением внутренних органов и чаще всего — желудочно-кишечного тракта.
У больного возможны симптомы опухолевой интоксикации в виде повышения, довольно существенного, температуры, ночной потливости и снижение веса за непродолжительное время и без какого-либо изменения диетического режима. Такие проявления даёт и лимфома, и СПИД, и сопровождающие последнюю стадию оппортунистические инфекции: туберкулез, пневмоцистная пневмония, распространённый кандидоз и так далее.
Можно считать благом особенность лимфогранулематоза развиваться у инфицированного ВИЧ при отсутствии выраженного снижения популяции иммунных клеток, поскольку вероятность присоединения типичных для СПИД инфекций всё-таки уменьшается.
Окончательная стадия ЛГМ, которую внесут в медицинскую документацию пациента на всю оставшуюся жизнь и будут только дополнять констатацией зон рецидива и проведенным лечением, при СПИД выставляется непосредственно перед началом противоопухолевого лечения, если на первом этапе планируется ВААРТ.
С чего начинается лечение лимфомы Ходжкина при ВИЧ
Декларировано, что ВИЧ-инфицированные пациенты должны получать стандартную противоопухолевую химиотерапию, как и все другие, тем не менее, при лимфоме Ходжкина существуют терапевтические ограничения.
- Если клиника злокачественного лимфопролиферативного процесса позволяет, то на первом этапе рекомендуется провести ВААРТ, хотя бы две недели, комбинация противовирусных лекарств способна изменить статус — уменьшить проявления опухолевого процесса и его объём.
- Оптимальный вариант, когда ЛГМ обнаруживают у получающего противовирусные препараты инфицированного, а в миллилитре крови содержится более 200 иммунных клеток. В этой ситуации химиотерапия может назначаться безотлагательно, сопровождая ВААРТ, побочные эффекты которой уже известны и минимальны либо отсутствуют.
- Не получавший лечение вирусной инфекции пациент с тяжёлыми проявления ходжкинской лимфомы может нуждаться в немедленном начале ХТ, тогда ВААРТ ему начнут с отсрочкой — при улучшении состояния в ответ на уменьшение опухоли.
 ВААРТ не желательно совмещать с химиотерапией из-за повышения токсических реакций и сложности идентификации препарата, ставшего причиной неблагоприятных последствий.
ВААРТ не желательно совмещать с химиотерапией из-за повышения токсических реакций и сложности идентификации препарата, ставшего причиной неблагоприятных последствий.
Какая химиотерапия проводится при ВИЧ с лимфомой Ходжкина
«Золотой» стандарт 1 линии химиотерапии — комбинация противоопухолевых препаратов BEACOPP у больных СПИД чревата тяжёлыми и даже фатальными осложнениями. Поэтому проводится почти такая же результативная, но не столь агрессивная по токсическим проявлениям схема ABVD, длительность лечения зависит от исходного поражения и чувствительности опухоли к лекарствам.
Проблема в том, что комбинация ABVD совместима с очень ограниченным числом противовирусных препаратов, большая часть антиинфекционных лекарственных средств требует тщательного подбора дозы и постоянного контроля осложнений.
При лимфогранулематозе эффективно более десятка цитостатиков, вполне возможно подобрать оптимальную комбинацию, совместимую с другими лекарствами и минимальными побочными реакциями.
Какое специальное лечение может потребоваться
ЛГМ отлично отзывается на облучение опухолевых очагов, поэтому лучевая терапия по радикальной программе «с головы до ног» или только на очаги злокачественного поражения — стандартный подход, применяемый и у ВИЧ-инфицированных.
Кроме того, обязательно сопроводительное лечение, то есть использование облегчающих химиотерапию и предотвращающих токсические реакции лекарственных средств. В большинстве случаев после курса химиотерапии используются стимуляторы кроветворения, позволяющие не снижать дозы цитостатиков и не пролонгировать интервалы между курсами.
Обязательно проводится лекарственная профилактика оппортунистических для СПИД инфекций, в том числе, противотуберкулезная терапия. Только в таком случае прогноз на излечение и жизнь у инфицированного не будет отличаться от более здоровых пациентов.
Лимфома Ходжкина входит в малочисленную группу злокачественных процессов, излечиваемых только одной химиотерапией, но для такого результата необходимо лечиться в клинике, специалисты которой умеют и знают, могут и желают лечить и вылечить.
Запись на консультацию круглосуточно
+7 (495) 668-82-28
Список литературы:
- Некрасова A.В. / Онкологические заболевания у пациентов с ВИЧ-инфекцией. Взгляд клинициста// Материалы II Санкт-Петербургского форума: «Современные аспекты профилактики, диагностики и лечения ВИЧ-инфекции», 06 октября 2017 г., Санкт-Петербург
- Покровский В.В. / ВИЧ-инфекция и СПИД. Национальное руководство. М.: ГЭОТАР-Медиа, 2013
- Клиническая онкогематология. Изд. 2-е. Руководство для врачей /Под ред. проф. Волковой М.А.// М.: Медицина, 2007
- Демина Е.А., Тумян Г.С., Унукова Е.Н. с соавторами/ Современные возможности лечения первичных больных лимфомой Ходжкина и причины неудач лечения// Онкогематология, 2007; 2.
- Connors JM/ Positron Emission Tomography in the Management of Hodgkin Lymphoma// Hematology 2011.
- Lanoy E, Rosenberg P, Fily F et al./ HIV-associated Hodgkin lymphoma during the first months on combination antiretroviral therapy// Blood 2011; 118 (1).

- Deeks SG, Barré-Sinoussi F./Public health: Towards a cure for HIV// Nature 2012; 487.
Действие лимфомы | Лимфома во время беременности
Насколько распространена лимфома во время беременности?
Лимфома во время беременности диагностируется довольно редко. В развитых странах примерно у 1 из 1000 беременных женщин диагностируют рак.
Лимфома Ходжкина
Лимфома Ходжкина (ХЛ) чаще всего встречается у людей в возрасте от 15 до 34 лет (основной детородный возраст) и у лиц старше 60 лет. Она чаще встречается у беременных женщин по сравнению с неходжкинской лимфомой (НХЛ). . Примерно у 1 из 6000 беременных женщин диагностируется ЛХ.
Неходжкинская лимфома
Риск развития неходжкинской лимфомы (НХЛ) увеличивается с возрастом. Большинство людей с диагнозом старше 55 лет. Это может объяснить, почему во время беременности встречается меньше случаев НХЛ по сравнению с ЛХ.
Когда НХЛ диагностируется во время беременности, она, как правило, относится к быстрорастущему типу (высокой степени злокачественности), такому как диффузная крупноклеточная В-клеточная лимфома (ДВККЛ) или периферическая Т-клеточная лимфома (ПТКЛ).
НХЛ низкой степени злокачественности представляет собой медленно растущий тип лимфомы. Во время беременности диагностируется крайне редко.
Некоторые люди задаются вопросом, могут ли изменения гормональной или иммунной системы во время беременности быть связаны с развитием лимфомы. Нет никаких доказательств того, что это так.
Вернуться к началу
Диагностика лимфомы во время беременности
Врачи оценивают ваши симптомы и проводят анализы для постановки диагноза лимфомы.
Симптомы
Некоторые общие признаки лимфомы могут быть похожи на некоторые общие симптомы беременности, в том числе:
- пот
- боли и боли
- усталость (крайняя усталость)
- анемия (низкий уровень эритроцитов), которая может вызывать у вас чувство усталости и одышку
- тромбоцитопения (низкий уровень тромбоцитов), которая может увеличить риск образования синяков и кровотечений.
Наложение этих симптомов может задержать постановку диагноза лимфомы. Однако представляется, что у беременных женщин диагностируют лимфому на поздней стадии не чаще, чем у женщин, которые не были беременны на момент постановки диагноза.
Однако представляется, что у беременных женщин диагностируют лимфому на поздней стадии не чаще, чем у женщин, которые не были беременны на момент постановки диагноза.
На протяжении всей беременности я чувствовала себя некомфортно. Я упомянула моей акушерской бригаде и врачам о зуде и ночной потливости, но мне сказали, что это гормональное и побочное действие беременности.
Линн, пораженная лимфомой во время беременности
Анализы
Обычно для подтверждения диагноза лимфомы требуется биопсия. Это небольшая операция, которую проводят под местной или общей анестезией. Берется образец ткани (клетки вашего тела), который исследуется в лаборатории на наличие клеток лимфомы. Ни тест, ни анестетик не должны навредить вашему будущему ребенку.
Сканирование
После того, как вам сделали биопсию, врачи проводят стадирующие тесты, чтобы выяснить, где в вашем теле находится лимфома. Постановка часто включает рентген, компьютерную томографию или ПЭТ-сканирование, в которых используется радиация (вид энергии). Уровни радиации, как правило, достаточно низкие, чтобы не причинить вреда вашему ребенку; однако врачи обычно избегают использования радиации у беременных женщин. Если вы беременны, вам может быть назначено МРТ или УЗИ, ни одно из которых не использует радиацию. Вы также можете сделать рентген грудной клетки. Сканирование зависит от того, в каком триместре беременности вы находитесь. Поговорите со своим врачом, если вы беспокоитесь о тестах, в которых используется радиация.
Уровни радиации, как правило, достаточно низкие, чтобы не причинить вреда вашему ребенку; однако врачи обычно избегают использования радиации у беременных женщин. Если вы беременны, вам может быть назначено МРТ или УЗИ, ни одно из которых не использует радиацию. Вы также можете сделать рентген грудной клетки. Сканирование зависит от того, в каком триместре беременности вы находитесь. Поговорите со своим врачом, если вы беспокоитесь о тестах, в которых используется радиация.
Безопасность после сканирования
Если вы беременны, маловероятно, что вам будут проводить сканирование с использованием радиации.
Сканирование и рентген после рождения ребенка
ПЭТ-сканирование
Если вам сделали ПЭТ-сканирование, ваши врачи могут посоветовать вам избегать тесного контакта с ребенком и не кормить грудью в течение нескольких часов после этого. Это дает время для того, чтобы радиация покинула ваше тело. Поговорите со своей медицинской бригадой о том, как кормить ребенка в это время.
Компьютерная томография и рентгеновские снимки
Тесный контакт с ребенком и грудное вскармливание безопасны после компьютерной томографии и рентгеновских снимков. Излучение быстро проходит через ваше тело и не остается в грудном молоке.
Наверх
Лечение во время беременности
Ваше здоровье является приоритетом для вашей медицинской команды. Их цель — вылечить вашу лимфому или как можно дольше ограничить ее рост. Ваша медицинская команда также заботится о безопасности вашего ребенка, пока он еще находится в утробе матери и после рождения.
Ваше лечение лимфомы тщательно спланировано и зависит от нескольких факторов, в том числе:
- тип лимфомы, где она находится в вашем организме и как быстро она растет
- в каком триместре беременности вы находитесь
- ваших запросов.
Химиотерапия
Химиотерапия (лечение лекарствами, убивающими раковые клетки) часто используется для лечения лимфомы. Безопасность химиотерапии во время беременности зависит от точной комбинации препаратов (схемы), которую вы принимаете, и от того, на каком сроке беременности вы находитесь. Если вы проходите химиотерапию, ваши врачи используют вашу текущую (беременную) площадь поверхности тела для расчета дозировки.
Безопасность химиотерапии во время беременности зависит от точной комбинации препаратов (схемы), которую вы принимаете, и от того, на каком сроке беременности вы находитесь. Если вы проходите химиотерапию, ваши врачи используют вашу текущую (беременную) площадь поверхности тела для расчета дозировки.
Обратите внимание, что химиотерапевтические препараты могут присутствовать в грудном молоке. Поэтому вам следует избегать грудного вскармливания вашего ребенка во время лечения. Обратитесь к врачу за дополнительной информацией и советом, относящимся к вашей ситуации.
Врачи рекомендовали химиотерапию. Это была моя жизнь на ближайшие месяцы. Мой разум был затуманен, и я пыталась все обдумать, думая о моем новом ребенке. Хотя было много падений, я помню, что чувствовал себя сильным мысленно и заставлял себя пройти через это. Моя малышка, Саванна, была самым желанным развлечением, и я всегда называю ее своим чудом.
Лиэнн, страдающая лимфомой во время беременности
Первый триместр (первые 12 недель)
Врачи часто избегают химиотерапии в первом триместре беременности. Это когда у нерожденного ребенка (плода) развиваются основные органы, и химиотерапия может повредить этому процессу. Существует также более высокая вероятность выкидыша и мертворождения, если вы проходите химиотерапию в течение первого триместра. Риск наиболее высок в период со 2-й по 8-ю неделю беременности.
Это когда у нерожденного ребенка (плода) развиваются основные органы, и химиотерапия может повредить этому процессу. Существует также более высокая вероятность выкидыша и мертворождения, если вы проходите химиотерапию в течение первого триместра. Риск наиболее высок в период со 2-й по 8-ю неделю беременности.
По возможности врачи не назначают лечение до второго триместра. Стероиды могут быть очень эффективными в отсрочке начала химиотерапии. Эти препараты считаются безопасными на любом сроке беременности.
Если вам необходимо немедленно начать химиотерапию, ваши врачи могут посоветовать вам не продолжать беременность. Прерывание беременности по медицинским показаниям известно как «терапевтический аборт». На момент написания статьи женщины в Северной Ирландии должны ехать в Англию для терапевтического аборта; по состоянию на октябрь 2019 года для этого имеется финансирование. К апрелю 2020 года ожидается, что процедура будет доступна локально.
Терапевтический аборт может быть чрезвычайно трудным эмоционально. Доступна поддержка, например, консультации, группы поддержки и онлайн-форумы. Спросите члена вашей медицинской бригады, могут ли они направить вас в какие-либо службы поддержки.
Доступна поддержка, например, консультации, группы поддержки и онлайн-форумы. Спросите члена вашей медицинской бригады, могут ли они направить вас в какие-либо службы поддержки.
Pregnancy Choices — это организация, которая предлагает ряд услуг поддержки, включая бесплатные консультационные центры. У них есть филиалы в Англии, Шотландии и Уэльсе, а также один в Каррикфергусе, Северная Ирландия.
Второй триместр (с 13-й по 26-ю недели) и третий триместр (с 27-й недели)
В целом химиотерапия считается безопасной для женщин и нерожденных детей после первого триместра беременности. С этого момента плацента образует барьер, который препятствует попаданию многих лекарств к ребенку. Так обстоит дело с ABVD, обычным режимом для людей с лимфомой Ходжкина. Схема CHOP часто является терапией первого выбора при неходжкинской лимфоме, в том числе для беременных женщин.
Врачи обычно советуют не проходить курс химиотерапии в течение 3 недель до даты родов. Это необходимо для того, чтобы показатели крови вернулись к нормальному уровню перед родами. Ваши врачи должны учитывать это при планировании лечения.
Ваши врачи должны учитывать это при планировании лечения.
Лучевая терапия
Лучевая терапия использует вид энергии, называемый «излучение». Иногда его назначают для лечения или облегчения симптомов лимфомы. Как правило, если это вообще делается, то во время беременности лучевая терапия проводится только на шею и грудь.
Общая доза облучения, как правило, достаточно мала, чтобы не подвергать риску вашего ребенка. Тем не менее, ваши врачи могут посоветовать подождать до рождения ребенка, прежде чем начинать лучевую терапию. Если вам срочно нужно лечение, они могут посоветовать вам продолжить лечение, соблюдая меры предосторожности. Это включает в себя планирование вашего лечения, чтобы убедиться, что ваш ребенок находится на безопасном расстоянии от области вашего тела, которую лечат. В некоторых случаях они также могут использовать свинцовый фартук, чтобы защитить ребенка от радиации.
Лучевая терапия обычно представляет больший риск для развивающегося ребенка во втором и третьем триместрах беременности по сравнению с первым. Лучевая терапия, проводимая на этих более поздних сроках беременности, может увеличить риск развития у вашего ребенка лейкемии (разновидность рака крови) или солидных опухолей (опухолей, которые могут быть раковыми или доброкачественными) в течение первых 10 лет их жизни. Это также может повлиять на их умственное и физическое развитие. Ваши врачи должны поговорить с вами о возможных рисках, прежде чем вы начнете лечение.
Лучевая терапия, проводимая на этих более поздних сроках беременности, может увеличить риск развития у вашего ребенка лейкемии (разновидность рака крови) или солидных опухолей (опухолей, которые могут быть раковыми или доброкачественными) в течение первых 10 лет их жизни. Это также может повлиять на их умственное и физическое развитие. Ваши врачи должны поговорить с вами о возможных рисках, прежде чем вы начнете лечение.
Таргетные препараты
Существует множество различных типов таргетных препаратов, используемых для лечения лимфомы. Они по-разному воздействуют на процессы в клетках.
Таргетные препараты появились совсем недавно, а это означает, что у нас пока мало информации об их возможном долгосрочном воздействии на новорожденных. Большая часть имеющихся в настоящее время доказательств получена в результате исследований на животных, и результаты не обязательно будут перенесены на людей.
Ритуксимаб — это таргетный препарат, используемый для лечения некоторых типов лимфомы у взрослых. Одним из распространенных побочных эффектов является то, что он может временно снизить количество В-клеток (тип лейкоцитов, которые борются с инфекцией) в крови. Новорожденные от матерей, получавших ритуксимаб во время беременности, могут иметь меньше В-клеток при рождении. Однако их количество В-клеток (количество В-клеток) должно со временем достичь нормального уровня без долгосрочных последствий. Вашему ребенку не следует вводить живые вакцины до тех пор, пока показатели его крови не достигнут уровня, при котором это будет достаточно безопасно для него.
Одним из распространенных побочных эффектов является то, что он может временно снизить количество В-клеток (тип лейкоцитов, которые борются с инфекцией) в крови. Новорожденные от матерей, получавших ритуксимаб во время беременности, могут иметь меньше В-клеток при рождении. Однако их количество В-клеток (количество В-клеток) должно со временем достичь нормального уровня без долгосрочных последствий. Вашему ребенку не следует вводить живые вакцины до тех пор, пока показатели его крови не достигнут уровня, при котором это будет достаточно безопасно для него.
Другие возможные риски для детей, чьи матери лечатся таргетными препаратами, пока они находятся в утробе матери, включают:
- повышенный риск преждевременных родов (до 37 недель)
- низкий вес при рождении.
И то, и другое может повлиять на здоровье и развитие вашего ребенка. Ваши врачи должны поговорить с вами об этих рисках, прежде чем вы начнете лечение лимфомы.
После лечения
Во время беременности и некоторое время после нее у женщин повышен риск образования тромбов. Наличие лимфомы (или любого типа рака) еще больше увеличивает этот риск.
Наличие лимфомы (или любого типа рака) еще больше увеличивает этот риск.
Чтобы снизить риск образования тромбов, врачи могут порекомендовать вам ежедневные инъекции для разжижения крови (низкомолекулярный гепарин). Ваша медицинская бригада может научить вас, как делать эти инъекции в домашних условиях. Они также должны предоставить вам информацию о том, к кому можно обратиться, если вам понадобится помощь или совет. Инъекции полностью безопасны для будущего ребенка. Однако у матери несколько повышен риск кровотечения, например, из носа и десен. Синяки также распространены.
Поддерживающая терапия
Поддерживающая терапия проводится для облегчения симптомов лимфомы и уменьшения побочных эффектов лечения лимфомы.
Ваша медицинская бригада может посоветовать вам, какие поддерживающие процедуры безопасны для вас. Поддерживающая терапия, которая считается безопасной для будущего ребенка, включает:
- противорвотные препараты (противорвотные средства), которые назначаются для лечения тошноты и недомогания, например, во время химиотерапии
- гепарин, разжижающий кровь препарат для снижения риска образования тромбов (вероятность которых выше во время беременности и при раке)
- фактора роста, назначаемые для профилактики или лечения нейтропенического сепсиса или для повышения выработки стволовых клеток до или после трансплантации стволовых клеток.

Некоторые, но не все антибиотики считаются безопасными для приема во время беременности.
Наверх
Мы отвечаем на некоторые распространенные вопросы о лечении лимфомы во время беременности. Поговорите со своей медицинской бригадой, чтобы получить совет, относящийся к вашей ситуации.
Повлияет ли лечение во время беременности на моего ребенка в дальнейшей жизни?
Ваша медицинская бригада тщательно спланирует ваше лечение с учетом безопасности вашего ребенка. Имеющиеся данные свидетельствуют о том, что лечение лимфомы, проводимое в соответствии с рекомендациями во время беременности, вряд ли окажет долгосрочное вредное воздействие на вашего ребенка. Также маловероятно, что это повлияет на их развитие в детстве.
Безопасно ли кормить грудью во время лечения лимфомы?
Лекарственные препараты (включая химиотерапию и таргетные препараты) могут попасть в грудное молоко. Поэтому вам может быть рекомендовано не кормить грудью во время и некоторое время после лечения.
Некоторые виды стероидных препаратов считаются безопасными для приема во время грудного вскармливания.
Могу ли я принять участие в клиническом исследовании лимфомы во время беременности?
Женщин нельзя исключать из клинического исследования только потому, что они беременны. Однако забота как о своем собственном здоровье, так и о здоровье своего ребенка часто означает, что беременные или кормящие женщины не могут принимать участие.
Повлияет ли беременность на мое мировоззрение?
Беременность, по-видимому, не влияет на перспективы женщин с лимфомой, если их лечение хорошо организовано.
Исследование 449 женщин с лимфомой Ходжкина не выявило доказательств того, что беременность увеличивает риск рецидива лимфомы (рецидива) среди женщин в состоянии ремиссии (где тесты не показывают признаков лимфомы).
Как мне позаботиться о себе, если я беременна и у меня лимфома?
Справиться с лимфомой и беременностью может быть чрезвычайно сложно как физически, так и эмоционально.
Обычно ваша медицинская бригада по лечению лимфомы и дородовая бригада работают вместе, чтобы заботиться о вас. Вас также могут направить в специализированное отделение по уходу за беременными для дальнейшей поддержки.
Во избежание причинения вреда вам или вашему ребенку важно следовать советам, данным вам вашим медицинским персоналом. Прежде чем принимать какие-либо лекарства или добавки, поговорите с врачом из вашей медицинской бригады. Они могут дать вам совет о том, что вы можете сделать, чтобы чувствовать себя максимально комфортно.
Эмоциональное благополучие так же важно, как и физическое здоровье. Возможно, вам будет полезно обратиться за поддержкой, чтобы справиться со своими чувствами. Звезда мамы поддерживает женщин, у которых во время беременности диагностировали рак. У них есть онлайн-форум эмоциональной поддержки для женщин, пострадавших от рака во время беременности и вскоре после рождения ребенка.
Вы также можете подумать о том, чтобы получить дополнительную поддержку, чтобы справиться со своими чувствами. Разговорная терапия, такая как консультирование, может помочь вам справиться со своими чувствами. Существует множество различных видов консультирования, но все они направлены на то, чтобы помочь вам найти способы справиться со своими эмоциями.
Разговорная терапия, такая как консультирование, может помочь вам справиться со своими чувствами. Существует множество различных видов консультирования, но все они направлены на то, чтобы помочь вам найти способы справиться со своими эмоциями.
Если вас интересует разговорная терапия, поговорите со своим врачом, который, возможно, сможет дать вам направление в NHS. Вы также можете найти частного терапевта в вашем районе, используя онлайн-инструмент Британской ассоциации консультантов и психотерапевтов.
Вернуться к началу
Как лечить лимфому во время беременности | Кровь
Пропустить пункт назначения
Гематологические осложнения при беременности|
5 ноября 2020 г.
Кирон Данливи,
Клэр Маклинток
Кровь (2020) 136 (19): 2118–2124.
https://doi.org/10.1182/blood. 201
201
61
История статьи
Подано:
24 октября 2019 г.
Принято:
15 апреля 2020 г.
Первая редакция:
14 августа 2020 г.
Соответствующая статья была опубликована:
Как я лечу тромботическую тромбоцитопеническую пурпуру при беременности
Соответствующая статья была опубликована:
Как я лечу венозную тромбоэмболию при беременности
Соответствующая статья была опубликована:
Как я веду беременность у носителей гемофилии и больных болезнью фон Виллебранда
Посмотреть больше
Соответствующая статья была опубликована:
Введение в серию «Как я лечу» о гематологических осложнениях беременности
Посмотреть меньше
- Разделенный экран
Делиться
- Твиттер
Инструменты
Запросить разрешения
Иконка Цитировать
Цитировать
Поиск по сайту
PDF
Citation
Кирон Данливи, Клэр Маклинток; Как я лечу лимфому при беременности. Кровь 2020; 136 (19): 2118–2124. doi: https://doi.org/10.1182/blood.201
Кровь 2020; 136 (19): 2118–2124. doi: https://doi.org/10.1182/blood.201
61
Скачать файл цитирования:
- Рис (Зотеро)
- Менеджер ссылок
- EasyBib
- Подставки для книг
- Менделей
- Бумаги
- КонецПримечание
- РефВоркс
- Бибтекс
панель инструментов поиска
Visual Abstract
Посмотреть в большом размереСкачать слайд
Посмотреть в большом размереСкачать слайд
Темы:
Как я лечу,
Лимфоидная неоплазия
Лимфомы поражают все возрастные группы людей, при этом некоторые типы проявляются преимущественно у женщин у подростков и молодых людей. Часть лимфом, диагностируемых в этой демографической группе, возникает в условиях беременности. Большинство из них ведут себя агрессивно при появлении и требуют немедленного или неотложного лечения. Лечение должно учитывать здоровье как матери, так и плода, поэтому подходы к ведению зависят от гестационного возраста при диагностике и лечении, а также от сроков родов. Несмотря на недостаток литературы о том, как лечить этих пациентов, ограниченные ретроспективные отчеты демонстрируют в целом хорошие результаты и подчеркивают необходимость подхода опытной мультидисциплинарной команды к лечению.
Лечение должно учитывать здоровье как матери, так и плода, поэтому подходы к ведению зависят от гестационного возраста при диагностике и лечении, а также от сроков родов. Несмотря на недостаток литературы о том, как лечить этих пациентов, ограниченные ретроспективные отчеты демонстрируют в целом хорошие результаты и подчеркивают необходимость подхода опытной мультидисциплинарной команды к лечению.
Темы:
Как я лечу,
Лимфоидная неоплазия
Диагноз рака, как осложнение беременности, является редким явлением с частотой примерно 1 на 1000. встречающаяся с наибольшей частотой, за которой следует неходжкинская лимфома (НХЛ), большую часть которой составляет первичная медиастинальная В-клеточная лимфома (ПМВКЛ). 4,5 HL и NHL составляют примерно 6% и 5% всех видов рака, связанных с беременностью, соответственно. Диагноз лимфомы во время беременности сопряжен со многими проблемами, и при проведении оптимальной лечебной терапии необходимо учитывать уникальные риски в отношении матери и развивающегося плода. В этом отношении крайне важно, чтобы в принятии основных решений участвовала междисциплинарная команда, включающая специалистов в области медицины матери и плода, анестезиологов, неонатологов и гематологов/онкологов, имеющих опыт оказания помощи этой уникальной группе населения. Диагноз лимфомы во время беременности ставит уникальные и тонкие клинические и этические дилеммы, которые требуют тщательного обсуждения и рассмотрения наилучшего подхода к лечению, чтобы обеспечить оптимальные результаты для женщины и ее будущего ребенка. Хотя агрессивность и распространенность лимфомы являются важными факторами, определяющими необходимость срочного начала лечения, на терапевтический подход существенно влияет триместр, в котором возникает диагноз лимфомы. Учитывая редкость диагноза лимфомы во время беременности, литература о том, как лучше всего лечить эти сложные случаи, недостаточна, а проспективные исследования отсутствуют. Мы представляем 2 случая лимфомы у женщин во время беременности и обсуждаем наш подход к их лечению, учитывающий потребности матери и плода.
В этом отношении крайне важно, чтобы в принятии основных решений участвовала междисциплинарная команда, включающая специалистов в области медицины матери и плода, анестезиологов, неонатологов и гематологов/онкологов, имеющих опыт оказания помощи этой уникальной группе населения. Диагноз лимфомы во время беременности ставит уникальные и тонкие клинические и этические дилеммы, которые требуют тщательного обсуждения и рассмотрения наилучшего подхода к лечению, чтобы обеспечить оптимальные результаты для женщины и ее будущего ребенка. Хотя агрессивность и распространенность лимфомы являются важными факторами, определяющими необходимость срочного начала лечения, на терапевтический подход существенно влияет триместр, в котором возникает диагноз лимфомы. Учитывая редкость диагноза лимфомы во время беременности, литература о том, как лучше всего лечить эти сложные случаи, недостаточна, а проспективные исследования отсутствуют. Мы представляем 2 случая лимфомы у женщин во время беременности и обсуждаем наш подход к их лечению, учитывающий потребности матери и плода.
37-летняя женщина со второй продолжающейся беременностью доставлена в отделение неотложной помощи на сроке 30 недель и 6 дней (30 +6 недель) с жалобами на боль в груди и одышку в анамнезе, которые разбудили ее от спать. У нее также судороги в правой икре. В течение нескольких недель она испытывает нарастающую одышку и сердцебиение при подвижности. Она некурящая, не употребляющая алкоголь. С ребенком проблем нет, первая беременность и роды прошли без осложнений. При осмотре тахикардия 120 уд/мин, нормотензия, АД 114/60 мм рт.ст., сатурация кислорода 9.7% на комнатном воздухе, без температуры. Набухшие яремные вены отмечены с обеих сторон, болезненности грудной стенки нет. При аускультации грудной клетки выявлены хрипы в правом нижнем отделе. Тоны сердца двойные, шумов нет. У нее нет лимфаденопатии, и исследование брюшной полости показывает увеличенную матку, как и ожидалось для ее даты, без каких-либо других аномалий. Общий анализ крови в норме. Комплексная метаболическая панель в норме, за исключением повышенного уровня лактатдегидрогеназы (448 ЕД/л; референтный диапазон 120–250 ЕД/л) и С-реактивного белка (70 мг/л; референсный диапазон 1–5 мг/л). Первоначальное клиническое беспокойство по поводу легочной эмболии вызвало компьютерную томографию (КТ) и легочную ангиограмму. Это показывает большую массу средостения размером 11,5 × 8,3 × 8,3 см, вызывающую значительную обструкцию верхней полой вены и левой главной легочной артерии и сужение левых верхних долевых бронхов (рис. 1A-B). Отмечается небольшой перикардиальный выпот. Дифференциальный диагноз включает лимфому с другими возможными новообразованиями тимуса, тератомами или злокачественными новообразованиями щитовидной железы. Выполняется биопсия медиастинального образования под контролем КТ, которая подтверждает фокальные области, демонстрирующие пролиферацию средних и крупных лимфоидных клеток. Большие лимфоидные клетки положительны по CD20, CD79.a и PAX5, а также BCL6 и имеют слабое окрашивание BCL2. CD23 и CD30 демонстрируют слабую очаговую положительную реакцию в больших клетках, а CD10, CD15, MUM1, циклин D1 и гибридизация вируса Эпштейна-Барр in situ (ISH) являются отрицательными.
Первоначальное клиническое беспокойство по поводу легочной эмболии вызвало компьютерную томографию (КТ) и легочную ангиограмму. Это показывает большую массу средостения размером 11,5 × 8,3 × 8,3 см, вызывающую значительную обструкцию верхней полой вены и левой главной легочной артерии и сужение левых верхних долевых бронхов (рис. 1A-B). Отмечается небольшой перикардиальный выпот. Дифференциальный диагноз включает лимфому с другими возможными новообразованиями тимуса, тератомами или злокачественными новообразованиями щитовидной железы. Выполняется биопсия медиастинального образования под контролем КТ, которая подтверждает фокальные области, демонстрирующие пролиферацию средних и крупных лимфоидных клеток. Большие лимфоидные клетки положительны по CD20, CD79.a и PAX5, а также BCL6 и имеют слабое окрашивание BCL2. CD23 и CD30 демонстрируют слабую очаговую положительную реакцию в больших клетках, а CD10, CD15, MUM1, циклин D1 и гибридизация вируса Эпштейна-Барр in situ (ISH) являются отрицательными. Пролиферативная фракция Ki67 составляет 60%. Исследования флуоресцентной гибридизации in situ не выявили перестройки MYC, BCL2 или BCL6. Патологические особенности соответствуют диагнозу ПМВКЛ.
Пролиферативная фракция Ki67 составляет 60%. Исследования флуоресцентной гибридизации in situ не выявили перестройки MYC, BCL2 или BCL6. Патологические особенности соответствуют диагнозу ПМВКЛ.
Рис. 1.
Просмотреть в большом формате Загрузить PPT
Случай 1 пациента с первичной медиастинальной В-клеточной лимфомой на 31 недель беременности. (A) КТ грудной клетки в коронарном срезе с контрастированием при постановке диагноза, до лечения. Иллюстрирует значительное сдавление ВПВ опухолевой массой (внутри пунктирных линий) справа и демонстрирует протяженность массы также слева выше легочной артерии (ЛА). (B) КТ грудной клетки в поперечном срезе с контрастированием при постановке диагноза, до лечения. Иллюстрирует степень опухолевой массы переднего средостения. КТ показала возможный перикардиальный выпот среднего размера, обнаруженный при эхокардиографии как небольшой выпот. (C) КТ грудной клетки в корональном срезе с контрастированием по завершении лечения. ВПВ нормального калибра с периферически вставленным центральным катетером (PICC) на месте. Небольшой объем остаточной опухоли (в пределах пунктирных линий). Последующее сканирование ПЭТ-КТ не показало активности, подтверждающей полный метаболический ответ.
ВПВ нормального калибра с периферически вставленным центральным катетером (PICC) на месте. Небольшой объем остаточной опухоли (в пределах пунктирных линий). Последующее сканирование ПЭТ-КТ не показало активности, подтверждающей полный метаболический ответ.
Рисунок 1.
Просмотреть в большом формате Загрузить PPT
Случай 1: пациентка с первичной медиастинальной В-клеточной лимфомой на сроке беременности 31 90 349 недель. (A) КТ грудной клетки в коронарном срезе с контрастированием при постановке диагноза, до лечения. Иллюстрирует значительное сдавление ВПВ опухолевой массой (внутри пунктирных линий) справа и демонстрирует протяженность массы также слева выше легочной артерии (ЛА). (B) КТ грудной клетки в поперечном срезе с контрастированием при постановке диагноза, до лечения. Иллюстрирует степень опухолевой массы переднего средостения. КТ показала возможный перикардиальный выпот среднего размера, обнаруженный при эхокардиографии как небольшой выпот. (C) КТ грудной клетки в корональном срезе с контрастированием по завершении лечения. ВПВ нормального калибра с периферически вставленным центральным катетером (PICC) на месте. Небольшой объем остаточной опухоли (в пределах пунктирных линий). Последующее сканирование ПЭТ-КТ не показало активности, подтверждающей полный метаболический ответ.
(C) КТ грудной клетки в корональном срезе с контрастированием по завершении лечения. ВПВ нормального калибра с периферически вставленным центральным катетером (PICC) на месте. Небольшой объем остаточной опухоли (в пределах пунктирных линий). Последующее сканирование ПЭТ-КТ не показало активности, подтверждающей полный метаболический ответ.
Близкий модальный анализ
Стадирование лимфомы во время беременности
Методы определения стадии лимфомы включают КТ, 18 Позитронно-эмиссионную томографию с F-фтордезоксиглюкозой (ФДГ-ПЭТ) и, реже, магнитно-резонансную томографию всего тела (МРТ) ). Сведение к минимуму воздействия ионизирующего излучения на плод целесообразно, учитывая, что не существует определенного безопасного уровня с учетом его канцерогенного риска. 6 Дозы облучения плода и матери при общих исследованиях стадирования приведены в Таблице 1. Доза облучения может быть описана либо как доза, доставленная в ткань, обычно указывается в миллигреях, либо как эффективная доза облучения, указывается в миллизивертах, который описывает биологический эффект доставленного излучения и зависит от типа излучения и подвергаемой облучению ткани. 7 МРТ всего тела часто используется в качестве альтернативы ПЭТ-КТ, поскольку она не подвергает женщину или плод потенциально вредному ионизирующему излучению. Заболевание средостения можно оценить с помощью КТ, а МРТ без гадолиния является предпочтительным методом визуализации брюшной полости и таза.
7 МРТ всего тела часто используется в качестве альтернативы ПЭТ-КТ, поскольку она не подвергает женщину или плод потенциально вредному ионизирующему излучению. Заболевание средостения можно оценить с помощью КТ, а МРТ без гадолиния является предпочтительным методом визуализации брюшной полости и таза.
Таблица 1.
Дозы облучения плода и матери при общестадийных исследованиях
| Исследование . | Эффективная доза облучения плода (мЗв) . | Эффективная доза облучения матери (мЗв) . |
|---|---|---|
| Chest X-ray | 0.0005-0.01 | 0.02 |
| CT chest | 0.01-0.66 | 4-18 |
| CT pulmonary angiogram | 0.01-0.66 | 13- 40 |
| КТ органов брюшной полости и таза | 13-25 | 3-45 |
| Nuclear medicine | ||
| 18 FDG-PET | 1. 4-5.2 4-5.2 | 3-9 |
| 18 FDG-PET/CT | 10-22 | 13-32 |
| Whole body MRI | None | None |
| Abdominal ultrasound | None | None |
| Расследование . | Эффективная доза облучения плода (мЗв) . | Эффективная доза облучения матери (мЗв) . |
|---|---|---|
| Chest X-ray | 0.0005-0.01 | 0.02 |
| CT chest | 0.01-0.66 | 4-18 |
| CT pulmonary angiogram | 0.01-0.66 | 13- 40 |
| КТ брюшной полости и таза | 13-25 | 3-45 |
| Nuclear medicine | ||
| 18 FDG-PET | 1. 4-5.2 4-5.2 | 3-9 |
| 18 FDG -PET/CT | 10-22 | 13-32 |
| Whole body MRI | None | None |
| Abdominal ultrasound | None | None |
Эффективные дозы облучения при радиологических исследованиях обычно используются для определения стадии лимфомы. 8,35-37
View Large
Радиофармпрепарат, используемый в ПЭТ-визуализации, проникает через плаценту, и доза облучения плода выше в первом и втором триместрах. 8 Преимущества ФДГ-ПЭТ по сравнению с КТ при постановке диагноза ограничены, и его основная клиническая ценность заключается в завершении терапии и промежуточной оценке. Это противоречит его рутинному использованию во время постановки диагноза, и, поскольку большинство женщин будут в послеродовом периоде на момент окончания оценки терапии, это ограничивает воздействие на плод дополнительного облучения. 9 Мы рекомендуем избегать ПЭТ во время беременности и заменять ее МРТ или обычной рентгенографией грудной клетки для (промежуточной) оценки состояния средостения. Если необходимы оценки костного мозга и/или спинномозговой жидкости, их следует проводить в соответствии с рекомендациями для небеременных пациентов.
9 Мы рекомендуем избегать ПЭТ во время беременности и заменять ее МРТ или обычной рентгенографией грудной клетки для (промежуточной) оценки состояния средостения. Если необходимы оценки костного мозга и/или спинномозговой жидкости, их следует проводить в соответствии с рекомендациями для небеременных пациентов.
Оптимальное время для начала терапии
Хотя некоторые виды рака, которые могут возникнуть во время беременности, имеют медленное клиническое течение и, следовательно, могут не нуждаться в неотложном лечении, это обычно не относится к лимфоме. Наш пациент имеет симптоматику большого образования в средостении с симптомами и признаками обструкции верхней полой вены (ВПВ), и поэтому требует немедленного начала лечения. Кесарево сечение (КС) или индукция родов возможны в третьем триместре; тем не менее, необходимо тщательно учитывать время родов, чтобы максимально увеличить зрелость плода и, насколько это возможно, избежать преждевременных родов (до 37 недель беременности), которые подвергают младенца более высокому риску осложнений. Кратковременные осложнения включают респираторный дистресс-синдром, внутрижелудочковое кровоизлияние, сепсис и перинатальную смертность, а долгосрочные осложнения включают церебральный паралич, хроническое заболевание легких и ретинопатию недоношенных. Осложнения чаще встречаются у детей, рожденных очень недоношенными и с задержкой роста, но даже у детей, рожденных поздно (между 34 нед и 36, +6 недель гестации) имеют более высокие показатели неонатальных осложнений, проблем с питанием и гипогликемии. 10 Возможные осложнения недоношенности являются аргументом против немедленной индукции родов или кесарева сечения перед введением химиотерапии у нашей пациентки со сроком беременности 31 неделя.
Кратковременные осложнения включают респираторный дистресс-синдром, внутрижелудочковое кровоизлияние, сепсис и перинатальную смертность, а долгосрочные осложнения включают церебральный паралич, хроническое заболевание легких и ретинопатию недоношенных. Осложнения чаще встречаются у детей, рожденных очень недоношенными и с задержкой роста, но даже у детей, рожденных поздно (между 34 нед и 36, +6 недель гестации) имеют более высокие показатели неонатальных осложнений, проблем с питанием и гипогликемии. 10 Возможные осложнения недоношенности являются аргументом против немедленной индукции родов или кесарева сечения перед введением химиотерапии у нашей пациентки со сроком беременности 31 неделя.
Проведение химиотерапии беременной женщиной, что подвергает ее ребенка потенциальным осложнениям, связанным с этими агентами, должно быть сбалансировано с очень реальными рисками, связанными с недоношенностью. Принято считать, что химиотерапевтические агенты вызывают нейтропению и подавление иммунитета у плода, и рекомендуется отложить роды на 3 недели после введения химиотерапии, чтобы избежать родов, когда у ребенка будет иммунодефицит. На практике это обычно означает, что большинству женщин химиотерапия не будет проводиться после 34 недель беременности. Важно обсудить предпочтения женщины в отношении родов и просмотреть ее предыдущий акушерский анамнез, особенно историю преждевременных родов.
На практике это обычно означает, что большинству женщин химиотерапия не будет проводиться после 34 недель беременности. Важно обсудить предпочтения женщины в отношении родов и просмотреть ее предыдущий акушерский анамнез, особенно историю преждевременных родов.
Дополнительным риском является наличие приближающейся ВПВ и обструкции дыхательных путей. Если требуется КС, хотя нейроаксиальная анестезия обычно эффективна, может потребоваться общая анестезия, и у этой женщины наличие надвигающейся ВПВ и обструкции дыхательных путей делает введение общего анестетика чрезвычайно опасным.
В описанном случае мы выступаем за планирование родов, как только это станет безопасным с минимальным риском для плода и матери. Полная диагностика и стадирование были завершены к 33 неделе беременности. Проведение первого цикла химиотерапии имело бы преимущество в виде уменьшения размера большой массы средостения и уменьшения обструкции ВПВ и дыхательных путей. Это сделало бы роды более безопасными для женщины и обеспечило бы зрелость плода при ограниченном воздействии иммунохимиотерапии. Роды после 36 недель гестации сопряжены с низким риском осложнений недоношенности, и целью должно быть время введения химиотерапии для планирования родов после этой гестации.
Роды после 36 недель гестации сопряжены с низким риском осложнений недоношенности, и целью должно быть время введения химиотерапии для планирования родов после этой гестации.
Какую терапию следует использовать?
Поскольку ПМВКЛ является относительно редким и недавно описанным отдельным клинико-патологическим состоянием по классификации Всемирной организации здравоохранения, существует мало проспективных исследований и нет рандомизированных проспективных испытаний, чтобы определить, каким должен быть оптимальный подход. Хотя когда-то это заболевание рассматривалось как разновидность диффузной крупноклеточной В-клеточной лимфомы (ДВККЛ), оно клинически и молекулярно сильно отличается от других типов ДВККЛ. 11 Фактически, его клинические и биологические характеристики гораздо больше напоминают классическую лимфому Ходжкина (cHL). 12,13 Ранние исследования заболевания, хотя и ретроспективные сравнения, показали, что режимы с более высокой интенсивностью доз, чем циклофосфамид, доксорубицин, винкристин и преднизолон (CHOP), были связаны с улучшением выживаемости, и, следовательно, они были разработаны для PMBCL. Важная роль интенсивности дозы неудивительна, учитывая тесную биологическую связь PMBCL с cHL, где более высокая интенсивность дозы полезна для некоторых пациентов с высоким риском. Одно одноцентровое проспективное исследование и крупное многоцентровое ретроспективное исследование продемонстрировали высокую эффективность, которая устранила необходимость в лучевой терапии по схеме дозирования этопозида, преднизолона, винкристина, циклофосфамида, этопозида и ритуксимаба (DA-EPOCH-R). 14,15 Признавая, что прямого сравнения DA-EPOCH-R и ритуксимаба + CHOP (R-CHOP; стандартная схема при ДВККЛ) в отношении ПМККЛ не проводилось, но была достигнута высокая эффективность одной группы по сравнению с первой схемой, мы будет способствовать назначению DA-EPOCH-R для ПМВКЛ в третьем триместре. Этопозид, как и большинство других препаратов, не был хорошо изучен при беременности, но ограниченный ретроспективный опыт его применения, особенно в третьем триместре, позволяет предположить, что он безопасен.
Важная роль интенсивности дозы неудивительна, учитывая тесную биологическую связь PMBCL с cHL, где более высокая интенсивность дозы полезна для некоторых пациентов с высоким риском. Одно одноцентровое проспективное исследование и крупное многоцентровое ретроспективное исследование продемонстрировали высокую эффективность, которая устранила необходимость в лучевой терапии по схеме дозирования этопозида, преднизолона, винкристина, циклофосфамида, этопозида и ритуксимаба (DA-EPOCH-R). 14,15 Признавая, что прямого сравнения DA-EPOCH-R и ритуксимаба + CHOP (R-CHOP; стандартная схема при ДВККЛ) в отношении ПМККЛ не проводилось, но была достигнута высокая эффективность одной группы по сравнению с первой схемой, мы будет способствовать назначению DA-EPOCH-R для ПМВКЛ в третьем триместре. Этопозид, как и большинство других препаратов, не был хорошо изучен при беременности, но ограниченный ретроспективный опыт его применения, особенно в третьем триместре, позволяет предположить, что он безопасен. Другие подходы, более интенсивные, чем R-CHOP, такие как ритуксимаб + доксорубицин, циклофосфамид, виндезин, блеомицин и преднизолон (R-ACVBP), успешно применялись у молодых небеременных пациенток, но, насколько нам известно, ретроспективных данных об их эффективности мало. использование при беременности. Решение о том, какой режим использовать, является более сложным в более ранних триместрах, как обсуждалось в контексте случая 2. Локальная лучевая терапия используется крайне редко при лечении синдрома ВПВ в контексте лимфомы, учитывая ее чувствительность к стероидам и химиотерапии; мы бы рекомендовали их использование после постановки диагноза. Для большинства пациенток с ДВККЛ во время беременности мы рекомендуем терапию R-CHOP. 16 В негестационном периоде В-клеточная лимфома высокой степени злокачественности с хромосомными перестройками MYC и BCL2 и/или BCL6 редко встречается у более молодых пациенток, и может помочь альтернативный подход. Это не должно быть исключением в условиях беременности.
Другие подходы, более интенсивные, чем R-CHOP, такие как ритуксимаб + доксорубицин, циклофосфамид, виндезин, блеомицин и преднизолон (R-ACVBP), успешно применялись у молодых небеременных пациенток, но, насколько нам известно, ретроспективных данных об их эффективности мало. использование при беременности. Решение о том, какой режим использовать, является более сложным в более ранних триместрах, как обсуждалось в контексте случая 2. Локальная лучевая терапия используется крайне редко при лечении синдрома ВПВ в контексте лимфомы, учитывая ее чувствительность к стероидам и химиотерапии; мы бы рекомендовали их использование после постановки диагноза. Для большинства пациенток с ДВККЛ во время беременности мы рекомендуем терапию R-CHOP. 16 В негестационном периоде В-клеточная лимфома высокой степени злокачественности с хромосомными перестройками MYC и BCL2 и/или BCL6 редко встречается у более молодых пациенток, и может помочь альтернативный подход. Это не должно быть исключением в условиях беременности.
Случай 1, последующее наблюдение
После постановки диагноза пациентка изначально получала высокие дозы стероидов для лечения синдрома ВПВ. Затем она получила свой первый цикл терапии DA-EPOCH-R по телефону 33 +3 9.0335 недель беременности и перенесла очень хорошо. Дополнительно вводили рост колониестимулирующий фактор без осложнений. МРТ грудной клетки была проведена через 2 недели и показала уменьшение размеров образования средостения до 8,6 × 4,5 × 5,4 см со значительным улучшением ВПВ и компрессии дыхательных путей. Роды были индуцированы в сроке 35 +5 недель, и у нашей пациентки были неосложненные вагинальные роды у здоровой девочки (масса тела при рождении 2585 г), без неонатальных осложнений. Она получила второй цикл DA-EPOCH-R на 22-й день в соответствии со схемой химиотерапии без осложнений на четвертый послеродовой день и впоследствии завершила в общей сложности 6 циклов терапии. КТ и ФДГ-ПЭТ были выполнены по завершении терапии, показывая значительное уменьшение опухоли на КТ (рис. 1С) и полный метаболический ответ на ФДГ-ПЭТ, и ей не потребовалось облучение средостения. Она остается в полной ремиссии при последнем наблюдении.
1С) и полный метаболический ответ на ФДГ-ПЭТ, и ей не потребовалось облучение средостения. Она остается в полной ремиссии при последнем наблюдении.
38-летняя женщина в возрасте 12 +4 недель беременности при третьей беременности поступила в отделение неотложной помощи с жалобами на тупую центральную боль в груди в течение 2 часов, которая прекратилась по прибытии. Ее первая беременность была неосложненной, с вагинальными родами на 41 неделе беременности. За несколько месяцев до этой презентации ее вторая беременность закончилась выкидышем на 6 неделе гестации. У нее нет истории лихорадки, ночной потливости или потери веса. Рентгенограмма грудной клетки показывает выраженную аномалию сердечно-медиастинального контура с отпечатком большой массы переднего средостения. Последующая КТ грудной клетки показывает большое инфильтративное образование в переднем средостении размером 17,6 × 90,8 × 8,8 см, окружающие, но не сдавливающие сосуды средостения, но инфильтрирующие предтрахеальное пространство. Нет перикардиального выпота и нет надключичной, подмышечной или внутригрудной лимфаденопатии. Кроме того, нет очаговой легочной аномалии и плевральной жидкости. Общий анализ крови в норме, отмечается повышение С-реактивного белка до 53 мг/л (референсный диапазон 1-5 мг/л) и лактатдегидрогеназы до 292 ЕД/л (референтный диапазон 120-250 ЕД/л). ). Выполнена пункционная биопсия новообразования, которая демонстрирует участки ткани, преимущественно фиброзные, с рассеянными лимфоидными скоплениями, сосредоточенными в очагах гранулематозного воспаления. Гранулемы связаны со сгруппированными эозинофилами, некоторые из которых дегранулированы. Присутствует умеренное количество крупных клеток с гиперхромными ядрами и выраженными эозинофильными ядрышками с умеренным количеством амфофильной цитоплазмы. Присутствовали клетки Рида-Штернберга, а фоновые лимфоциты выявляли смесь лимфоцитов малого и среднего размера без атипичных признаков и плазматических клеток, присутствующих в очень небольшом количестве.
Нет перикардиального выпота и нет надключичной, подмышечной или внутригрудной лимфаденопатии. Кроме того, нет очаговой легочной аномалии и плевральной жидкости. Общий анализ крови в норме, отмечается повышение С-реактивного белка до 53 мг/л (референсный диапазон 1-5 мг/л) и лактатдегидрогеназы до 292 ЕД/л (референтный диапазон 120-250 ЕД/л). ). Выполнена пункционная биопсия новообразования, которая демонстрирует участки ткани, преимущественно фиброзные, с рассеянными лимфоидными скоплениями, сосредоточенными в очагах гранулематозного воспаления. Гранулемы связаны со сгруппированными эозинофилами, некоторые из которых дегранулированы. Присутствует умеренное количество крупных клеток с гиперхромными ядрами и выраженными эозинофильными ядрышками с умеренным количеством амфофильной цитоплазмы. Присутствовали клетки Рида-Штернберга, а фоновые лимфоциты выявляли смесь лимфоцитов малого и среднего размера без атипичных признаков и плазматических клеток, присутствующих в очень небольшом количестве. Крупные клетки положительны по CD30, CD15, PAX5 и MUM1 и отрицательны по ALK, ISH вируса Эпштейна-Барр, CD23, CD20, CD3, CD68 и CKAE1/AE3. Малые фоновые лимфоциты представляют собой преимущественно Т-лимфоциты, положительные по CD3. Окрашивание панцитокератином выделяет эпителиальные элементы тимуса, инфильтрированные опухолевой популяцией. Внешний вид и иммунный профиль соответствуют узловому склерозирующему подтипу HL. У нее нет заболевания за пределами средостения на МРТ, и, следовательно, изолированное объемное заболевание средостения расслаивает ее на раннюю стадию неблагоприятной ЛХ.
Крупные клетки положительны по CD30, CD15, PAX5 и MUM1 и отрицательны по ALK, ISH вируса Эпштейна-Барр, CD23, CD20, CD3, CD68 и CKAE1/AE3. Малые фоновые лимфоциты представляют собой преимущественно Т-лимфоциты, положительные по CD3. Окрашивание панцитокератином выделяет эпителиальные элементы тимуса, инфильтрированные опухолевой популяцией. Внешний вид и иммунный профиль соответствуют узловому склерозирующему подтипу HL. У нее нет заболевания за пределами средостения на МРТ, и, следовательно, изолированное объемное заболевание средостения расслаивает ее на раннюю стадию неблагоприятной ЛХ.
Ведение лимфомы на ранних сроках беременности
Органогенез продолжается в эмбрионе до 10 недель беременности (8 недель после зачатия), поэтому существует более высокая вероятность тератогенного действия лекарств или облучения до завершения этого периода. Фетальная фаза начинается с 10-й недели беременности и продолжается до рождения, при этом продолжается рост и созревание сформированных органов, а воздействие лекарственных препаратов на этой стадии может привести к ограничению роста, но, как правило, не к грубым структурным аномалиям. Некоторые органы с потенциально более высокой уязвимостью к химиотерапии включают центральную нервную систему, систему кроветворения и глаза, но в целом введение химиотерапии во втором и третьем триместре считается относительно безопасным. 17,18 Однако, как и другие препараты, химиотерапия может повлиять на функциональность органов плода. В 1 большом опубликованном (ретроспективном) опыте лимфомы во время беременности (90 женщин; таблица 2) у 11 пациенток был диагностирован в первом триместре, и из них 6 беременностей были прерваны для немедленной химиотерапии. 19 В этой же серии медиана гестационного возраста для женщин (n = 56), получавших антенатальную терапию, составила 22 недели. Комбинированную химиотерапию назначали 89% женщин, из них 37 (66%) получали терапию во втором триместре. Терапия была отложена у 28 (33%) женщин до послеродового периода, диагноз был поставлен в среднем на 30-й неделе беременности. Не было повышенного количества осложнений беременности, таких как преждевременные роды, преждевременная индукция родов, преждевременный разрыв плодных оболочек или преэклампсия у женщин, получавших антенатальную терапию по сравнению с отсроченной (постнатальной) терапией.
Некоторые органы с потенциально более высокой уязвимостью к химиотерапии включают центральную нервную систему, систему кроветворения и глаза, но в целом введение химиотерапии во втором и третьем триместре считается относительно безопасным. 17,18 Однако, как и другие препараты, химиотерапия может повлиять на функциональность органов плода. В 1 большом опубликованном (ретроспективном) опыте лимфомы во время беременности (90 женщин; таблица 2) у 11 пациенток был диагностирован в первом триместре, и из них 6 беременностей были прерваны для немедленной химиотерапии. 19 В этой же серии медиана гестационного возраста для женщин (n = 56), получавших антенатальную терапию, составила 22 недели. Комбинированную химиотерапию назначали 89% женщин, из них 37 (66%) получали терапию во втором триместре. Терапия была отложена у 28 (33%) женщин до послеродового периода, диагноз был поставлен в среднем на 30-й неделе беременности. Не было повышенного количества осложнений беременности, таких как преждевременные роды, преждевременная индукция родов, преждевременный разрыв плодных оболочек или преэклампсия у женщин, получавших антенатальную терапию по сравнению с отсроченной (постнатальной) терапией. Медиана массы тела при рождении была аналогичной, но наблюдалась тенденция к рождению детей с малым весом для гестационного возраста у женщин, получавших антенатальную химиотерапию. Этот набор данных не выявил значительного увеличения заболеваемости или смертности плода в лечебном учреждении во втором и третьем триместрах. 20,21 Другое недавнее исследование, в котором приняли участие 134 беременные женщины с ЛХ, показало, что выживаемость не отличалась между беременными и небеременными женщинами, но частота преждевременных родов и разрыва плодных оболочек была выше у пациенток с ЛХ, получавших антенатальную терапию, по сравнению со случаями, когда она была отсрочена. до послеродового. 22 Назначение химиотерапии в первом триместре недостаточно изучено, и результаты, вероятно, сильно зависят от срока гестации, поскольку это период основного органогенеза. Для пациенток с диагнозом ЛХ в конце I триместра (как в нашем случае) при далеко зашедшей симптоматике заболевания целесообразно срочное начало терапии (или с небольшой отсрочкой начала во II триместре).
Медиана массы тела при рождении была аналогичной, но наблюдалась тенденция к рождению детей с малым весом для гестационного возраста у женщин, получавших антенатальную химиотерапию. Этот набор данных не выявил значительного увеличения заболеваемости или смертности плода в лечебном учреждении во втором и третьем триместрах. 20,21 Другое недавнее исследование, в котором приняли участие 134 беременные женщины с ЛХ, показало, что выживаемость не отличалась между беременными и небеременными женщинами, но частота преждевременных родов и разрыва плодных оболочек была выше у пациенток с ЛХ, получавших антенатальную терапию, по сравнению со случаями, когда она была отсрочена. до послеродового. 22 Назначение химиотерапии в первом триместре недостаточно изучено, и результаты, вероятно, сильно зависят от срока гестации, поскольку это период основного органогенеза. Для пациенток с диагнозом ЛХ в конце I триместра (как в нашем случае) при далеко зашедшей симптоматике заболевания целесообразно срочное начало терапии (или с небольшой отсрочкой начала во II триместре).
Таблица 2.
Избранные ретроспективные исследования исходов у женщин с лимфомой, диагностированной во время беременности
| Авторы . | Исследуемая популяция . | Т1, Т2 и Т3 . | Исход/выживание . | Внутриутробная заболеваемость/смертность . |
|---|---|---|---|---|
| Evens et al 19 | 90 пациентов: HL:50; НХЛ: 40 | Т1, 12% | 3-летняя ВБП и ОС: 53% и 82% для НХЛ и 85% и 97% для ЛХ соответственно | Доношенная беременность в 56% случаев; роды в среднем 37 недель; индукция родов в 33%; 6 пациентов подверглись плановому прерыванию |
| Т2, 58% | ||||
| Т3, 38% | ||||
| НХЛ 8 | Т1, 8% | 5-летняя ВБП и ОС: 75% и 82% соответственно | Роды в среднем 37 недель; 3 пациента подверглись плановому прерыванию; no fetal abnormalities were observed | |
| T2, 67% | ||||
| T3, 25% | ||||
| Maggen et al 22 | 134 patients with HL | 5-y PFS and OS: 82. 6% и 97,3% для ранней стадии ЛХ и 90,9% и 100% для прогрессирующей ЛХ соответственно 6% и 97,3% для ранней стадии ЛХ и 90,9% и 100% для прогрессирующей ЛХ соответственно | Преждевременные схватки (12%) и разрыв плодных оболочек (5%), выше у пациенток, получающих дородовое лечение |
| Авторы . | Исследуемая популяция . | Т1, Т2 и Т3 . | Исход/выживание . | Внутриутробная заболеваемость/смертность . | |
|---|---|---|---|---|---|
| Evens et al 19 | 90 пациентов: HL:50; НХЛ: 40 | Т1, 12% | 3-летняя ВБП и ОС: 53% и 82% для НХЛ и 85% и 97% для ЛХ соответственно | Доношенная беременность в 56% случаев; роды в среднем 37 недель; индукция родов в 33%; 6 пациентов подверглись плановому прерыванию | |
| Т2, 58% | |||||
| Т3, 38% | |||||
| НХЛ 8 | T1, 8% | 5-летняя ВБП и ОВ: 75% и 82% соответственно | Роды в среднем 37 недель; 3 пациента подверглись плановому прерыванию; аномалий развития плода не наблюдалось | ||
| T2, 67% | |||||
| T3, 25% | |||||
| Maggen et al 22 | 134 пациентов с HL | 134 пациентов с HL | 134 пациентов с HL | . стадия ЛХ и 90,9% и 100% для запущенной ЛХ соответственно стадия ЛХ и 90,9% и 100% для запущенной ЛХ соответственно | Преждевременные схватки (12%) и разрыв плодных оболочек (5%), выше у пациенток, получающих антенатальное лечение |
ЛХ, лимфома Ходжкина; НХЛ неходжкинская лимфома; ОС, общая выживаемость; PFS, выживаемость без прогрессирования; Т1, первый триместр; Т2, второй триместр; Т3, третий триместр.
View Large
Выбор тактики лечения ЛХ
Адриамицин, блеомицин, винбластин и дакарбазин (ABVD), вводимые каждые 2 недели, являются наиболее часто используемой схемой лечения ЛХ во время беременности. 23 В нескольких отчетах показано, что его можно безопасно вводить во втором и третьем триместрах. Для пациентов с поздней стадией заболевания альтернативы, такие как брентуксимаб с AVD (отказ от блеомицина) или эскалация блеомицина, этопозид, доксорубицин, циклофосфамид, винкристин, прокарбазин и преднизолон, могут быть рассмотрены для лечения ЛХ вне беременности. 24 Однако они значительно более токсичны, чем ABVD, опыт использования этих платформ во время беременности недостаточен, и поэтому мы рекомендуем избегать их использования во время беременности на данном этапе. Для новых препаратов, таких как брентуксимаб, нет данных об их применении во время беременности, а их потенциальные тератогенные и токсические эффекты неизвестны. 25,26 С точки зрения продолжительности терапии, для пациентов с благоприятным исходом на ранней стадии может быть целесообразна более короткая продолжительность ABVD, а для пациентов с поздней стадией, у которых заболевание не проявляется после 2 циклов, блеомицин при ABVD может быть отменен, если временно Результаты ПЭТ отрицательные. 27,28 Опыт использования облучения в качестве терапевтического средства для лечения лимфомы во время беременности ограничен. Мы обсудим его использование ниже, но в этой ситуации мы предпочитаем избегать его антенатального использования, за исключением исключительных обстоятельств.
24 Однако они значительно более токсичны, чем ABVD, опыт использования этих платформ во время беременности недостаточен, и поэтому мы рекомендуем избегать их использования во время беременности на данном этапе. Для новых препаратов, таких как брентуксимаб, нет данных об их применении во время беременности, а их потенциальные тератогенные и токсические эффекты неизвестны. 25,26 С точки зрения продолжительности терапии, для пациентов с благоприятным исходом на ранней стадии может быть целесообразна более короткая продолжительность ABVD, а для пациентов с поздней стадией, у которых заболевание не проявляется после 2 циклов, блеомицин при ABVD может быть отменен, если временно Результаты ПЭТ отрицательные. 27,28 Опыт использования облучения в качестве терапевтического средства для лечения лимфомы во время беременности ограничен. Мы обсудим его использование ниже, но в этой ситуации мы предпочитаем избегать его антенатального использования, за исключением исключительных обстоятельств.
Случай 2 последующее наблюдение
После того, как диагноз был подтвержден, и после тщательного консультирования и возможности для женщины и ее семьи обсудить последствия терапии, наша пациентка решила продолжить химиотерапию ABVD. Решающее значение для ее решения имело то, что она понимала, что, выбрав продолжение беременности, она получит стандартный рекомендуемый режим химиотерапии, который обеспечит наилучшие шансы на излечение, но в то же время маловероятно, что он окажет негативное влияние на здоровье. своего будущего ребенка. Она получила свою первую дозу ABVD в 15 9 лет.0334 +4 недель гестации и перенесла хорошо, без существенных осложнений. Она продолжала получать ABVD-терапию каждые 2 недели на протяжении всей беременности, и промежуточная рентгенограмма грудной клетки показала значительное уменьшение размера образования средостения. Из-за токсичности, озноба и болей при химиотерапии она остановилась после 5 циклов ABVD. У нее был спонтанный разрыв плодных оболочек на сроке 37 +1 недель гестации, после чего произошли неосложненные вагинальные роды здорового мальчика (масса тела при рождении 419 г).5 г), неонатальных осложнений не было. ФДГ-ПЭТ/КТ сканирование, выполненное после завершения терапии, показало полную метаболическую ремиссию, и пациент остается здоровым без каких-либо признаков заболевания при самом последнем последующем наблюдении.
У нее был спонтанный разрыв плодных оболочек на сроке 37 +1 недель гестации, после чего произошли неосложненные вагинальные роды здорового мальчика (масса тела при рождении 419 г).5 г), неонатальных осложнений не было. ФДГ-ПЭТ/КТ сканирование, выполненное после завершения терапии, показало полную метаболическую ремиссию, и пациент остается здоровым без каких-либо признаков заболевания при самом последнем последующем наблюдении.
Из ограниченного ряда исследований, которые рассматривали этот вопрос, Т-клеточные лимфомы составляют значительную часть НХЛ, возникающих во время беременности. Принципы лечения Т-клеточных лимфом, диагностированных во время беременности, такие же, как обсуждалось выше для двух наших случаев; однако, когда эти заболевания возникают в этой возрастной группе, проявления, как правило, очень агрессивны, требуют неотложной химиотерапии, и часто необходимы интенсивные режимы с несколькими агентами, что повышает риск осложнений для матери и плода. Это также относится к лимфоме Беркитта, диагностированной во время беременности. Другими более редкими лимфомами, которые встречаются в этих условиях, являются фолликулярная лимфома и другие индолентные лимфомы, такие как ассоциированная со слизистой оболочкой лимфоидно-ассоциированная лимфома: эти заболевания, как правило, имеют гораздо менее агрессивные проявления при постановке диагноза, и в большинстве случаев их можно лечить с помощью выжидательной тактики. подход. Мы бы не рекомендовали обширное рентгенологическое исследование этих заболеваний, если они диагностированы во время беременности, и его следует отложить (как и терапию, если это возможно) до послеродового периода.
Это также относится к лимфоме Беркитта, диагностированной во время беременности. Другими более редкими лимфомами, которые встречаются в этих условиях, являются фолликулярная лимфома и другие индолентные лимфомы, такие как ассоциированная со слизистой оболочкой лимфоидно-ассоциированная лимфома: эти заболевания, как правило, имеют гораздо менее агрессивные проявления при постановке диагноза, и в большинстве случаев их можно лечить с помощью выжидательной тактики. подход. Мы бы не рекомендовали обширное рентгенологическое исследование этих заболеваний, если они диагностированы во время беременности, и его следует отложить (как и терапию, если это возможно) до послеродового периода.
Роль лучевой терапии в этой возрастной группе пациентов с диагнозом агрессивной лимфомы, как правило, заключается в улучшении локализованного контроля заболевания в случае ранней стадии заболевания и иногда в паллиативных целях. Хотя исторические данные показали, что введение наддиафрагмального облучения с экранированием брюшной полости и таза может быть безопасным и выполнимым методом, учитывая высокую эффективность только системной терапии и хотя ограниченные данные о ее безопасности в этой ситуации, мы рекомендуем избегать облучения. по возможности и, при необходимости, откладывание его применения на послеродовой период. 29
по возможности и, при необходимости, откладывание его применения на послеродовой период. 29
Ритуксимаб, моноклональное антитело к CD20, является неотъемлемым компонентом лечебной терапии агрессивных В-клеточных лимфом. Его использование широко описано в литературе для лечения беременных женщин с лимфомой и аутоиммунными заболеваниями. Его связь с гипогаммаглобулинемией предполагает, что он потенциально может увеличить частоту неонатальных инфекций, но это не было четко продемонстрировано. 30 Мы рекомендуем всегда использовать его в условиях, когда он может повысить эффективность химиотерапии. Брентуксимаб ведотин, конъюгат антитело-лекарственное средство, в настоящее время одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для лечения первой линии ЛХ, но в настоящее время отсутствуют данные о безопасности его воздействия на плод, и мы поэтому не одобряйте его использование во время беременности. Мы не обсуждали так подробно лечение рецидивирующей и рефрактерной лимфомы во время беременности, поскольку она встречается крайне редко. Учитывая это, а также множество различных вариантов лечения по сравнению с впервые диагностированной ситуацией, каждый случай следует рассматривать индивидуально с учетом вышеупомянутых подходов к лечению лимфомы во время беременности.
Учитывая это, а также множество различных вариантов лечения по сравнению с впервые диагностированной ситуацией, каждый случай следует рассматривать индивидуально с учетом вышеупомянутых подходов к лечению лимфомы во время беременности.
Гранулоцитарный колониестимулирующий фактор (Г-КСФ) часто используется у пациентов, получающих определенные схемы химиотерапии. Модели на животных позволяют предположить, что Г-КСФ проникает через плаценту и вызывает нейтрофилию, но его использование во время беременности не связано с неблагоприятными исходами. 31 Международный регистр женщин, получавших Г-КСФ во время беременности по поводу тяжелой хронической нейтропении, не сообщил об увеличении частоты неблагоприятных исходов. 32 Его использование во втором и третьем триместрах считается безопасным, но его следует избегать или использовать с большой осторожностью в первом триместре, учитывая недостаточность доступных данных. Развитие венозной тромбоэмболии чаще встречается при беременности, и диагноз рака является дополнительным фактором риска для этого. Мы не рекомендуем однозначно профилактику венозной тромбоэмболии, и решение о ее назначении и типе профилактики должны приниматься в соответствии с рекомендациями, недавно опубликованными Американским обществом гематологов. 33 Во время химиотерапии по типичным схемам для ЛХ и распространенных типов НХЛ, наблюдаемых в этой возрастной группе, обычно назначают несколько поддерживающих препаратов. К ним относятся антагонисты рецепторов серотонина 5-HT 3 , такие как ондансетрон, ингибиторы протонной помпы, такие как омепразол или пантопразол, и антигистаминные препараты у пациентов, получающих факторы роста. Следует внимательно отнестись к назначению других классов препаратов, и мы рекомендуем проконсультироваться с фармацевтом, знакомым с акушерскими назначениями. Ни один класс препаратов не следует назначать, если польза не превышает потенциальный риск.
Мы не рекомендуем однозначно профилактику венозной тромбоэмболии, и решение о ее назначении и типе профилактики должны приниматься в соответствии с рекомендациями, недавно опубликованными Американским обществом гематологов. 33 Во время химиотерапии по типичным схемам для ЛХ и распространенных типов НХЛ, наблюдаемых в этой возрастной группе, обычно назначают несколько поддерживающих препаратов. К ним относятся антагонисты рецепторов серотонина 5-HT 3 , такие как ондансетрон, ингибиторы протонной помпы, такие как омепразол или пантопразол, и антигистаминные препараты у пациентов, получающих факторы роста. Следует внимательно отнестись к назначению других классов препаратов, и мы рекомендуем проконсультироваться с фармацевтом, знакомым с акушерскими назначениями. Ни один класс препаратов не следует назначать, если польза не превышает потенциальный риск.
Рекомендуемые варианты сохранения фертильности у женщин, получающих химиотерапию, включают замораживание эмбрионов и яйцеклеток. 34 Эффективность методов защиты яичников, таких как аналоги гонадотропин-рилизинг-гормона и гормональная супрессия, неизвестна, и они обычно не рекомендуются. Достижения в области криоконсервации и трансплантации ткани яичников продолжаются, но не хватает зрелых данных для руководства их применением. Эти варианты не были доступны ни для одной из представленных женщин, потому что беременность не позволяла использовать эти методы для сохранения фертильности.
34 Эффективность методов защиты яичников, таких как аналоги гонадотропин-рилизинг-гормона и гормональная супрессия, неизвестна, и они обычно не рекомендуются. Достижения в области криоконсервации и трансплантации ткани яичников продолжаются, но не хватает зрелых данных для руководства их применением. Эти варианты не были доступны ни для одной из представленных женщин, потому что беременность не позволяла использовать эти методы для сохранения фертильности.
Нет данных о повышенном риске рецидива в этой популяции. Визуализация послеродового наблюдения при последующем наблюдении не должна отличаться от других параметров и соответствовать Национальной комплексной онкологической сети или другим аналогичным руководствам. Последующее наблюдение за выживаемостью также должно быть аналогичным.
Лимфома, возникающая во время беременности, представляет собой уникальное заболевание, при котором для оптимального лечения требуется тесное сотрудничество междисциплинарной команды, включающей специалистов по гинекологии, анестезиологов и гематолога/онколога, имеющих опыт лечения лимфоидных заболеваний. Несмотря на ограниченный ретроспективный опыт, исходы для матери и плода у большинства женщин с диагнозом лимфома во время беременности превосходны, а стандартная лечебная терапия по большей части хорошо переносится. Одними из самых сложных задач являются лечение лимфомы в первом триместре и выбор оптимального времени родов в третьем триместре. Поскольку новые агенты все более широко используются в лечении лимфомы, жизненно важно собрать данные об опыте и безопасности их использования во время беременности, чтобы информировать о будущем лечении этой популяции пациентов.
Несмотря на ограниченный ретроспективный опыт, исходы для матери и плода у большинства женщин с диагнозом лимфома во время беременности превосходны, а стандартная лечебная терапия по большей части хорошо переносится. Одними из самых сложных задач являются лечение лимфомы в первом триместре и выбор оптимального времени родов в третьем триместре. Поскольку новые агенты все более широко используются в лечении лимфомы, жизненно важно собрать данные об опыте и безопасности их использования во время беременности, чтобы информировать о будущем лечении этой популяции пациентов.
Добавил: К.Д. и К.М. написал рецензию и утвердил окончательный вариант рукописи.
Раскрытие информации о конфликте интересов: Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Для переписки: Claire McLintock, Women’s HealthNB, городская больница Окленда, Grafton Rd, Auckland 1143, Новая Зеландия; электронная почта: [email protected].
1.
Ван Калстерен
K
,
Heyns
L
,
De Smet
F
и др.
Рак во время беременности: анализ 215 пациенток с акцентом на акушерские и неонатальные исходы
.
Дж Клин Онкол
.
2010
;
28
(
4
):
683
—
689
.
2.
Lee
YY
,
Робертс
CL
,
Доббинс
T
, и др.
Заболеваемость и исходы рака, связанного с беременностью, в Австралии, 1994–2008 гг. : популяционное исследование связей
: популяционное исследование связей
.
БДЖОГ
.
2012
;
119
(
13
):
1572
—
1582
.
3.
Амант
F
,
Ванденбрук
T
,
Verheecke
M
и др.;
Международная сеть по раку, бесплодию и беременности (INCIP)
.
Исходы у детей после рака матери, диагностированного во время беременности
.
N Engl J Med
.
2015
;
373
(
19
):
1824
—
1834
.
4.
9.
Гематологический рак во время беременности
.
Ланцет
.
2012
;
379
(
9815
):
580
—
587
.
5.
Данливи
К
,
Гросс
ТГ
.
Ведение агрессивных В-клеточных НХЛ в популяции AYA: взгляд взрослых и детей
.
Кровь
.
2018
;
132
(
4
):
369
—
375
.
6.
Гольдберг-Штайн
S
,
Лю
B
,
Хан
0209,
Ли
СИ
.
КТ тела во время беременности: тенденции использования, показания для обследования и дозы облучения плода
.
AJR Am J Рентгенол
.
2011
;
196
(
1
):
146
—
151
.
7.
Лоу
S
.
Диагностическая визуализация при беременности: принятие обоснованных решений
.
Акушерство Мед
.
2019
;
12
(
3
):
116
—
122
.
8.
Zanotti-Fregonara
P
,
Stabin
MG
.
Новые дозы облучения плода для 18 Ф-ФДГ на основе данных о людях
.
Дж Нукл Мед
.
2017
;
58
(
11
):
1865
—
1866
.
9.
Кобе
C
,
Дитлайн
M
,
Хеллвиг
5
4 D 9.0
ПЭТ/КТ для оценки ответа после лечения лимфомы при лимфоме Ходжкина и диффузной В-крупноклеточной лимфоме
.
Семин Нукл Мед
.
2018
;
48
(
1
):
28
—
36
.
10.
Манук
ТА
,
Рис
ММ
,
Бейлит
Заболеваемость и смертность недоношенных новорожденных по гестационному возрасту: современная когорта
.
Am J Obstet Gynecol
.
2016
;
215
(
1
):
e1
—
e14
.
11.
Данливи
К
.
Первичная медиастинальная В-клеточная лимфома: биология и разработка терапевтических стратегий
.
Гематология Am Soc Hematol Educ Program
.
2017
;
2017
:
298
—
303
.
12.
Розенвальд
А
,
Райт
Г
,
Лерой
Молекулярная диагностика первичной В-клеточной лимфомы средостения позволяет выявить клинически благоприятную подгруппу диффузной крупноклеточной В-клеточной лимфомы, связанной с лимфомой Ходжкина
.
J Exp Med
.
2003
;
198
(
6
):
851
—
862
.
13.
Мотток
А
,
Райт
Г
,
Розенвальд
А
Молекулярная классификация первичной крупноклеточной В-клеточной лимфомы средостения с использованием общедоступных образцов тканей
.
Кровь
.
2018
;
132
(
22
):
2401
—
2405
.
14.
Dunleavy
K
,
Pittaluga
S
,
Maeda
LS
, et al.
Терапия EPOCH-ритуксимабом с поправкой на дозу при первичной медиастинальной В-клеточной лимфоме
.
N Engl J Med
.
2013
;
368
(
15
):
1408
—
1416
.
15.
Giulino-Roth
L
,
O’Donohue
T
,
Chen
Z
, et al.
Исходы у взрослых и детей с первичной медиастинальной В-клеточной лимфомой, получавших EPOCH-R с поправкой на дозу
.
Br J Гематол
.
2017
;
179
(
5
):
739
—
747
.
16.
Bartlett
NL
,
Wilson
WH
,
Jung
9 ,
Jung
9 ,
5 ,
EPOCH-R с поправкой на дозу по сравнению с R-CHOP в качестве передовой терапии диффузной крупноклеточной В-клеточной лимфомы: клинические результаты фазы III межгруппового исследования Alliance/CALGB 50303
.
Дж Клин Онкол
.
2019
;
37
(
21
):
1790
—
1799
.
17.
Перег
Д
,
Корень
Г
,
Лишнер
М
Лечение лимфомы Ходжкина и неходжкинской лимфомы у беременных
.
Гематологические
.
2007
;
92
(
9
):
1230
—
1237
.
18.
Кардоник
E
,
Якобуччи
A
.
Применение химиотерапии во время беременности человека
.
Ланцет Онкол
.
2004
;
5
(
5
):
283
—
291
.
19.
Эвены
АМ
,
Адвани
Р
,
Пресс
9et
OW
Лимфома, возникшая во время беременности: антенатальная терапия, осложнения и материнская выживаемость в многоцентровом анализе
.
Дж Клин Онкол
.
2013
;
31
(
32
):
4132
—
4139
.
20.
Пинникс
CC
,
Осборн
EM
,
Чихара
.
Исходы для матери и плода после лечения лимфомы Ходжкина или неходжкинской лимфомы, диагностированной во время беременности
.
JAMA Oncol
.
2016
;
2
(
8
):
1065
—
1069
.
21.
Бачанова
В
,
Коннорс
ДМ
.
Лимфома Ходжкина при беременности
.
Curr Hematol Malig Rep
.
2013
;
8
(
3
):
211
—
217
.
22.
Магген
C
,
Dierickx
D
,
Lugtenburg
P
и др.;
Международная сеть по вопросам рака, бесплодия и беременности
.
Акушерские и материнские исходы у пациенток с диагнозом лимфома Ходжкина во время беременности: многоцентровое ретроспективное когортное исследование
.
Ланцет Гематол
.
2019
;
6
(
11
):
e551
—
e561
.
23.
Pinnix
CC
,
Androas
TY
,
Milgrom
S
,
4955
MA
209.
Лечение лимфомы при беременности
.
Curr Hematol Malig Rep
.
2017
;
12
(
3
):
251
—
256
.
24.
Галламини
А
,
Тарелла
С
,
Вивиани
С. и др.
Ранняя интенсификация химиотерапии с эскалацией BEACOPP у пациентов с далеко зашедшей стадией лимфомы Ходжкина с положительным результатом промежуточной позитронно-эмиссионной томографии/компьютерной томографии после двух циклов ABVD: отдаленные результаты исследования GITIL/FIL HD 0607
.
Дж Клин Онкол
.
2018
;
36
(
5
):
454
—
462
.
25.
Connors
JM
,
Jurczak
W
,
Straus
DJ
, et al;
ЭШЕЛОН-1 Учебная группа
.
Брентуксимаб ведотин с химиотерапией при лимфоме Ходжкина III или IV стадии
.
N Engl J Med
.
2018
;
378
(
4
):
331
—
344
.
26.
Ramchandren
R
,
Advani
RH
,
Ansell
SM
, et al.
Брентуксимаб ведотин плюс химиотерапия у североамериканских субъектов с недавно диагностированной лимфомой Ходжкина III или IV стадии
.
Клиника рака Res
.
2019
;
25
(
6
):
1718
—
1726
.
27.
Straus
DJ
,
Jung
SH
,
Кувшин
CALGB 50604: адаптированное к риску лечение необъемной лимфомы Ходжкина на ранней стадии на основе промежуточной ПЭТ
.
Кровь
.
2018
;
132
(
10
):
1013
—
1021
.
28.
Barrington
SF
,
Kirkwood
AA
,
Franceschetto
A
, et al.
ПЭТ-КТ для определения стадии и раннего ответа: результаты исследования Response-Adapted Therapy in Advanced Hodgkin Lymphoma
.
Кровь
.
2016
;
127
(
12
):
1531
—
1538
.
29.
Mazonakis
M
,
Varveris
H
,
Fasoulaki
M
,
Damilakis
,
,
4 9000 40005
,
4 9000 40005
,
4 9000 40005
.
Лучевая терапия болезни Ходжкина на ранних сроках беременности: измерение дозы на эмбрион
.
Радиотер Онкол
.
2003
;
66
(
3
):
333
—
339
.
30.
Робертс
DM
,
Джонс
РБ
,
Смит
РМ
Ритуксимаб-ассоциированная гипогаммаглобулинемия: частота, предикторы и исходы у пациентов с мультисистемным аутоиммунным заболеванием
.
J Аутоиммунный
.
2015
;
57
:
60
—
65
.
31.
Medlock
ES
,
Kaplan
DL
,
Cecchini
M
,
Ulich
TR
,
del Castillo
J
,
Андресен
Дж
.
Гранулоцитарный колониестимулирующий фактор проникает через плаценту и стимулирует гранулопоэз плода крысы
.
Кровь
.
1993
;
81
(
4
):
916
—
922
.
32.
Boxer
LA
,
Bolyard
AA
,
Kelley
ML 9
Применение гранулоцитарного колониестимулирующего фактора при беременности у женщин с хронической нейтропенией
.
Акушерство Гинекол
.
2015
;
125
(
1
):
197
—
203
.
33.
Бейтс
СМ
,
Раджасекхар
А
,
Мидделдорп
5 С
5
и др.
Рекомендации Американского общества гематологов по лечению венозной тромбоэмболии 2018 г. : венозная тромбоэмболия в контексте беременности
: венозная тромбоэмболия в контексте беременности
.
Blood Adv
.
2018
;
2
(
22
):
3317
—
3359
.
34.
Октай
К
,
Харви
БЭ
,
Куропатка
AH
и др.
Сохранение фертильности у больных раком: обновленное руководство по клинической практике ASCO
.
Дж Клин Онкол
.
2018
;
36
(
19
):
1994
—
2001
.
35.
Костелло
JE
,
Чекава
ND
,
Такер
JE
,
Бау
JL
.
Доза облучения при КТ: текущие споры и стратегии снижения дозы
.
AJR Am J Рентгенол
.
2013
;
201
(
6
):
1283
—
1290
.
36.
Пахаде
Дж.К.
,
Литманович
D
,
Pedrosa
I
,
Romero
J
,
Bankier
AA
,
Boiselle
209
209
209
209
209
209
2099
2.
,
Инициативы в области качества: визуализация беременных с подозрением на тромбоэмболию легочной артерии: что нужно знать радиологу
.
Рентгенография
.
2009
;
29
(
3
):
639
—
654
.
37.
Tirada
N
,
Dreizin
D
,
Khati
NJ
,
Akin
EA
,
Zeman
RK
.
Визуализация беременных и кормящих женщин
.
Рентгенография
.
2015
;
35
(
6
):
1751
—
1765
.
Войдите через свое учреждение
Материнская химиотерапия ABVD лимфомы Ходжкина при дихориальной диамниотической беременности: клинический случай | BMC Беременность и роды
- История болезни
- Открытый доступ
- Опубликовано:
- Camille Cotteret 1 ,
- Yen-Vi Pham 1 ,
- Ambroise Marcais 2 ,
- Marine Driessen 3 ,
- Salvatore Cisternino 1,4 &
- …
- Джоэль Шлаттер 1
BMC Беременность и роды
том 20 , Номер статьи: 231 (2020)
Процитировать эту статью
2166 доступов
6 цитирований
1 Альтметрический
Детали показателей
Abstract
Исходная информация
Лимфома Ходжкина (HL) является наиболее частым гематологическим злокачественным новообразованием во время беременности. Терапией первой линии при ЛХ во время беременности является стандартная схема ABVD без каких-либо препаратов и/или коррекции дозы. Однако данные о химиотерапии во время беременности двойней немногочисленны, и необходимо лучшее понимание механизмов воздействия и токсического действия противоопухолевых препаратов на плод.
Терапией первой линии при ЛХ во время беременности является стандартная схема ABVD без каких-либо препаратов и/или коррекции дозы. Однако данные о химиотерапии во время беременности двойней немногочисленны, и необходимо лучшее понимание механизмов воздействия и токсического действия противоопухолевых препаратов на плод.
Описание клинического случая
41-летняя беременная с дихориальным диамниозом получила лечение ABVD по поводу ЛХ в сроке гестации 28 недель и 3 дней. Пациент получил 2 цикла химиотерапии с 15-дневным терапевтическим окном, включая реальную дозу доксорубицина 25 мг/м 2 на цикл. В отличие от близнеца женского пола, у близнеца мужского пола через четыре дня после рождения развилась дисфункция левого сердца. Кардиотоксичность доксорубицина у новорожденных мужского пола также подтверждалась высоким уровнем тропонина в крови. В возрасте одного месяца результаты эхокардиографии были нормальными. Мы изучили литературные данные о физиологических аспектах беременности, которые могут влиять на фармакокинетику доксорубицина, а также фармакодинамические и фармакокинетические данные о применении доксорубицина во время беременности. Мы подробно описали роль транспортеров в распределении доксорубицина через плаценту и попытались понять, почему был затронут только один плод.
Мы подробно описали роль транспортеров в распределении доксорубицина через плаценту и попытались понять, почему был затронут только один плод.
Выводы
Безопасность плода зависит, по крайней мере, от фармакокинетики доксорубицина у матери. Из-за лекарственных взаимодействий (т. е. метаболизма и транспорта лекарств) всегда следует соблюдать осторожность, чтобы избежать вариабельности фармакокинетики у матери. Токсические эффекты у дизиготных близнецов различались, что свидетельствует о дополнительных специфических для плода фармакокинетических/фармакодинамических факторах токсичности доксорубицина.
Отчеты экспертной оценки
История вопроса
Хотя одновременное возникновение рака и беременности является редким медицинским событием, гематологические злокачественные новообразования, такие как лимфома Ходжкина (ЛХ), возникают примерно в 1/6000 беременностей, что составляет 3% всех пациентов с ЛХ [1,2,3, 4,5,6,7]. Во Франции число новых случаев ЛХ оценивается примерно в 2000 в год, причем 45% из них затрагивают женщин [8]. Стадия заболевания помогает определить подходящее лечение. Для лечения поздних стадий (IIБ, III и IV) во время беременности наилучшим терапевтическим выбором считается схема АБВД (доксорубицин, блеомицин, винбластин и дакарбазин), обеспечивающая хорошую общую выживаемость и низкую токсичность для плода [9].,10,11,12]. Не было предложено единого мнения о лечении ЛХ стадии IA и IIA во время беременности, но рекомендуется отложить химиотерапию до родов [11, 12]. Терапевтическое решение также зависит от гестационного возраста и развития плода. Лечение токсичности ABVD требует учета физиологических изменений во время беременности, которые влияют на фармакокинетику препарата. Однако, исходя из ограниченных клинических данных об адаптации химиотерапии во время беременности, стандартный протокол ABVD остается текущим методом лечения ЛХ во время беременности в Северной Америке и Европе [13, 14].
Во Франции число новых случаев ЛХ оценивается примерно в 2000 в год, причем 45% из них затрагивают женщин [8]. Стадия заболевания помогает определить подходящее лечение. Для лечения поздних стадий (IIБ, III и IV) во время беременности наилучшим терапевтическим выбором считается схема АБВД (доксорубицин, блеомицин, винбластин и дакарбазин), обеспечивающая хорошую общую выживаемость и низкую токсичность для плода [9].,10,11,12]. Не было предложено единого мнения о лечении ЛХ стадии IA и IIA во время беременности, но рекомендуется отложить химиотерапию до родов [11, 12]. Терапевтическое решение также зависит от гестационного возраста и развития плода. Лечение токсичности ABVD требует учета физиологических изменений во время беременности, которые влияют на фармакокинетику препарата. Однако, исходя из ограниченных клинических данных об адаптации химиотерапии во время беременности, стандартный протокол ABVD остается текущим методом лечения ЛХ во время беременности в Северной Америке и Европе [13, 14]. Небольшая серия случаев и ретроспективные исследования беременных, получавших лечение по поводу ЛХ, показали, что доксорубицин безопасен для сердца плода при введении во втором и третьем триместре [9]., 12, 15,16,17]. Но они сообщили, что доксорубицин при беременности может уменьшать толщину стенки левого желудочка, не вызывая пороков сердца или функциональных нарушений [15].
Небольшая серия случаев и ретроспективные исследования беременных, получавших лечение по поводу ЛХ, показали, что доксорубицин безопасен для сердца плода при введении во втором и третьем триместре [9]., 12, 15,16,17]. Но они сообщили, что доксорубицин при беременности может уменьшать толщину стенки левого желудочка, не вызывая пороков сердца или функциональных нарушений [15].
В этой статье мы сообщаем о случае дизиготной беременности двойней, осложненной ЛХ, при которой введение ABVD было связано с обратимой сердечной дисфункцией только у одного из близнецов.
Представление клинического случая
41-летняя женщина, беременная двойней, поступила в наше отделение гематологии на сроке гестации 27 недель с диагнозом ЛХ IIA стадии. Анамнез заболевания начался с синдрома полой вены в сочетании с правой надключичной лимфаденопатией до 3 см. Сканирование органов грудной клетки, брюшной полости и малого таза показало компрессионное образование в переднем средостении диаметром 16 см, а биопсия лимфатических узлов подтвердила диагноз классической ЛХ. CRAT (Французский справочный центр по тератогенным веществам) утверждает, что если обследование необходимо для обеспечения наилучшей диагностики/лечения пациента, оно может быть проведено с соблюдением защитных мер в специализированном отделении. Уровни радиации были ниже максимально рекомендуемых во время беременности [18]. Курс кортикостероидов (преднизолон 80 мг/день, а затем 40 мг/день) был начат во время постановки диагноза. Трансторакальная эхокардиография и электрокардиограмма матери были нормальными. При трансабдоминальной эхографии плодов в сроках гестации 18 нед и 4 дня и 22 недели и 3 дня морфологическое исследование было нормальным. Сердце было в нормальном положении, и у каждого из близнецов было четыре уравновешенных сердечных полости. Пересечение крупных сосудов в норме. Нарушений сердечного ритма не обнаружено. При поступлении пациента результаты цитологического исследования, анализа мочи и гемостаза были в пределах нормы. Междисциплинарная группа (гематологи и акушеры) решила начать химиотерапию на основе протокола ABVD при сроке беременности 28 недель и 3 дня.
CRAT (Французский справочный центр по тератогенным веществам) утверждает, что если обследование необходимо для обеспечения наилучшей диагностики/лечения пациента, оно может быть проведено с соблюдением защитных мер в специализированном отделении. Уровни радиации были ниже максимально рекомендуемых во время беременности [18]. Курс кортикостероидов (преднизолон 80 мг/день, а затем 40 мг/день) был начат во время постановки диагноза. Трансторакальная эхокардиография и электрокардиограмма матери были нормальными. При трансабдоминальной эхографии плодов в сроках гестации 18 нед и 4 дня и 22 недели и 3 дня морфологическое исследование было нормальным. Сердце было в нормальном положении, и у каждого из близнецов было четыре уравновешенных сердечных полости. Пересечение крупных сосудов в норме. Нарушений сердечного ритма не обнаружено. При поступлении пациента результаты цитологического исследования, анализа мочи и гемостаза были в пределах нормы. Междисциплинарная группа (гематологи и акушеры) решила начать химиотерапию на основе протокола ABVD при сроке беременности 28 недель и 3 дня. Пациент получил 2 цикла химиотерапии в 15-дневных амбулаторных условиях (табл. 1). Во время каждого амбулаторного гематологического сеанса доксорубицин 25 мг/м 2 , блеомицин 10 мг/м 2 , винбластин 6 мг/м 2 , дакарбазин 375 мг/м 2 (ABVD) и дексаметазон 10 мг. Больной получал такие препараты, как ондансетрон (8 мг 2 раза в сутки), преднизолон (40 мг в сутки с момента постановки диагноза до 1 недели после первой ABVD), эноксапарин (4000 МЕ 2 раза в сутки), лансопразол (30 мг 1 раз в сутки) и валацикловир (500 мг 1 раз в сутки). Преждевременный преждевременный разрыв плодных оболочек (ПРПО) произошел в тот же день, что и завершение второго цикла ABVD, что соответствует гестационному возрасту 32 недели и 4 дня. Она была госпитализирована в родильное отделение для наблюдения и получала антибиотики, амоксициллин и стероиды для созревания легких плода. Признаков хориоамнионита на тот момент не обнаружено (схваток нет, признаков воспаления в образце крови нет, тахикардии плода нет).
Пациент получил 2 цикла химиотерапии в 15-дневных амбулаторных условиях (табл. 1). Во время каждого амбулаторного гематологического сеанса доксорубицин 25 мг/м 2 , блеомицин 10 мг/м 2 , винбластин 6 мг/м 2 , дакарбазин 375 мг/м 2 (ABVD) и дексаметазон 10 мг. Больной получал такие препараты, как ондансетрон (8 мг 2 раза в сутки), преднизолон (40 мг в сутки с момента постановки диагноза до 1 недели после первой ABVD), эноксапарин (4000 МЕ 2 раза в сутки), лансопразол (30 мг 1 раз в сутки) и валацикловир (500 мг 1 раз в сутки). Преждевременный преждевременный разрыв плодных оболочек (ПРПО) произошел в тот же день, что и завершение второго цикла ABVD, что соответствует гестационному возрасту 32 недели и 4 дня. Она была госпитализирована в родильное отделение для наблюдения и получала антибиотики, амоксициллин и стероиды для созревания легких плода. Признаков хориоамнионита на тот момент не обнаружено (схваток нет, признаков воспаления в образце крови нет, тахикардии плода нет). У нее спонтанно начались роды в 33 недели, и было выполнено кесарево сечение из-за недоношенности и многоплодной беременности. Латентный период, от PPROM до родов, по-видимому, короче у близнецов по сравнению с одноплодной беременностью. В большинстве исследований сообщается о средней латентности менее 24 часов [19].].
У нее спонтанно начались роды в 33 недели, и было выполнено кесарево сечение из-за недоношенности и многоплодной беременности. Латентный период, от PPROM до родов, по-видимому, короче у близнецов по сравнению с одноплодной беременностью. В большинстве исследований сообщается о средней латентности менее 24 часов [19].].
Таблица 1 Протокол ABVD, применяемый к беременным женщинам-двойняшкам
Полноразмерная таблица
Первым родившимся близнецом был мальчик весом 2030 г (50-й процентиль) и размером 48 см. Окружность головы 31,5 см, оценка по шкале Апгар 9/10/10, рН пуповины 7,32. У новорожденного было нормальное дыхание (45 вдохов/мин), ЧСС 150 уд/мин. Анализ крови был нормальным, гемоглобин 18 г/дл и тромбоциты 328 000/мм 3 . Во избежание преждевременного апноэ вводили внутривенно нагрузочную и поддерживающую дозу кофеина (5 мг/кг/день). Новорожденный дышал спонтанно, без апноэ и брадикардии. Через 4 дня после родов контрольное эхокардиографическое исследование выявило незначительную дисфункцию левых отделов сердца с сохраненной фракцией выброса (СН 9 баллов). 0273 p EF) на уровне 48%, что связано с высокой концентрацией тропонина (Tn1: 103 нг/л; эталон: < 26 нг/л). Были даны рекомендации кардиолога, терапия не начата, но начато медицинское наблюдение. Когда ему был один месяц, результаты эхокардиографии были нормальными с пограничной ФВ ЛЖ на уровне 50% без легочной артериальной гипертензии. Дальнейшее измерение тропонина не проводилось. После исключительно парентерального питания в течение 4 дней постепенно вводили пероральное питание с полной автономией на 17-й день. Неврологическое исследование было нормальным.
0273 p EF) на уровне 48%, что связано с высокой концентрацией тропонина (Tn1: 103 нг/л; эталон: < 26 нг/л). Были даны рекомендации кардиолога, терапия не начата, но начато медицинское наблюдение. Когда ему был один месяц, результаты эхокардиографии были нормальными с пограничной ФВ ЛЖ на уровне 50% без легочной артериальной гипертензии. Дальнейшее измерение тропонина не проводилось. После исключительно парентерального питания в течение 4 дней постепенно вводили пероральное питание с полной автономией на 17-й день. Неврологическое исследование было нормальным.
Вторым близнецом была девочка весом 1785 г (25-й процентиль) и ростом 42 см при рождении. Окружность головы 32 см; Оценка по шкале Апгар 9/10/10, рН пуповины 7,32. Анализ крови был нормальным, гемоглобин 19,2 г/дл, тромбоциты 310 000/мм 3 . При рождении результаты эхокардиографии были нормальными, ФВ ЛЖ > 55%. Неврологическое исследование было нормальным.
Для матери 18 F-FDG ПЭТ и TDM сканирование были выполнены через 20 дней и выявили полную метаболическую ремиссию. Ей было проведено еще 6 циклов ABVD для консолидации.
Ей было проведено еще 6 циклов ABVD для консолидации.
Обсуждение и выводы
Приведен случай дизиготной беременности двойней, осложненной ЛХ. В 32 недели и 4 дня диагностирован преждевременный разрыв плодных оболочек. Применение ABVD было связано с обратимой сердечной дисфункцией только у одного из близнецов. Магген и др. сообщили в многоцентровом когортном исследовании, что 3% из 123 детей, рожденных от матерей с диагнозом ЛХ, имели при рождении серьезные врожденные аномалии (синдактилия, дефект межпредсердной перегородки) и 3% — незначительные аномалии. Они также сообщили, что у матерей, получавших пренатальную химиотерапию, было больше акушерских осложнений (преждевременные схватки, преждевременный разрыв плодных оболочек) [20]. Во время беременности фармакокинетика препарата может быть изменена физиологическими изменениями матери. Таким образом, может быть затронуто распределение и/или элиминация препарата у матери. Действительно, концентрация альбумина в материнской сыворотке снижается от значения до беременности 45,8 г/л (7,6%) до 37,6 г/л (10%) в 34 недели и 31,5 г/л (17%) в 40 недель беременности. 21, 22]. Увеличение внутрисосудистой и экстраваскулярной жидкости частично объясняет наблюдаемую во время беременности гипоальбуминемию со значительным увеличением общего количества воды в организме [23]. Гипоальбуминемия может увеличить свободную плазменную фракцию лекарств и изменить их распределение в тканях. Однако низкое связывание доксорубицина с белками сыворотки (~ 75%) ограничивает такие вариации в распределении доксорубицина.
21, 22]. Увеличение внутрисосудистой и экстраваскулярной жидкости частично объясняет наблюдаемую во время беременности гипоальбуминемию со значительным увеличением общего количества воды в организме [23]. Гипоальбуминемия может увеличить свободную плазменную фракцию лекарств и изменить их распределение в тканях. Однако низкое связывание доксорубицина с белками сыворотки (~ 75%) ограничивает такие вариации в распределении доксорубицина.
Активность CYP2D6 и CYP3A4 увеличивается до 35% во втором и третьем триместрах [24]. Клиренс доксорубицина (субстрат CYP3A4 и CYP2D6) в основном включает метаболизм в печени и выведение через желчные протоки [21]. Однако в некоторых сообщениях о клиренсе доксорубицина во время беременности содержатся противоречивые результаты о влиянии беременности на метаболизм доксорубицина и изменения в желчевыделении [22, 25, 26, 27]. Доксорубицин, низкомолекулярный (544 г/моль) амфифильный препарат, также известен как субстрат карбонилредуктаз CBR1 и CBR3, которые превращают доксорубицин в доксорубицинол, активный и токсичный метаболит, и другие ферменты, продуцирующие некоторые неактивные метаболиты (например, агликоны, глюкурониды и сульфаты) [28,29,30]. Доксорубицин более сильно влияет на систолическую и диастолическую функции сердца, чем доксорубицин [31]. Кардиотоксичность снижается за счет снижения уровня циркулирующего доксорубицинола посредством ингибирования CBR1 [32]. Образование доксорубицинола находится под контролем экспрессии AKR1C3, CBR1 и CBR3 [33]. Насколько нам известно, нет данных о влиянии изменений их экспрессии или активности во время беременности. Однако количество доксорубицинола, выраженное как отношение его концентраций в плазме, представленное как площадь под кривой (AUC) (AUCдоксорубицинол/AUCдоксорубицин: 0,45 ± 0,10; диапазон: 0,33–0,61), существенно не отличалось от такового у не- беременные женщины. Это предполагает, что беременность не влияет на метаболический путь, участвующий в образовании доксорубицинола [22]. Более того, эти исследования также предполагают, что объем распределения и элиминация (период полувыведения) доксорубицина статистически не отличаются у беременных и небеременных женщин [22, 27, 28, 29].
Доксорубицин более сильно влияет на систолическую и диастолическую функции сердца, чем доксорубицин [31]. Кардиотоксичность снижается за счет снижения уровня циркулирующего доксорубицинола посредством ингибирования CBR1 [32]. Образование доксорубицинола находится под контролем экспрессии AKR1C3, CBR1 и CBR3 [33]. Насколько нам известно, нет данных о влиянии изменений их экспрессии или активности во время беременности. Однако количество доксорубицинола, выраженное как отношение его концентраций в плазме, представленное как площадь под кривой (AUC) (AUCдоксорубицинол/AUCдоксорубицин: 0,45 ± 0,10; диапазон: 0,33–0,61), существенно не отличалось от такового у не- беременные женщины. Это предполагает, что беременность не влияет на метаболический путь, участвующий в образовании доксорубицинола [22]. Более того, эти исследования также предполагают, что объем распределения и элиминация (период полувыведения) доксорубицина статистически не отличаются у беременных и небеременных женщин [22, 27, 28, 29]. ]. Способность плаценты переносить доксорубицин или пегилированный липосомальный доксорубицин из материнской крови в кровоток плода изучали ex vivo на модели плацентарной перфузии человека [34]. Это исследование показало быстрое снижение концентрации доксорубицина: 30% доксорубицина остается в кровотоке матери через 4 часа, а 12% доксорубицина — в кровотоке плода. Напротив, доксорубицин не обнаруживался в кровотоке плода в любой момент времени в течение 4 ч ex vivo плацентарной перфузии пегилированным липосомальным доксорубицином. Эти результаты свидетельствуют о том, что пегилированный липосомальный доксорубицин не проникает через гематоплацентарный барьер. Хотя эти опубликованные данные свидетельствуют о том, что фармакокинетика доксорубицина у матери, по-видимому, не различалась во время беременности, плацентарная функция и факторы плода также были возможными источниками изменчивости воздействия доксорубицина на плод или его фармакокинетики.
]. Способность плаценты переносить доксорубицин или пегилированный липосомальный доксорубицин из материнской крови в кровоток плода изучали ex vivo на модели плацентарной перфузии человека [34]. Это исследование показало быстрое снижение концентрации доксорубицина: 30% доксорубицина остается в кровотоке матери через 4 часа, а 12% доксорубицина — в кровотоке плода. Напротив, доксорубицин не обнаруживался в кровотоке плода в любой момент времени в течение 4 ч ex vivo плацентарной перфузии пегилированным липосомальным доксорубицином. Эти результаты свидетельствуют о том, что пегилированный липосомальный доксорубицин не проникает через гематоплацентарный барьер. Хотя эти опубликованные данные свидетельствуют о том, что фармакокинетика доксорубицина у матери, по-видимому, не различалась во время беременности, плацентарная функция и факторы плода также были возможными источниками изменчивости воздействия доксорубицина на плод или его фармакокинетики.
Для дальнейшего объяснения низкого риска кардиотоксичности доксорубицина у плода была предложена критическая роль плацентарных переносчиков лекарств суперсемейства ABC в эффективном контроле и ограничении воздействия лекарств/субстрата на плод [35, 36]. Некоторые исследования показали, что ABCB1, также известный как P-гликопротеин (P-gp), имеет решающее значение для защиты плода, ограничивая воздействие субстратов из кровотока матери и удаляя их из кровотока плода в кровоток матери [37,38,39].]. В таблице 2 обобщена локализация выбранных систем, опосредованных переносчиками доксорубицина, из суперсемейства ABC, которые, как известно, ограничивают, по крайней мере, в плаценте человека доступ доксорубицина к компартменту крови плода. Также известно влияние на фармакокинетику доксорубицина посредством их полиморфизма. Следовательно, функция этих переносчиков лекарств может иметь решающее значение для защиты плода. P-gp и ABCG2 (BCRP) экспрессируются в плаценте, а доксорубицин хорошо известен как двойной субстрат P-gp и BCRP. Обнаруженная в микроворсинках синцитиотрофобласта, граничащих с материнской стороной плаценты человека, средняя экспрессия P-gp снижается с 14-й по 40-ю неделю беременности, что свидетельствует о постепенном снижении эффективности и защиты плода [35, 36].
Некоторые исследования показали, что ABCB1, также известный как P-гликопротеин (P-gp), имеет решающее значение для защиты плода, ограничивая воздействие субстратов из кровотока матери и удаляя их из кровотока плода в кровоток матери [37,38,39].]. В таблице 2 обобщена локализация выбранных систем, опосредованных переносчиками доксорубицина, из суперсемейства ABC, которые, как известно, ограничивают, по крайней мере, в плаценте человека доступ доксорубицина к компартменту крови плода. Также известно влияние на фармакокинетику доксорубицина посредством их полиморфизма. Следовательно, функция этих переносчиков лекарств может иметь решающее значение для защиты плода. P-gp и ABCG2 (BCRP) экспрессируются в плаценте, а доксорубицин хорошо известен как двойной субстрат P-gp и BCRP. Обнаруженная в микроворсинках синцитиотрофобласта, граничащих с материнской стороной плаценты человека, средняя экспрессия P-gp снижается с 14-й по 40-ю неделю беременности, что свидетельствует о постепенном снижении эффективности и защиты плода [35, 36]. Хотя его клинические последствия до сих пор плохо известны, пониженная экспрессия/функция P-gp в плаценте может увеличивать распространение лекарственного субстрата к плоду, возможно, усиливая его эффекты [37]. Функция P-gp также может быть снижена при взаимодействии лекарств с ингибиторами, такими как амиодарон, циклоспорин или хинидин [44].
Хотя его клинические последствия до сих пор плохо известны, пониженная экспрессия/функция P-gp в плаценте может увеличивать распространение лекарственного субстрата к плоду, возможно, усиливая его эффекты [37]. Функция P-gp также может быть снижена при взаимодействии лекарств с ингибиторами, такими как амиодарон, циклоспорин или хинидин [44].
Таблица 2 Полиморфизм гена транспортера ABC доксорубицина, вовлеченного в плаценту человека [40,41,42,43]
Полная таблица
Внутривенный ондансетрон для предотвращения тошноты и рвоты был назначен не по прямому назначению в нашем клиническом случае. В литературе сообщалось о побочных эффектах, включая потенциальное удлинение интервала QT и пируэтную желудочковую тахикардию [45,46,47]. В исследовании, проведенном Danielsson et al., были проанализированы данные шведского медицинского реестра рождений для выявления 1349 детей, рожденных от женщин, принимавших ондансетрон на ранних сроках беременности. Был статистически повышен риск сердечно-сосудистых дефектов [48]. Авторы предположили, что возможное удлинение интервала QT под действием ондансетрона может вызывать эмбриональные аритмии, предполагая, что препарат не следует использовать не по прямому назначению на ранних сроках беременности. Недавнее исследование, проведенное Fejzo et al. проанализировали исход беременности при применении ондансетрона в Соединенных Штатах. Результаты были аналогичны этим выводам [49].
Был статистически повышен риск сердечно-сосудистых дефектов [48]. Авторы предположили, что возможное удлинение интервала QT под действием ондансетрона может вызывать эмбриональные аритмии, предполагая, что препарат не следует использовать не по прямому назначению на ранних сроках беременности. Недавнее исследование, проведенное Fejzo et al. проанализировали исход беременности при применении ондансетрона в Соединенных Штатах. Результаты были аналогичны этим выводам [49].
Лекарственные взаимодействия, связанные с метаболизмом и/или транспортом доксорубицина, всегда следует учитывать до начала лечения доксорубицином. Прогностическая роль полиморфизма P-gp в фетальной токсичности доксорубицина требует дальнейших клинических исследований. В нашем случае такие генетические тесты не проводились.
В этом случае возраст матери 41 год был фактором риска, который следует учитывать. Пожилой возраст матери может способствовать множественным осложнениям беременности, таким как самопроизвольный аборт, преэклампсия, гестационный диабет, задержка роста плода и мертворождение [50, 51]. В некоторых исследованиях также сообщалось о повышенном риске дефектов перегородки у женщин, забеременевших в пожилом возрасте [52, 53]. И наоборот, некоторые исследования не обнаружили доказательств связи между возрастом матери и врожденным пороком сердца [54, 55, 56].
В некоторых исследованиях также сообщалось о повышенном риске дефектов перегородки у женщин, забеременевших в пожилом возрасте [52, 53]. И наоборот, некоторые исследования не обнаружили доказательств связи между возрастом матери и врожденным пороком сердца [54, 55, 56].
Одной из особенностей этого случая является то, что близнецы по-разному реагировали на воздействие. Несмотря на то, что у близнецов одна и та же матка, наличие двух отдельных плацент оказывает особое влияние на каждого близнеца [57, 58]. Доставка соединений, токсичных или нет, зависит от сосудистой системы, предназначенной для отдельного близнеца [57]. В своем исследовании Igbal и соавт. предположили, что различная экспрессия у близнецов — генетическая изменчивость генов, которые кодируют эти транспортеры лекарств, может значительно изменить функцию транспортеров и может играть важную роль в определении чувствительности плода к лекарственным препаратам матери [43]. В 2017 г. Hermel сообщил о случае, когда только у одного из близнецов, рожденных от матери, получавшей дазатиниб по поводу хронического миелоидного лейкоза, были пороки сердца [59]. ]. Следовательно, гипотезой может быть плацентарное несоответствие в распределении доксорубицина с более высоким уровнем переливания крови для близнецов мужского пола.
]. Следовательно, гипотезой может быть плацентарное несоответствие в распределении доксорубицина с более высоким уровнем переливания крови для близнецов мужского пола.
Лечение ЛХ, диагностированной во время беременности, является серьезной проблемой для медицинского персонала, который должен предложить наилучшие варианты лечения, избегая токсичности для плода. Мы сообщаем об одном случае ЛХ, получавшей лечение по схеме ABVD во время беременности дизиготной двойней, осложнившейся преждевременным разрывом плодных оболочек и кардиотоксичностью у одного из близнецов.
Даже если в нашем исследовании не удалось выдвинуть гипотезу о молекулярном механизме, этот случай подчеркивает роль специфических факторов плода, которые могут придавать вариабельность фармакокинетике и/или фармако/токсикодинамике доксорубицина.
Наличие данных и материалов
Все данные, проанализированные в ходе этого исследования, включены в эту опубликованную статью.
Сокращения
- ABVD:
Адриамицин/доксорубицин, блеомицин, винкристин, дакарбазин
- Букварь:
Кассета для связывания АТФ
- АУК:
Площадь под кривой
- БКРП:
Белок устойчивости к раку молочной железы; АБКГ2
- HL:
лимфома Ходжкина
- ФВ ЛЖ:
Фракция выброса левого желудочка
- П-гп:
Р-гликопротеин; АВСВ1
Каталожные номера
- «>
Haas JF. Беременность в связи с недавно диагностированным раком: популяционная эпидемиологическая оценка. Int J Cancer 1984; 34: 229–235. https://doi.org/10.1002/ijc.2
0214.
Pinnix CC, Andraos TY, Milgrom S, Fanale MA. Лечение лимфомы в условиях беременности. Curr Hematol Malig Rep 2017;12(3):251–256. https://doi.org/10.1007/s11899-017-0386-x.
Моше Ю., Бентур О.С., Лишнер М., Авиви И. Лечение лимфомы Ходжкина при беременности. Eur J Haematol 2017;99(5):385–391. https://doi.org/10.1111/ejh.12956.
Пентерудакис Г., Павлидис Н. Рак и беременность: poena magna, больше нет. Eur J Рак 2006; 42: 126–140. https://doi.org/10.1016/j.ejca.2005.10.014.
Hurley TJ, McKinnell JV, Irani MS. Гематологические злокачественные новообразования при беременности. Акушерская гинекологическая клиника N Am 2005;32:595–614. https://doi.org/10.1016/j.ogc.2005. 08.008.
08.008.
Бреннер Б., Авиви И., Лишнер М. Гематологический рак во время беременности. Ланцет 2012; 379: 580–587. https://doi.org/10.1016/S0140-6736(11)61348-2.
Павлидис Н., Пентерудакис Г. Беременная женщина с раком молочной железы: диагностика и терапевтическое лечение. Лечение рака, ред. 2005; 31:439–447. https://doi.org/10.1016/j.ctrv.2005.04.010.
Ле Гуйадер-Пейру С., Бело А., Майнадье М., Биндер-Фукар Ф., Ремонте Л., Труссар Х., Боссар Н., Моннеро а; Французская сеть онкологических регистров (Francim). Заболеваемость раком во Франции за 1980-2012 период: гемобластозы. Rev Epidemiol Sante Publique 2016;64(2):103–112. https://doi.org/10.1016/j.respe.2015.12.017.
Авилес А., Намбо М.Дж., Нери Н. Лечение лимфомы Ходжкина на ранних стадиях во время беременности. Mediterr J Hematol Infect Dis 2018;10(1):e2018006. https://doi.org/10.4084/mjhid. 2018.006.
2018.006.
Перег Д., Корен Г., Лишнер М. Лечение лимфомы Ходжкина и неходжкинской лимфомы у беременных. Гематология 2007; 92:1230–1237. doi:10.3324/гематол.11097.
Pinnix CC, Osborne EM, Chihama C, et al. Исходы для матери и плода после лечения лимфомы Ходжкина и неходжкинской лимфомы, диагностированной во время беременности. JAMA Oncol 2016;3:1065–1069. doi:10.1001/jamaoncol.2016.1396.
Эйр Т.А., Лау И.Дж., Маккиллоп Л., Коллинз Г.П. Ведение и противоречия классической лимфомы Ходжкина во время беременности. Бр Дж. Гематол 2015; 169: 513–630. https://doi.org/10.1111/bjh.13327.
Peccatori FA, Azim HA Jr, Orecchia R, Hoekstra HJ, Pavlidis N, Kesic V, Pentheroudakis G. Рабочая группа по рекомендациям ESMO. Рак, беременность и фертильность: Клинические практические рекомендации ESMO по диагностике, лечению и последующему наблюдению. Энн Онкол 2013;24 Дополнение 6:vi160–vi170. https://doi.org/10.1093/annonc/mdt199.
https://doi.org/10.1093/annonc/mdt199.
Бачанова В., Коннорс Дж.М. Лимфома Ходжкина при беременности. Curr Hematol Malig Rep 2013;8(3):211–217. https://doi.org/10.1007/s11899-013-0163-4.
Фрамарино-Деи-Малатеста М., Саммартино П., Наполи А. Обеспечивает ли химиотерапия на основе антрациклинов у беременных женщин с онкологическими заболеваниями безопасные исходы для сердца и нервной системы для развивающегося плода? BMC Рак 2017;17(1):777. https://doi.org/10.1186/s12885-017-3772-9.
Ирияма Н., Хорикоши А., Танака Т., Хирабаяши Ю., Кодаира Х., Хатта Ю., Такеучи Дж. Успешное лечение лимфомы Ходжкина во втором триместре беременности: осуществимость режима ABVD. Международный Дж. Гематол 2011; 94(1):104–107. https://doi.org/10.1007/s12185-011-0876-x.
Де Санктис В., Филиппоне Ф.Р., Альфо М., Муни Р., Кавальери Э., Пульсони А., Аннечини Г., Валериани М. , Ости М.Ф., Миннити Г., Энричи Р.М. Влияние различных подходов к лечению на исходы беременности у 99 женщин, лечившихся от лимфомы Ходжкина. Int J Radiat Oncol Biol Phys 2012;84(3):755–761.https://doi.org/10.1016/j.ijrobp.2011.12.066.
, Ости М.Ф., Миннити Г., Энричи Р.М. Влияние различных подходов к лечению на исходы беременности у 99 женщин, лечившихся от лимфомы Ходжкина. Int J Radiat Oncol Biol Phys 2012;84(3):755–761.https://doi.org/10.1016/j.ijrobp.2011.12.066.
Centre de Référence sur les Agents Tératogenes. Госпиталь Труссо (Париж, Франция): Radiations ionisantes — Grossesse. https://lecrat.fr/spip.php?page=article&id_article=254. Просмотрено 29Январь 2020 г.
Sela HY, Simpson LL. Преждевременный преждевременный разрыв плодных оболочек, осложняющий беременность двойней: соображения ведения. Clin Obstet Gynecol 2011;54:321–329. https://doi.org/10.1016/j.jogc.2019.06.016.
Магген К., Дириккс Д., Лугтенбург П., Лаэнен А., Кардоник Э., Смаков Р., Беллидо М., Кабрера-Гарсия А., Гзири М.М., Халаска М.Дж., Оттевангер П.Б., Ван Калстерен К., О’Лафлин А., Полушкина Е. , Van Dam L, Avavi I, Vandenberghe P, Woei-A-Jin FJSH, Amant F. Международная сеть по раку, бесплодию и беременности. Акушерские и материнские исходы у пациенток с диагнозом лимфома Ходжкина во время беременности: многоцентровое ретроспективное когортное исследование. Ланцет Гематол 2019;6(11):e551-e561. https://doi.org/10.1016/S2352-3026(19)30195-4.
Международная сеть по раку, бесплодию и беременности. Акушерские и материнские исходы у пациенток с диагнозом лимфома Ходжкина во время беременности: многоцентровое ретроспективное когортное исследование. Ланцет Гематол 2019;6(11):e551-e561. https://doi.org/10.1016/S2352-3026(19)30195-4.
Абдулджалил К., Фернесс П., Джонсон Т.Н., Ростами-Ходжеган А., Солтани Х. Анатомические, физиологические и метаболические изменения в зависимости от гестационного возраста при нормальной беременности: база данных параметров, необходимых для физиологически обоснованного фармакокинетического моделирования. Clin Pharmacokinet 2012;51(6):365–396. https://doi.org/10.2165/11597440-000000000-00000.
Рю Р.Дж., Эяль С., Каплан Х.Г., Акбарзаде А., Хейс К., Пуль К., Истерлинг Т.Р., Берг С.Л., Скорсоне К.А., Фельдман Э.М., Уманс Ю.Г., Миодовник М., Хеберт М.Ф. Фармакокинетика доксорубицина у беременных. Рак Chemother Pharmacol 2014;73(4):789–797. https://doi.org/10.1007/s00280-014-2406-z.
https://doi.org/10.1007/s00280-014-2406-z.
Lukaski H, Skiers W, Nielsen E, Hall C. Общее количество воды в организме при беременности: оценка с помощью биоэлектрического импеданса. Ам Дж. Клин Нутр 1994; 59: 578–585. https://doi.org/10.1093/ajcn/59.3.578.
Трейси Т.С., Венкатараманан Р., Гловер Д.Д., Каритис С.Н., Национальный институт детского здоровья и развития человека, сеть отделений медицины матери и плода. Временные изменения метаболизма лекарственных средств (активность CYP1A2, CYP2D6 и CYP3A) во время беременности. Am J Obstet Gynecol 2005;192(2):633–639. https://doi.org/10.1016/j.ajog.2004.08.030.
Piscitelli SC, Rodvold KA, Rushing DA, Tewksbury DA. Фармакокинетика и фармакодинамика доксорубицина у больных мелкоклеточным раком легкого. Clin Pharmacol Ther 1993; 53:555–561. https://doi.org/10.1038/clpt.1993.69.
Родволд К.А., Рашинг Д. А., Тьюксбери Д.А. Клиренс доксорубицина при ожирении. Дж. Клин Онкол, 1988; 6: 1321–1327. DOI: 10.1200/JCO.1988.6.8.1321.
А., Тьюксбери Д.А. Клиренс доксорубицина при ожирении. Дж. Клин Онкол, 1988; 6: 1321–1327. DOI: 10.1200/JCO.1988.6.8.1321.
Jacquet JM, Bressolle F, Galtier M, et al. Доксорубицин и доксорубицинол: индивидуальные и индивидуальные вариации фармакокинетических параметров. Рак Chemother Pharmacol 1990;39:507. https://doi.org/10.1007/BF00685716.
Бэйнс О.С., Карклинг М.Дж., Грильятти Т.А., Рейд Р.Е., Риггс К.В. Два несинонимичных однонуклеотидных полиморфизма карбонилредуктазы 1 человека демонстрируют пониженный метаболизм даунорубицина и доксорубицина in vitro. Drug Metab Dispos 2009;37(5):1107–1114. https://doi.org/10.1124/dmd.108.024711.
Бейнс О.С., Карклинг М.Дж., Лубенецка Дж.М., Грильятти Т.А., Рейд Р.Е., Риггс К.В. Встречающиеся в природе варианты CBR3 человека изменяют метаболизм антрациклина in vitro. J Pharmacol Exp Ther 2010;332(3):755–763. https://doi.org/10.1124/jpet. 109.160614.
109.160614.
Kassner N, Huse K, Martin HJ, Gödtel-Armbrust U, Metzger A, Meineke I, Brockmöller J, Klein K, Zanger UM, Maser E, Wojnowski L. Карбонилредуктаза 1 является преобладающей доксорубицинредуктазой в организме человека. печень. Drug Metab Dispos 2008;36(10):2113–2120. https://doi.org/10.1124/dmd.108.022251.
Forrest GL, Gonzalez B, Tseng W, Li X, Mann J. Сверхэкспрессия карбонилредуктазы человека в сердце способствует развитию доксорубицин-индуцированной кардиотоксичности у трансгенных мышей. Рак рез. 2000;60(18):5158–64.
КАС
пабмед
Google ученый
Олсон Л.Э., Беджа Д., Алви С.Дж., Кардунель А.Дж., Габриэльсон К.Л., Ривз Р.Х. Защита от сердечной токсичности, вызванной доксорубицином, у мышей с нулевым аллелем карбонилредуктазы 1. Cancer Res. 2003;63(20):6602–6.
КАС
пабмед
Google ученый
Thorn CF, Oshiro C, Marsh S, Hernandez-Boussard T, McLeod H, Klein TE, Altman RB. Пути введения доксорубицина: фармакодинамика и побочные эффекты. Pharmacogenet Genomics 2011;21(7):440–446. ДОИ: 10.1097/FPC.0b013e32833ffb56.
Soininen SK, Repo JK, Karttunen V, Auriola S, Vähäkangas KH, Ruponen M. Поглощение плацентарными клетками и тканями человека доксорубицина и его липосомальных форм. Toxicol Lett 2015;239(2):108–114. https://doi.org/10.1016/j.toxlet.2015.09.011.
МакФарланд А., Абрамович Д.Р., Юэн С.В., Пирсон С.К. Стадийно-специфическое распределение Р-гликопротеина в плаценте первого триместра и доношенной плаценты человека. Histochem J 1994;26(5):417–423. https://doi.org/10.1007/BF00160054.
Gil S, Saura R, Forestier F, Farinotti R. Экспрессия P-гликопротеина плаценты человека во время беременности. Плацента 2005;26(2–3):268–270. https://doi.org/10.1016/j.placenta. 2004.05.013.
2004.05.013.
Чечкова-Новотна М., Павек П., Стауд Ф. Р-гликопротеин в плаценте: экспрессия, локализация, регуляция и функция. Reprod Toxicol 2006;22(3):400–410. https://doi.org/10.1016/j.reprotox.2006.01.007.
Нанаяккара А.К., Фоллит К.А., Чен Г., Уильямс Н.С., Фогель П.Д., Уайз Дж.Г. Таргетные ингибиторы Р-гликопротеина увеличивают вызванную химиотерапией смертность опухолевых клеток с множественной лекарственной устойчивостью. Научный представитель 2018; 8 (1): 967. https://doi.org/10.1038/s41598-018-19325-x.
Pavek P, Staud F, Fendrich Z, Slenarova H, Libra A, Novotna M, et al. Исследование функциональной активности Р-гликопротеина в плацентарном барьере крыс с использованием родамина 123. J Pharmacol Exp Ther 2003;305(3):1239–1250. https://doi.org/10.1124/jpet.102.048470.
Уокер Н., Филис П., Соффентини У., Беллингем М., О’Шонесси П. Дж., Фаулер П.А. Локализация и экспрессия плацентарного транспортера у человека: важность различий в видах, поле и гестационном возрасте. Биол Репрод 2017;96(4):733–742. https://doi.org/10.1093/biolre/iox012.
Дж., Фаулер П.А. Локализация и экспрессия плацентарного транспортера у человека: важность различий в видах, поле и гестационном возрасте. Биол Репрод 2017;96(4):733–742. https://doi.org/10.1093/biolre/iox012.
Джоши А.А., Вайдья С.С., Сен-Пьер М.В., Михеев А.М., Десино К.Е., Няндеге А.Н., Аудус К.Л., Унадкат Ж.Д., Герк П.М. Плацентарные АВС-транспортеры: биологическое воздействие и фармацевтическое значение. Фармрез 2016;33(12):2847–2878. https://doi.org/10.1007/s11095-016-2028-8.
Staud F, Cerveny L, Ceckova M. Фармакотерапия при беременности; влияние транспортеров ABC и SLC на транспорт лекарств через плаценту и воздействие лекарств на плод. J Цель по борьбе с наркотиками 2012; 20 (9): 736–763. https://doi.org/10.3109/1061186X.2012.716847.
Икбал М., Одетт М.С., Петропулос С., Гибб В., Мэтьюз С.Г. Плацентарные переносчики лекарств и их роль в защите плода. Плацента 2012;33(3):137–142. https://doi.org/10.1016/j.placenta.2012.01.008.
https://doi.org/10.1016/j.placenta.2012.01.008.
Pavek P, Fendrich Z, Staud F, Malakova J, Brozmanova H, Laznicek M, et al. Влияние Р-гликопротеина на трансплацентарное прохождение циклоспорина. J Pharm Sci 2001;90(10):1583–1592. https://doi.org/10.1002/jps.1108.
Корен Г. Страшная наука: безопасность ондансетрона при беременности — два противоположных результата из одного и того же датского регистра. The Drug Monit 2014; 36: 1–2. doi: 10.1097/FTD.0000000000000020.
Li K, Vo K, Lee BK, Addo N, Coralic Z. Эффект однократной дозы внутривенного введения. ондансетрон на интервал QTc у пациентов отделения неотложной помощи. Am J Health Syst Pharm 2018;75(5):276–282. https://doi.org/10.2146/ajhp161070.
Lee DY, Trinh T, Roy SK. Torsades de Pointes после инфузии ондансетрона у 2 пациентов. Tex Heart Inst J 2017; 44 (5): 366–369. https://doi.org/10. 14503/THIJ-16-6040.
14503/THIJ-16-6040.
Danielsson B, Wikner BN, Källén B. Использование ондансетрона во время беременности и врожденных пороков развития у младенцев. Reprod Toxicol 2014; 50:134–137. https://doi.org/10.1016/j.reprotox.2014.10.017.
Фейзо М.С., Макгиббон К.В., Маллин П.М. Ондансетрон при беременности и риск неблагоприятных исходов для плода в США. Reprod Toxicol 2016;62:87–91. https://doi.org/10.1016/j.reprotox.2016.04.027.
Salem Yaniv S, Levy A, Wiznitzer A, Holcberg G, Mazor M, Sheiner E. Существует значимая линейная связь между преклонным возрастом матери и неблагоприятным перинатальным исходом. Arch Gynecol Obstet 2011;283(4):755–759. https://doi.org/10.1007/s00404-010-1459-4.
Лаопаибун М., Лумбиганон П., Интарут Н., Мори Р., Ганчимег Т., Фогель Д.П., Соуза Д.П., Гюльмезоглу А.М. Многострановой опрос ВОЗ по сети исследований здоровья матерей и новорожденных. Пожилой возраст матери и исходы беременности: многострановая оценка. BJOG 2014; 121 Приложение 1:49–56. https://doi.org/10.1111/1471-0528.12659.
Пожилой возраст матери и исходы беременности: многострановая оценка. BJOG 2014; 121 Приложение 1:49–56. https://doi.org/10.1111/1471-0528.12659.
Миллер А., Риле-Коларуссо Т., Сиффель С., Фриас Дж. Л., Корреа А. Возраст матери и распространенность изолированных врожденных пороков сердца в городских районах США. Am J Med Genet A 2011;155A(9):2137–2145. https://doi.org/10.1002/ajmg.a.34130.
Форрестер МБ, Мерц РД. Описательная эпидемиология отдельных врожденных пороков сердца, Гавайи, 1986-1999 гг. Pediatr Perinat Epidemiol 2004;18(6):415–424. https://doi.org/10.1111/j.1365-3016.2004.00594.х.
Cedergren MI, Selbing AJ, Källén BA. Факторы риска сердечно-сосудистых пороков развития — исследование, основанное на проспективно собранных данных. Scand J Work Environ Health 2002;28(1):12–17. дои: 10.5271/sjweh.641.
Лонг Дж., Рамадани Т., Митчелл Л. Е. Эпидемиология несиндромальных конотрункальных пороков сердца в Техасе, 1999-2004 гг. Birth Defects Res A Clin Mol Teratol 2010;88(11):971–979. https://doi.org/10.1002/bdra.20724.
Е. Эпидемиология несиндромальных конотрункальных пороков сердца в Техасе, 1999-2004 гг. Birth Defects Res A Clin Mol Teratol 2010;88(11):971–979. https://doi.org/10.1002/bdra.20724.
Best KE, Rankin J. Является ли пожилой возраст матери фактором риска врожденного порока сердца? Birth Defects Res A Clin Mol Teratol 2016;106(6):461–467. https://doi.org/10.1002/bdra.23507.
Марсо К., Макмастер М.Т., Смит Т.Ф., Даамс Дж.Г., ван Бейстервельдт К.Е., Бумсма Д.И., Кнопик В.С. Пренатальная среда в исследованиях близнецов: обзор хорионичности. Behav Genet 2016;46(3):286–303. https://doi.org/10.1007/s10519-016-9782-6.
Weiner E, Barber E, Feldstein O, Dekalo A, Schreiber L, Bar J, Kovo M. Различия в гистопатологии плаценты и неонатальный исход при дихориально-диамниотической беременности по сравнению с монохориально-диамниотической двойной беременностью. Reprod Sci 2018;25(7):1067–1072. https://doi.org/10.1177%2F1
https://doi.org/10.1177%2F1
32163.
Hermel DJ, Chiu V, Hermel MH, Tulpule A, Akhtari M. Врожденные пороки сердца у младенца-близнеца, родившегося у женщины с хроническим миелоидным лейкозом, принимающей дазатиниб. J Oncol Pharm Pract 2019;25(3):699–702. https://doi.org/10.1177/1078155217745710.
Ссылки на скачивание
Благодарности
Мы благодарим Расику Совмялакшми за редактирование английского текста.
Финансирование
Нет.
Информация об авторе
Авторы и принадлежности
Hôpital Universitiare Necker — Enfants Malades, Pharmacie, F -75015, Париж, Франция
Camille Cotteret, Yen -Vi Pham, Salvatore Cisternino & Joonhal Schlatter
40644000044000440004400044000440004400044000440004400044000440004400044000440004400044000440004400044000440004400044000440004.
4.
4.
4.
4.
. Взрослая гематология, F-75015, Париж, Франция
Ambroise Marcais
Hôpital universitaire Necker — Enfants malades, гинекология-акушерство, F-75015, Париж, Франция
Marine Driessen
Inserm UMR-S 1144, Team “Blood-brain barrier in brain pathophysiology and therapy”, Université Paris Descartes, F-75006, Paris, France
Salvatore Cisternino
Authors
- Camille Cotteret
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Yen-Vi Pham
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Ambroise Marcais
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - Marine Driessen
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Salvatore Cisternino
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - Joël Schlatter
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar
Вклады
AM и MD проанализировали и интерпретировали данные пациентов в отношении гематологического заболевания и данные о близнецах в отношении клинической оценки. CC, YVP, SC и JS проанализировали и обсудили безопасность лечения доксорубицином. CC, SC и JS внесли основной вклад в написание рукописи. Все авторы прочитали, отредактировали и одобрили окончательный вариант рукописи.
CC, YVP, SC и JS проанализировали и обсудили безопасность лечения доксорубицином. CC, SC и JS внесли основной вклад в написание рукописи. Все авторы прочитали, отредактировали и одобрили окончательный вариант рукописи.
Автор, ответственный за переписку
Переписка с
Джоэль Шлаттер.
Декларация этики
Одобрение этики и согласие на участие
Неприменимо. Местный комитет по этике постановил, что в данном конкретном случае формальное одобрение этики не требуется.
Согласие на публикацию
Пациент дал письменное согласие на публикацию изображений и/или клинических данных от своего имени и от имени своих детей. Копия формы согласия доступна для просмотра редактором этого журнала.
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Дополнительная информация
Примечание издателя
Springer Nature остается нейтральной в отношении юрисдикционных претензий в опубликованных картах и институциональной принадлежности.
Права и разрешения
Открытый доступ Эта статья находится под лицензией Creative Commons Attribution 4.0 International License, которая разрешает использование, совместное использование, адаптацию, распространение и воспроизведение на любом носителе или в любом формате, при условии, что вы укажете соответствующую ссылку на оригинальный автор(ы) и источник, предоставьте ссылку на лицензию Creative Commons и укажите, были ли внесены изменения. Изображения или другие сторонние материалы в этой статье включены в лицензию Creative Commons на статью, если иное не указано в кредитной строке материала. Если материал не включен в лицензию Creative Commons статьи, а ваше предполагаемое использование не разрешено законом или выходит за рамки разрешенного использования, вам необходимо получить разрешение непосредственно от правообладателя. Чтобы просмотреть копию этой лицензии, посетите http://creativecommons.org/licenses/by/4.0/. Отказ Creative Commons от права на общественное достояние (http://creativecommons. org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если иное не указано в кредитной линии данных.
org/publicdomain/zero/1.0/) применяется к данным, представленным в этой статье, если иное не указано в кредитной линии данных.
Перепечатки и разрешения
Об этой статье
Исходы для матери и плода после болезни Ходжкина во время беременности
- Опубликовано:
Клиническая онкология/эпидемиология
- M Лишнер 1 ,
- D Землячкис ,
- P Дегендорфер ,
- T Panzarella ,
- 9 SB Sutcliffe
- …
- Г Корень
Британский журнал рака
том 65 , страницы 114–117 (1992)Цитировать эту статью
284 доступа
103 Цитаты
Детали показателей
Abstract
Пик заболеваемости болезнью Ходжкина приходится на репродуктивный возраст, и его связь с беременностью составляет 1:1000-1:6000. Мы изучили влияние болезни Ходжкина на течение и выживаемость 48 беременных женщин с болезнью Ходжкина и сравнили их исходы с небеременными женщинами с аналогичной стадией заболевания, возрастом на момент постановки диагноза и календарным годом рождения. лечение. Двадцатилетняя выживаемость беременных женщин с болезнью Ходжкина не отличалась от аналогичной контрольной группы. У беременных женщин с болезнью Ходжкина распределение стадий было таким же, как и в контрольной группе.
Мы изучили влияние болезни Ходжкина на течение и выживаемость 48 беременных женщин с болезнью Ходжкина и сравнили их исходы с небеременными женщинами с аналогичной стадией заболевания, возрастом на момент постановки диагноза и календарным годом рождения. лечение. Двадцатилетняя выживаемость беременных женщин с болезнью Ходжкина не отличалась от аналогичной контрольной группы. У беременных женщин с болезнью Ходжкина распределение стадий было таким же, как и в контрольной группе.
Это предварительный просмотр содержимого подписки, доступ через ваше учреждение
Варианты доступа
Подписаться на журнал
Получить полный доступ к журналу на 1 год
118,99 €
всего 4,96 € за выпуск
Подписаться
Расчет налогов будет завершен во время оформления заказа.
Купить статью
Получите ограниченный по времени или полный доступ к статье на ReadCube.
32,00 $
Купить
Все цены указаны без учета стоимости.
Информация о авторе
Авторы и принадлежности
Департамент педиатрии, больница для больных детей, Торонто, Канада
M Lishner
Авторы
- M Lishner
. этот автор в
PubMed Google Scholar - D Zemlickis
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Академия - P Degendorfer
Посмотреть публикации автора
Вы также можете искать этого автора в
PubMed Google Scholar - T Panzarella
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - SB Sutcliffe
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar - Г Корень
Просмотр публикаций автора
Вы также можете искать этого автора в
PubMed Google Scholar
Права и разрешения
Перепечатка и разрешения
Об этой статье
Эта статья цитируется
Лимфома, возникшая во время беременности: современные диагностические и терапевтические подходы
- Манси Р.
 Шах
Шах - Джастин С. Брандт
- Эндрю М. Эвенс
Текущие онкологические отчеты (2020)
- Манси Р.
Частота беременностей и исходы беременностей у длительно перенесших лимфому Ходжкина
- Франческо Гаудио
- Клаудия Нарделли
- Джорджина Спеккиа
Анналы гематологии (2019)
Сохраняющиеся дилеммы в лечении лимфомы во время беременности: обзор анкеты из 10 пунктов, основанной на каждом конкретном случае
- Амит Оделия
- Йоффе Эрель
- Авиви Ирит
Международный журнал клинической онкологии (2017)
Ведение гематологических злокачественных новообразований: особые соображения у беременных женщин
- Оделия Амит
- Мерав Барзилай
- Ирит Авиви
Наркотики (2015)
Беременность и лимфома — Лимфома Австралия
Диагноз лимфомы во время беременности создает проблемы для женщин, их нерожденных детей, их семей и медицинских бригад. Ваша команда гематологов и дородовая команда будут работать вместе, чтобы заботиться о вас и вашем ребенке.
Ваша команда гематологов и дородовая команда будут работать вместе, чтобы заботиться о вас и вашем ребенке.
Лимфома Ходжкина чаще встречается у беременных по сравнению с неходжкинскими лимфомами. Это связано с тем, что HL часто встречается у людей в возрасте от 15 до 34 лет, которые являются детородным возрастом.
Если неходжкинская лимфома диагностируется во время беременности, она обычно имеет агрессивный (быстрорастущий) тип. Примером этого является диффузная крупноклеточная В-клеточная лимфома (DLBCL). НХЛ имеет меньше случаев беременности по сравнению с ЛХ, возможно, потому, что она чаще встречается у людей старше 55 лет.
Лимфома ведет себя одинаково для беременных и небеременных женщин. Рак растет и распространяется одинаково.
Лимфома не подпитывается гормонами беременности.
На этой странице:
Симптомы
Симптомы беременности и лимфомы могут быть схожими. Это часто приводит к задержке в постановке диагноза
Эти симптомы могут включать:
- Утомляемость – сильная усталость
- Анемия – низкий уровень эритроцитов, вызывающий чувство усталости
- 0032 Боли и боли
- Повышенное потоотделение
- Кожный зуд
Диагностика
Для диагностики лимфомы необходима биопсия лимфатического узла. Биопсию лимфатических узлов можно проводить под местной анестезией во время беременности, не нанося вреда будущему ребенку.
Биопсию лимфатических узлов можно проводить под местной анестезией во время беременности, не нанося вреда будущему ребенку.
После подтверждения диагноза лимфомы необходимо провести тесты на определение стадии. Обычно это рентген, компьютерная томография или ПЭТ. В этих тестах используется радиация. Врачи, как правило, избегают этих тестов во время беременности из-за радиации. Ваш врач может вместо этого провести МРТ или УЗИ, так как в этих тестах не используется радиация. Используемые сканы будут зависеть от того, в каком триместре беременности вы находитесь.
После рождения ребенка врач может попросить вас сделать компьютерную томографию, ПЭТ или рентген. Вам будет рекомендовано не кормить ребенка грудью в течение нескольких часов после ПЭТ-сканирования. Грудное вскармливание и тесный контакт с ребенком после компьютерной томографии и рентгена безопасны.
Лечение
Не существует установленных правил лечения лимфомы во время беременности. Лечение подбирается индивидуально для каждой женщины.
Если необходимо лечение HL во время беременности, его следует отложить до конца первого триместра, если это возможно.
Если диагностирован во второй половине беременности и не вызывает никаких проблем, женщина часто может дождаться рождения ребенка, прежде чем начинать лечение. Это самый безопасный вариант для малыша.
Ваша медицинская бригада будет тщательно планировать ваше лечение. Это будет зависеть от:
- Типа лимфомы
- Где она находится в организме
- Является ли это индолентным или агрессивным подтипом лимфомы
- В каком триместре беременности вы находитесь?
- Ваши личные запросы
Химиотерапия
Химиотерапия часто используется для лечения лимфомы. Безопасность зависит от используемых комбинаций химиотерапии и срока беременности.
Применение химиотерапии во время беременности следует сопоставлять с влиянием лечения на выживаемость матери.
Первый триместр – первые 12 недель
В этот период формируются все основные органы и системы организма. Ваш будущий ребенок наиболее уязвим в это время. Существует более высокий риск выкидыша и мертворождения, если вы проходите химиотерапию в течение этого триместра. Химиотерапия и лучевая терапия в первом триместре беременности связаны с повышенным риском врожденных пороков развития
Ваш будущий ребенок наиболее уязвим в это время. Существует более высокий риск выкидыша и мертворождения, если вы проходите химиотерапию в течение этого триместра. Химиотерапия и лучевая терапия в первом триместре беременности связаны с повышенным риском врожденных пороков развития
Врачи по возможности откладывают лечение до второго триместра. Стероиды можно безопасно использовать во время беременности, чтобы отсрочить лечение.
Второй триместр и третий триместр
Химиотерапия обычно считается безопасной для нерожденных детей после первого триместра беременности. Плацента обеспечивает барьер, препятствующий попаданию многих лекарств к ребенку. Два режима химиотерапии, которые можно безопасно использовать при беременности, — это CHOP (циклофосфамид, доксорубицин, винкристин и преднизолон) и ABVD (доксорубицин, блеомицин, винбластин и дакарбазин)
Химиотерапия, проводимая во втором и третьем триместрах, связана с ранними родами и низкой массой тела при рождении.
Химиотерапия не рекомендуется на последнем месяце беременности. Это необходимо для того, чтобы показатели крови вернулись к норме.
Лучевая терапия
Лучевая терапия иногда назначается для лечения или купирования симптомов лимфомы. Лучевая терапия использует тип излучения.
Врачи могут подождать до рождения вашего ребенка, прежде чем использовать радиацию, поскольку существует небольшой риск для вашего будущего ребенка. Меры предосторожности могут быть приняты, если облучение требуется срочно. Его можно доставить в области, удаленные от матки, при тщательном ограждении брюшной полости от массивов.
Лучевая терапия после первого триместра обычно более вредна для вашего будущего ребенка. Это может увеличить риск развития рака у вашего ребенка. Последствия в более позднем возрасте включают снижение IQ и умственную отсталость
Таргетная терапия
Существует много типов таргетной терапии, используемых для лечения лимфомы. Таргетная терапия — это новые препараты, а это означает, что данных об их возможном долгосрочном воздействии на новорожденных не так много. Ритуксимаб — распространенная таргетная терапия, используемая для лечения лимфомы. Возможные риски для детей включают:
Таргетная терапия — это новые препараты, а это означает, что данных об их возможном долгосрочном воздействии на новорожденных не так много. Ритуксимаб — распространенная таргетная терапия, используемая для лечения лимфомы. Возможные риски для детей включают:
- Низкий уровень В-клеток при рождении
- Высокий риск преждевременных родов (до 37 недель)
- Низкий вес при рождении
Поддерживающее лечение
До 70% пациентов страдают от тошноты или рвоты после химиотерапии .
Не обнаружено связи между лечением метоклопрамидом, антигистаминными препаратами и противорвотными препаратами на основе ондансетрона и врожденными пороками развития.
Так как беременных женщин с лимфомой можно лечить антибиотиками из-за нейтропенической лихорадки. Безопасность пенициллина, цефалоспоринов и эритромицина для плода хорошо известна.
Часто задаваемые вопросы
Нужен ли аборт?
В редких случаях возникает необходимость прерывания беременности, если у кого-то диагностирована ЛХ. Это рекомендуется только в том случае, если заболевание настолько запущено, что жизнь мамы находится под угрозой или делает невозможными жизнеспособные роды.
Это рекомендуется только в том случае, если заболевание настолько запущено, что жизнь мамы находится под угрозой или делает невозможными жизнеспособные роды.
Повлияет ли лечение во время беременности на моего ребенка?
Имеющиеся данные свидетельствуют о том, что лечение лимфомы, проводимое в соответствии с рекомендациями, вряд ли окажет долгосрочное вредное воздействие на вашего ребенка.
Безопасно ли кормить грудью во время лечения лимфомы?
Химиотерапия, стероиды и таргетные препараты могут попасть в грудное молоко. После вашего лечения ваша медицинская бригада даст вам рекомендации по безопасности грудного вскармливания.
Могу ли я принять участие в клиническом исследовании лимфомы во время беременности?
Здоровье матери и ребенка часто означает, что беременные и кормящие женщины не могут участвовать в исследованиях
Повлияет ли беременность на мой прогноз?
Текущие данные свидетельствуют о том, что беременность не влияет на прогноз для женщин, перенесших лимфому.
ЛЕЧЕНИЕ РАННИХ СТАДИЙ ЛИМФОМЫ ХОДЖКИНА ВО ВРЕМЯ БЕРЕМЕННОСТИ
Основное содержание статьи
Агустин Авилес
Мексиканский институт социального обеспечения
Мария-Хесус Намбо
Мексиканский институт социального обеспечения
Нативидад Нери
Мексиканский институт социального обеспечения,
Ключевые слова
Гематологические злокачественные новообразования и беременность, лимфома Ходжкина и беременность, Химиотерапия во время беременности
Аннотация
Цель. Для оценки исхода для матери и плода у женщин, получавших химиотерапию во время беременности для лечения лимфомы Ходжкина (ЛХ) на ранних стадиях (IA и IIA), мы провели ретроспективный анализ 44 женщин с ЛХ на ранней стадии, диагностированных и получавших лечение в период с 1988 по 2010 г. , в третичном онкологическом центре.
, в третичном онкологическом центре.
Методы: Анализ данных ЛХ: клиническая характеристика и лечение; и особое внимание осложнениям у матери и плода; дети: физическое развитие, оценка успеваемости ученых, психологические, сердечные и неврологические функции и тесты интеллекта.
Результаты: 44 беременных женщины были зарегистрированы. Медиана возраста составила 29,4 года (от 21 до 37 лет); у большинства пациентов была стадия IIA (86%), объемное поражение средостения (78%) и поражение > 3 лимфоузлов; таким образом, у этих пациентов было зафиксировано неблагоприятное состояние. При предложении аборта было отказано. Все пациентки получали комбинированную химиотерапию: ABVD (адриамицин, блеомицин, винбластин и дакарбазин), даже в течение первого триместра, в стандартных дозах и схемах. Лучевая терапия, при необходимости, проводилась после родов в 39 случаях.пациенты. Акушерских осложнений не наблюдалось. Роды произошли в срок от 31 до 36 недель у 10 пациентов (22%) и > 37 недель в 34 случаях (77%). Четверо новорожденных были маловесными: 2012 (медиана) (диапазон: 1750 -2350) г. Клинических пороков развития не наблюдалось, развитие детей было нормальным, без признаков кардиального, неврологического поражения. Поведение, посещаемость учащихся и тесты на интеллект были в норме. При медиане наблюдения 120,4 (диапазон 48-299) месяцев выживаемость без прогрессирования и общая выживаемость составила 9.3% и 95% соответственно.
Четверо новорожденных были маловесными: 2012 (медиана) (диапазон: 1750 -2350) г. Клинических пороков развития не наблюдалось, развитие детей было нормальным, без признаков кардиального, неврологического поражения. Поведение, посещаемость учащихся и тесты на интеллект были в норме. При медиане наблюдения 120,4 (диапазон 48-299) месяцев выживаемость без прогрессирования и общая выживаемость составила 9.3% и 95% соответственно.
Заключение: Химиотерапия в качестве начальной терапии представляется лучшим терапевтическим подходом в данных условиях для пациентов с отличным результатом как для матери, так и для ребенка. Если необходима лучевая терапия, ее можно провести после родов
Загрузки
Данные для загрузки пока недоступны.
Аннотация 2841 |
Загрузок PDF 577
HTML-загрузки 794
Ссылки
1. Ризак Т., Мега А., Легаре Р., Кастильо Дж.: Управление гематологическими злокачественными новообразованиями во время беременности. Am J Hematol 2009;84:830-841. https://doi.org/10.1002/ajh.21547 PMid:19844988
Am J Hematol 2009;84:830-841. https://doi.org/10.1002/ajh.21547 PMid:19844988
2. Лишнер М., Авиви И., Апперли Дж. Ф. и др.: Гематологические злокачественные новообразования во время беременности. Руководящие принципы управления от международной консенсусной встречи. Дж. Клин Онкол 2016; 38: 501-508. https://doi.org/10.1200/JCO.2015.62.4445 PMid:26628463
3. Pinnix CC, Andraos, Migrom S, Fanale MA.: Управление лимфомой в условиях беременности. CurrHematolMalig Rep 2017; 12:251-256. https://doi.org/10.1007/s11899-017-0386-х
4. Лишнер М., Земликис Д., Дегендорфер П. и др.: Исходы для матери и плода после болезни Ходжкина во время беременности. Бр Дж Рак 1992;68:114-117. https://doi.org/10.1038/bjc.1992.21
5. Gelb AB, Vanderigne M, WarnkeRZ, KamelRA. Лимфома, связанная с беременностью. Рак 1996; 78:304-310. https://doi.org/10.1002/(SICI)1097-0142(19960715)78:23.0.CO;2-#
6. Walsh EM, O’Kane GM, CalooKA и др.: Всегда ли требуется химиотерапия при раке во время беременности? Irish J Med Sci (в печати) doi:10. 1007/s11845.017-017-1602-3.
1007/s11845.017-017-1602-3.
7. Перег Д., Корен Г., Лишнер М.: Лечение лимфомы Ходжкина и неходжкинской лимфомы у беременных. Гематология 2007;92:1230-1237. https://doi.org/10.3324/haematol.11097 PMid:17666365
8. Pinnix CC, Osborne EM, Chihama C, et al.: Исходы для матери и плода после лечения лимфомы Ходжкина и неходжкинской лимфомы, диагностированной во время беременности. JAMA Oncol 2016;3:1065-1069. https://doi.org/10.1001/jamaoncol.2016.1396 PMid:27227654
9. Evers AM, Advani R, Press OW и др.: Лимфома, возникающая во время беременности: антенатальная терапия, осложнения и материнская выживаемость в многоцентровом анализе. Дж. Клин Онкол 2013; 4132-4139.
10. Эйр Т.А., Лау И.Дж., Маккиллоп Л., Коллинз Г.П.: Ведение и противоречия классической лимфомы Ходжкина во время беременности. Бр Дж. Гематол 2015;169:513-630. https://doi.org/10.1111/bjh.13327 PMid:25684034
11. Авилес А., Нери Н.: Гематологические злокачественные новообразования и беременность. Заключительный отчет о 84 детях, получивших внутриутробную химиотерапию Clin Lymphoma 2001; 2:173-175. https://doi.org/10.3816/CLM.2001.n.023 PMid:11779294
https://doi.org/10.3816/CLM.2001.n.023 PMid:11779294
12. Авилес А., Нери Н., Намбо М.Дж.: Гематологические злокачественные новообразования и беременность. Лечить или не лечить во время беременности. Int J Cancer 2012; 131:2678-2683 https://doi.org/10.1002/ijc.27560 PMid:22511239
13. Sasse S, BröckelmannPJ, Goergen H и др.: Долгосрочное наблюдение за современным лечением лимфомы Ходжкина на ранней стадии. J ClinOncol 2017;35:1999-2007. https://doi.org/10.1200/JCO.2016.70.9410 PMid:28418763
14. Авилес А., Дельгадо С.: Проспективное исследование, сравнивающее химиотерапию, лучевую терапию и комбинированную терапию при лечении ранней стадии болезни Ходжкина с объемным поражением. Clin Lab Haematol 1998; 20:95-99. https://doi.org/10.1046/j.1365-2257.1998.00096.x PMid:9681219
15. Амит В., Барзилат М., Авиви И.: Управление гематологическими злокачественными новообразованиями. Особое внимание беременным женщинам. Наркотики 2015:75:1725-1738. https://doi.org/10.1007/s40265-015-0464-0 PMid:26416583
16. Клигер-Гроссман С., Джоканович Н., Читая Д., Корен Г.: Воздействие терапевтического излучения внутриутробно при лимфоме Ходжкина. Can Fam Phys 2009; 55:988,991.
Клигер-Гроссман С., Джоканович Н., Читая Д., Корен Г.: Воздействие терапевтического излучения внутриутробно при лимфоме Ходжкина. Can Fam Phys 2009; 55:988,991.
17. BoiceJB Jr, Miller RW.: Детский и взрослый рак после внутриутробного воздействия ионизирующего излучения. Тератология 1999;59:227,233.
18. Мазоракис М., Лирараки Э., Варверис С., Самара Э., Зурак К., Дамиасакис Дж.: Концепции дозы лучевой терапии вовлеченного поля для лимфомы Ходжкина или линейного ускорителя, оснащенного MLC. Атралентер Онкол 2009;85:355-363.
19. Weisbull CE, Elorantz S, Smedby K и др.: Беременность и риск рецидива при диагностике лимфомы Ходжкина. Дж. Клин Онкол 2016; 34:337-344. https://doi.org/10.1200/JCO.2015.63.3446 PMid:26668344
Боковая панель статьи
HTML
Опубликовано
1 января 2018 г.
ДОИ
https://doi.org/10.4084/mjhid.2018.006
Детали изделия
Как цитировать
Авилес, А. , Намбо, М.-Ж. и Нери, Н. (2018) «ЛЕЧЕНИЕ РАННИХ СТАДИЙ ЛИМФОМЫ ХОДЖКИНА ВО ВРЕМЯ БЕРЕМЕННОСТИ», Mediterranean Journal of Hematology and Infectious Diseases , 10(1), с. е2018006. doi: 10.4084/mjhid.2018.006.
, Намбо, М.-Ж. и Нери, Н. (2018) «ЛЕЧЕНИЕ РАННИХ СТАДИЙ ЛИМФОМЫ ХОДЖКИНА ВО ВРЕМЯ БЕРЕМЕННОСТИ», Mediterranean Journal of Hematology and Infectious Diseases , 10(1), с. е2018006. doi: 10.4084/mjhid.2018.006.
Секция
Оригинальные статьи
Это статья в открытом доступе, распространяемая в соответствии с лицензией Creative Commons Attribution License (https://creativecommons.org/licenses/by-nc/4.0), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии, что оригинал работа цитируется правильно.
Передача авторских прав и разрешений на воспроизведение частей опубликованных документов. Авторы передают авторские права на свои статьи Институту гематологии Католического университета в Риме. Для воспроизведения частей (таблиц или иллюстраций) опубликованных статей не требуется официального разрешения, при условии, что источник указан надлежащим образом и воспроизведение не преследует коммерческих целей.
