Как заполнять добровольное информированное согласие на проведение прививок: Образец заполнения Добровольного информационного согласия
Образец заполнения согласия на прививку ребенку
Содержание
- Прививки: образец добровольного согласия или отказа
- ДОБРОВОЛЬНОЕ ИНФОРМИРОВАННОЕ СОГЛАСИЕ
- НА ПРОВЕДЕНИЕ ПРОФИЛАКТИЧЕСКИХ ПРИВИВОК ДЕТЯМ
Добровольное информированное согласие
на проведение профилактических прививок детям или
отказа от них
1 . Я, нижеподписавшийся(-аяся)
____________________________________________________________________
(фамилия, имя, отчество родителя (иного законного представителя) несовершеннолетнего в возрасте до 15 лет, несовершеннолетнего больного наркоманией в возрасте до 16 лет)/несовершеннолетнего в возрасте старше 15 лет, несовершеннолетнего больного наркоманией в возрасте старше 16 лет)
________________________________________________________ года рождения,
(указывается год рождения несовершеннолетнего в возрасте старше 15 лет, несовершеннолетнего больного наркоманией в возрасте старше 16 лет)
настоящим подтверждаю то, что проинформирован(а) врачом:
а) о том, что профилактическая прививка — это введение в организм человека медицинского иммунобиологического препарата для создания специфической невосприимчивости к инфекционным болезням;
б) о необходимости проведения профилактической прививки, возможных поствакцинальных осложнениях, последствиях отказа от нее;
в) о медицинской помощи при проведении профилактических прививок, включающей обязательный медицинский осмотр несовершеннолетнего в возрасте до 18 лет перед проведением прививки (а при необходимости — медицинское обследование), который входит в Программу государственных гарантий оказания гражданам Российской Федерации бесплатной медицинской помощи и предоставляется в государственных и муниципальных учреждениях здравоохранения бесплатно;
г) о выполнении предписаний медицинских работников.
2. Я проинформирован(а) о том, что в соответствии с пунктом 2 статьи 5 Федерального закона от 17 сентября 1998 г. N 157-ФЗ «Об иммунопрофилактике инфекционных болезней»*(1) отсутствие профилактических прививок влечет:
- запрет для граждан на выезд в страны, пребывание в которых в соответствии с международными медико-санитарными правилами либо международными договорами Российской Федерации требует конкретных профилактических прививок;
- временный отказ в приеме граждан в образовательные и оздоровительные учреждения в случае возникновения массовых инфекционных заболеваний или при угрозе возникновения эпидемий;
- отказ в приеме граждан на работы или отстранение граждан от работ, выполнение которых связано с высоким риском заболевания инфекционными болезнями (постановление Правительства Российской Федерации от 15 июля 1999 г. N 825 «Об утверждении перечня работ, выполнение которых связано с высоким риском заболевания инфекционными болезнями и требует обязательного проведения профилактических прививок»*(2)).

Я имел(а) возможность задавать любые вопросы и на все вопросы получил(а) исчерпывающие ответы.
Получив полную информацию о необходимости проведения профилактической прививки
возможных прививочных реакциях и поствакцинальных осложнениях, последствиях отказа от нее, я подтверждаю, что мне понятен смысл всех терминов, и:
добровольно соглашаюсь на проведение прививки*(3)
____________________________________________________________________
(название прививки)
добровольно отказываюсь от проведения прививки
___________________________________________________________________,
(название прививки)
несовершеннолетнему ____________________________________________________________________
(указывается фамилия, имя, отчество и год рождения несовершеннолетнего
в возрасте до 15 лет/несовершеннолетнего больного наркоманией в возрасте до 16 лет)
____________________________________________________________________
(фамилия, имя, отчество родителя (иного законного представителя) несовершеннолетнего в возрасте до 15 лет, несовершеннолетнего больного наркоманией в возрасте до 16 лет)/несовершеннолетнего в возрасте старше 15 лет, несовершеннолетнего больного наркоманией в возрасте старше 16 лет)
Я свидетельствую, что разъяснил все вопросы, связанные с проведением профилактических прививок несовершеннолетнему, и дал ответы на все вопросы.
Врач ________________________
(фамилия, имя, отчество)
Дата__________________________ Подпись
Информация для врачей и родителей о проведении профилактических прививок
____________________
*(1) Собрание законодательства Российской Федерации, 1998, N 38, ст. 4736; 2000, N 33, ст. 3348; 2003, N 2, ст. 167; 2004, N 35, ст. 3607; 2005, N 1 (ч. 1), ст. 25; 2006, N 27, ст. 2879; 2007, N 43, ст. 5084; N 49, ст. 6070; 2008, N 30 (ч. 2), ст. 361; N 52 (ч. 1), ст. 6236; 2009, N 1, ст. 21.
*(2) Собрание законодательства Российской Федерации, 1999, N 29, ст. 3766.
*(3) Нужное подчеркнуть.
*(4) Заполняется для несовершеннолетних в возрасте до 15 лет, несовершеннолетних больных наркоманией в возрасте до 16 лет.
Прививки: образец добровольного согласия или отказа
В соответствии с пунктом 5.2.101 Положения о Министерстве здравоохранения и социального развития Российской Федерации, утвержденного Постановлением Правительства Российской Федерации от 30 июня 2004 г. N 321 (Собрание законодательства Российской Федерации, 2004, N 28, ст. 2898), и в целях профилактики и снижения инфекционных заболеваний, управляемых средствами специфической профилактики у детей в Российской Федерации, приказываю:
N 321 (Собрание законодательства Российской Федерации, 2004, N 28, ст. 2898), и в целях профилактики и снижения инфекционных заболеваний, управляемых средствами специфической профилактики у детей в Российской Федерации, приказываю:
1. Утвердить рекомендуемый образец добровольного информированного согласия на проведение профилактических прививок детям или отказа от них согласно приложению.
2. Рекомендовать руководителям органов управления здравоохранением субъектов Российской Федерации использовать образец добровольного информированного согласия на проведение профилактических прививок детям или отказа от них, утвержденный настоящим Приказом, при организации работы по проведению профилактических прививок.
НА ПРОВЕДЕНИЕ ПРОФИЛАКТИЧЕСКИХ ПРИВИВОК ДЕТЯМ
«СОГАЗ-Мед»:вакцинация — kgsp3.ru
Телефон регистратуры 201-28-64, 234-03-82 | Главная > «СОГАЗ-Мед»:вакцинация и ревакцинация – укрепляем здоровье С начала 2021 года в Россиипроводится вакцинация от коронавирусной инфекции.
Кому прививку рекомендуется делать в первую очередь? В приоритетном порядке вакцинации подлежат:лица старше 60 лет;работники медицинских, образовательных организаций, организаций социального обслуживания и многофункциональных центров;лица, проживающие в организациях социального обслуживания;люди с хроническими заболеваниями; граждане, проживающие в городах с численностью населения 1 млн. и более. Как записаться на прививку? Запись и выбор места вакцинации доступны на портале Госуслуг. Также в субъектах РФ может осуществляться запись на прививку по телефонам или на сайтах медицинских организаций. Как проходит вакцинация? Вакцинация проводится бесплатно, с собой необходимо взять паспорт и полис ОМС. На приёме пациенту сначала разъясняются возможные поствакцинальные реакции и осложнения, а также последствия отказа от проведения вакцинации. Перед вакцинацией медработник осматривает пациента, измеряет температуру, показатели насыщения крови кислородом (сатурации), частоту сердечных сокращений, артериального давления, проводит диагностику дыхательной и сердечно-сосудистой системы. Результаты осмотра, а также разрешение на введение вакцины или отвод от вакцинации ввиду наличия противопоказаний для проведения вакцинации должны быть зафиксированы врачом в медицинской документации.
Вакцинация (укол) проводится внутримышечно в верхнюю часть плеча. Затем следует наблюдение после процедуры в течение 30 минут.
Если вы выбрали для вакцинации препарат «Спутник V» («Гам-Ковид-Вак») и «ЭпиВакКорона», обратите внимание: ввиду того, что эта вакцина двухкомпонентная, вам необходимо будет повторно обратиться в медицинское учреждение для вакцинации вторым компонентом на 21 день (без учета вакцинации) после прививки. Какие существуют рекомендации после вакцинации? В течение 3-х дней после вакцинации рекомендуется не мочить место инъекции, не посещать баню, сауну, не принимать алкоголь, избегать чрезмерных физических нагрузок. При возникновении побочных эффектов после вакцинации рекомендуется обратиться к врачу.
Кому нельзя делать прививку от коронавируса? С противопоказаниями к вакцинации по всем вакцинам, зарегистрированным в Российской Федерации, вы можете ознакомиться на сайте: стопкоронавирус.рф.
Есть ли ограничения для беременных? С июня 2021 года в соответствии с рекомендациями Минздрава по вакцинации против COVID-19 вакцина «Гам-Ковид-Вак» («Спутник V») используется для вакцинации беременных. Беременным женщинам перед проведением вакцинации необходимо проконсультироваться со своим лечащим врачом.
Что такое ревакцинация и зачем она нужна? Ревакцинация — надежный способ защитить себя от COVID-19. С учетом напряженной эпидемиологической обстановки, рекомендуется спустя полгода после вакцинации сделать повторную прививку – ревакцинироваться любой вакциной, зарегистрированной в Российской Федерации. Выбрать можно любую из них, независимо от того, каким препаратом вы вакцинировались первый раз.
Вы можете сделать повторную прививку, если после предыдущей вакцинации от COVID-19 или после перенесенного заболевания прошло более 6 месяцев, у вас нет обострения хронического заболевания, вы не болели ОРВИ в течение 2-х недель до прививки и не болеете в момент вакцинации, вам исполнилось 18 лети в последние 30 дней вы не делали других прививок. Для ревакцинации необходимо иметь с собой паспорт, полис ОМС и сертификат о вакцинации. При возникновении сложности с записью на вакцинацию вы можете обратиться в страховую медицинскую организацию. Генеральный директор страховой компании «СОГАЗ-Мед» Дмитрий Валерьевич Толстов отмечает: «Страховые медицинские организации помогают людям узнать о своих правах в системе ОМС и воспользоваться ими. Мы верим, что повышение правовой грамотности застрахованных приведет к улучшению качества медицинского обслуживания и позволит всей системе обязательного медицинского страхования выйти на более высокий уровень. Ответственное отношение к своему здоровью – личное дело каждого, а наша задача – помочь людям узнать о своих правах и получить качественную бесплатную медицинскую помощь».
Если вы застрахованы в компании «СОГАЗ-Мед» и у вас возникли вопросы о системе ОМС, связанные с получением полиса, медицинской помощи или качеством её оказания, вы можете обратиться за помощью к страховым представителям на сайте sogaz-med. |
Руководство MDHHS IRB по информированному согласию
Обнаружен неподдерживаемый браузер
Используемый в настоящее время веб-браузер не поддерживается, и некоторые функции этого сайта могут работать не так, как предполагалось. Пожалуйста, установите современный браузер, такой как Chrome, Firefox или Edge, чтобы использовать все функции, которые может предложить Michigan.gov.
Поддерживаемые браузеры
- Google Chrome
- Сафари
- Microsoft Edge
- Фаерфокс
Руководство MDHHS IRB по информированному согласию
Принципы Белмонта в большинстве случаев требуют, чтобы субъекты исследования понимали исследование, в котором их просят принять участие, и чтобы субъекты добровольно давали согласие на участие в этом исследовании. В этом руководстве обсуждаются положения Общего правила 2018 г. (вступление в силу ожидается 21 января 2019 г.).), но может применяться даже до 21 января 2019 г. Если информация в данном руководстве является новой в соответствии с Общим правилом 2018 г., эта информация выделена жирным шрифтом.
В этом руководстве обсуждаются положения Общего правила 2018 г. (вступление в силу ожидается 21 января 2019 г.).), но может применяться даже до 21 января 2019 г. Если информация в данном руководстве является новой в соответствии с Общим правилом 2018 г., эта информация выделена жирным шрифтом.
Прежде чем привлекать кого-либо к участию в исследовании, исследователь обычно должен получить имеющее юридическую силу информированное согласие этого лица или его законного представителя. Исследователь должен делать это только при обстоятельствах, которые предоставляют испытуемому или его представителю достаточную возможность для обсуждения и принятия решения об участии или неучастии. Процесс должен происходить при обстоятельствах, сводящих к минимуму возможность принуждения или неправомерного влияния. Информация, предоставляемая для облегчения информированного согласия, должна быть на языке, понятном лицу, у которого запрашивается согласие. Предоставленная информация должна включать информацию, которую разумный человек хотел бы иметь, чтобы принять обоснованное решение об участии. Информация должна быть представлена таким образом, чтобы не просто предоставлять отдельные факты, а вместо этого способствовать пониманию причин, по которым человек может или не хочет участвовать в исследовании. Представленная информация не может содержать оправдательных формулировок, с помощью которых субъект или законный представитель вынужден отказаться или создать видимость отказа от каких-либо законных прав субъекта или освобождает или делает вид, что освобождает исследователя, спонсора, учреждение или его агентов. от ответственности за халатность.
Информация должна быть представлена таким образом, чтобы не просто предоставлять отдельные факты, а вместо этого способствовать пониманию причин, по которым человек может или не хочет участвовать в исследовании. Представленная информация не может содержать оправдательных формулировок, с помощью которых субъект или законный представитель вынужден отказаться или создать видимость отказа от каких-либо законных прав субъекта или освобождает или делает вид, что освобождает исследователя, спонсора, учреждение или его агентов. от ответственности за халатность.
Правила включают требования к тому, что должен включать документ об информированном согласии, используемый для облегчения первоначального процесса информированного согласия:
- Информированное согласие должно начинаться с краткого и целенаправленного представления ключевой информации, которая, скорее всего, поможет законно уполномоченный представитель. Рекомендации по включению в эту информацию следующие:
- Заявление о том, что проект является исследовательским и что участие в исследовании является добровольным.

- Краткое описание исследования, включая:
- назначение,
- продолжительность участия субъекта и
- виды деятельности/процедур, в которых будут участвовать субъекты.
- Предсказуемые риски или неудобства для участников.
- Предсказуемые и ожидаемые выгоды для участников.
- Альтернативы участию (например, процедуры или курсы лечения или возможные альтернативные клинические испытания), если таковые имеются.
- Заявление о том, что проект является исследовательским и что участие в исследовании является добровольным.
- Любая дополнительная информация, объясняющая цель исследования, ожидаемую продолжительность участия субъектов и процедуры, которые необходимо соблюдать (включая определение процедур, которые являются экспериментальными), которая не была включена в итоговое заявление.
- Любое описание разумно предсказуемых рисков или неудобств, не включенное в итоговое заявление.

- Любое описание пользы для субъекта или других лиц, которую можно обоснованно ожидать от исследования, но не включенное в итоговое заявление.
- Любое раскрытие информации о соответствующих альтернативных процедурах или курсах лечения, которые могут быть полезны субъекту и которые не были включены в итоговое заявление.
- Заявление, описывающее степень, в которой будет сохраняться конфиденциальность записей, идентифицирующих субъекта.
- Объяснение того, к кому обращаться за ответами на соответствующие вопросы об исследовании и правах субъектов исследования, а также к кому обращаться в случае причинения субъекту травмы, связанной с исследованием.
- Заявление о том, что участие является добровольным, отказ от участия не влечет за собой штрафа или потери преимуществ, на которые субъект в ином случае имеет право, и субъект может прекратить участие в любое время без штрафных санкций или потери преимуществ, на которые субъект в противном случае имеет право.

- Если исследование включает сбор идентифицируемой частной информации или идентифицируемых биообразцов, должно быть включено одно из следующих утверждений:
- Заявление о том, что идентификаторы могут быть удалены из идентифицируемой частной информации или идентифицируемых биообразцов и что после такого удаления информация или биообразцы могут быть использованы для будущих исследований или переданы другому исследователю для будущих исследований без дополнительного информированного согласия со стороны субъекта или законного представителя, если это возможно, или
- Заявление о том, что информация субъекта или биообразцы, собранные в рамках исследования, даже если идентификаторы удалены, не будут использоваться или распространяться для будущих исследований.
В случае необходимости в документе об информированном согласии могут также потребоваться следующие элементы:
- Заявление о том, что лечение или процедура могут быть сопряжены с риском для субъекта (или для эмбриона или плода, если субъект является или может забеременеть), которые в настоящее время невозможно предвидеть.

- Предполагаемые обстоятельства, при которых участие испытуемого может быть прекращено исследователем без учета согласия испытуемого или его законного представителя.
- Любые дополнительные расходы субъекта, которые могут возникнуть в результате участия.
- Последствия решения субъекта выйти из исследования и процедуры упорядоченного прекращения участия субъекта.
- Субъекту будет предоставлено заявление о том, что в ходе исследования были получены важные новые данные, которые могут относиться к готовности субъекта продолжать участие.
- Примерное количество задействованных субъектов.
- Заявление о том, что биообразцы субъекта (даже если идентификаторы удалены) могут быть использованы для получения коммерческой прибыли, и будет ли субъект участвовать в этой коммерческой прибыли.
- Заявление о том, будут ли клинически значимые результаты исследований, включая результаты отдельных исследований, раскрываться субъектам, и если да, то при каких условиях.

- Для исследований с использованием биообразцов, независимо от того, будет ли исследование (если известно) или может включать секвенирование всего генома (т. е. секвенирование зародышевой линии или соматического образца человека с целью получения последовательности генома или экзома этого образца).
В Общем правиле 2018 г. есть положения о «широком согласии на хранение, обслуживание и повторное использование в исследованиях идентифицируемой частной информации или идентифицируемых биообразцов». IRB MDHHS будет рассматривать запросы на использование процесса «широкого согласия» в каждом конкретном случае.
За исключением некоторых обстоятельств, информированное согласие на исследование оформляется письменной формой информированного согласия, подписанной субъектом или его законным представителем. Копия письменной формы должна быть передана лицу, подписавшему форму информированного согласия.
Требование о подписи (хотя обычно это не требование об информированном согласии) может быть отменено ЭСО в следующих случаях: форма будет единственной записью, связывающей предмет и исследование. Если это является причиной отказа от требования о подписи, каждого субъекта (или законного представителя) спросят, хочет ли субъект получить документацию, связывающую субъекта с исследованием, и пожелания субъекта будут иметь преимущественную силу.
Если это является причиной отказа от требования о подписи, каждого субъекта (или законного представителя) спросят, хочет ли субъект получить документацию, связывающую субъекта с исследованием, и пожелания субъекта будут иметь преимущественную силу.
Управление здравоохранения штата Орегон: Закон об иммунизации штата Орегон: Законы и правила
Перейти к основному содержанию
Официальный сайт штата Орегон.
Учиться
Откуда ты знаешь »
(как определить веб-сайт Oregon.gov)
Официальный сайт штата Орегон »
Поиск
Временные и предлагаемые поправки к административным правилам
В настоящее время нет
Законы и правила об иммунизации
Законы штата Орегон определены в Пересмотренных уставах штата Орегон ( ORS ). Административные правила штата Орегон ( OAR ) определяют порядок реализации этих законов.
ОАР 333-046-0010 до 0130 (программа VFC)
Эти правила.
OAR 333-047-0010–0050 (Отчетность по вакцинам, поставляемым государством)
Настоящие правила распространяются на:
- 333-047-0010 Определения, используемые в вакцине Правила подотчетности
- 333-047-0030 Обучение
- 333-047-0040 Учет вакцины
- 333-047-0050 Срок подачи отчетов
OAR 333-049-0010 до 0130 (Реестр иммунизации)
Настоящие правила распространяются на:
- 333-049-0010 Определения
- 333-049-0020 Цель и намерение
- 333-049-0030 Регистрация
- 333-049-0040 Сбор и передача информации
- 333-049-0050 Отчетность в Реестр иммунизации
- 333-049-0060 Доступ к записям иммунизации
- 333-049-0065 Сборы
- 333-049-0070 Ограничения доступа к информации в Реестре иммунизации и Системе отслеживания и отзыва
- 333-049-0080 Ограничения на передачу информации из Реестра иммунизации
- 333-049-0090 Уведомление о необходимых прививках, скрининге слуха или скрининге свинца
- 333-049-0100 Конфиденциальность
- 333-049-0120 Удаление информации из реестра и системы отслеживания и отзыва
- 333-049-0130 Безопасность
ORS 433. 235–433.284 (борьба с болезнями в школах)
235–433.284 (борьба с болезнями в школах)
OAR 333-050-0010 до 0140 (Правила школьной иммунизации)
Настоящие правила охватывают:
- 333-050-0010 Определения, используемые в Правилах вакцинации
- 333-050-0020 Цель и намерение и резиденты
- 333- 050-0040 Необходимые заявления (записи)
- 333-050-0050 Требования к иммунизации
- 333-050-0060 Первичная проверка записей
- 333-050-0070 Вторичная проверка записей
- 333 -050-0090 Обзор приказов об исключении
- 333-050-0095 Соответствие требованиям школы/учреждения
- 333-050-0100 0120 Графики прививок для интервалов между дозами
- 333-050-0130 Вторая доза кори в учреждениях высшего образования
- 333-050-0140 Вторая доза кори в муниципальных колледжах
90 009 333-050-0080 Исключение
OAR 333-019-1030 Требования к вакцинации против COVID-19 для учителей и школьного персонала (английский)
- Другие языки
ORS 109. 640 (права несовершеннолетних)
640 (права несовершеннолетних)
ORS 689.005–689.995 (фармацевты; аптеки; продажа лекарств)
- Аптечные протоколы
ОАР 855-019- 0100–0320 (Лицензирование фармацевтов)
Эти правила распространяются на:
- 855-019-0100 Приложение
- 855-019-0110 Определения
- 855-019-0120 Лицензия
- 855-019-0122 Продление лицензии фармацевта
- 855-019-0123 Ограничения ответственности для волонтеров
- 855-019-0125 Коучинг от Правления и Персонала
- 855-019-0130 Лицензирование по принципу взаимности
- 855-019-0140 NAPLEX Score Transfer
- 855-019-0150 Иностранные выпускники аптек
- 855-019-0160 Ядерные фармацевты
- 855-019-0170 Восстановление лицензии
- 855-019-0171 Восстановление отозванной или переданной лицензии
- 855-019-0200 Общие обязанности фармацевта
- 855-019-0205 Обязанность сообщать
- 855-019-0210 Обязанности фармацевта, получающего рецепт
- 855-019-0220 Проверка использования лекарств (DUR)
- 855-019-0230 Консультации
- 855-019-0240 Практика фармацевта-консультанта
- 855-019-0250 Управление медикаментозной терапией
- 855-019-0260 Совместное управление лекарственной терапией
- 855-019-0264 Государственные протоколы управления лекарственной терапией
- 855-019-0265 Управление лекарствами
- 855-019-0270 Квалификация
- 855-019-0280 Протоколы, политики и процедуры
- 855-019-0290 Ведение учета и отчетности
- 855-019-0300 Обязанности главного фармацевта
- 855-019-0310 Основания для дисциплинарного взыскания
- 855-019-0320 Петиция о восстановлении лицензии фармацевта
ORS 433.

 Ответы на самые частые и волнующие вопросы граждан по даннойтематикеданы в этой статье.
Ответы на самые частые и волнующие вопросы граждан по даннойтематикеданы в этой статье. Выдается для заполнения анкета и оформляется информированное добровольное согласие на медицинское вмешательство, а также информационная памятка.
Выдается для заполнения анкета и оформляется информированное добровольное согласие на медицинское вмешательство, а также информационная памятка.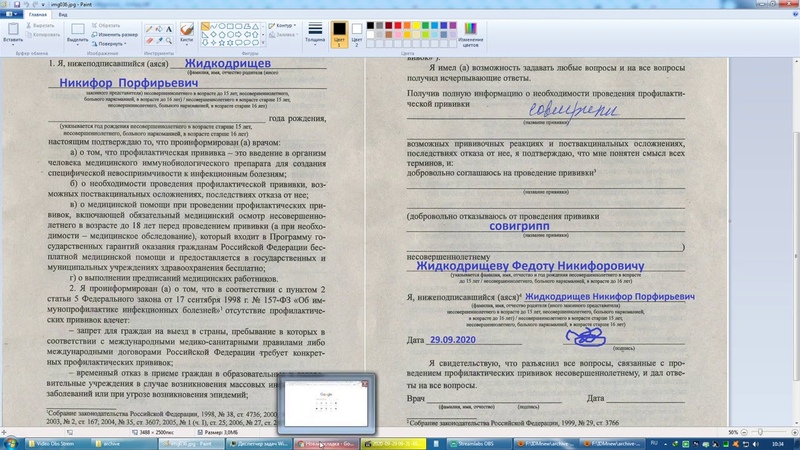 А для вакцины «КовиВак» введение второго компонента осуществляется с интервалом 14 дней. На эту процедуру вас запишут автоматически, она будет полностью аналогичной первому этапу вакцинации.
А для вакцины «КовиВак» введение второго компонента осуществляется с интервалом 14 дней. На эту процедуру вас запишут автоматически, она будет полностью аналогичной первому этапу вакцинации.
 Записаться можно через Госуслуги или иным доступным в регионе способом.
Записаться можно через Госуслуги или иным доступным в регионе способом. ru, используя онлайн-чат, по телефону круглосуточного контакт-центра 8-800-100-07-02 (звонок по России бесплатный) или в офисах компании «СОГАЗ-Мед».
ru, используя онлайн-чат, по телефону круглосуточного контакт-центра 8-800-100-07-02 (звонок по России бесплатный) или в офисах компании «СОГАЗ-Мед».