Иммунодефицит у детей: Иммунодефицит у ребенка — виды, симптомы и лечение у детей
Первичный иммунодефицит у детей — причины возникновения и лечение иммунного дефицита в Новосибирске
Первичный иммунодефицит (ПИД) ‒ это нарушение работы иммунной системы, ее неспособность должным образом сопротивляться антигенам. Код по МКБ-10 ‒ D80.
В отличие от вторичных иммунодефицитов, связанных со старением, длительным приемом лекарств, ВИЧ, недостаточностью питания, первичный обычно вызван генетическими дефектами. Или, в более редких случаях, проблемами в процессе внутриутробного развития.
Разновидности ПИД
Первичный иммунодефицит ‒ группа из более чем 350 заболеваний. По симптоматике они могут значительно различаться. Такая высокая вариабельность проявлений объясняется сложностью иммунной системы, ее многокомпонентностью. Последствия зависят от того, какое из ее звеньев вышло из строя.
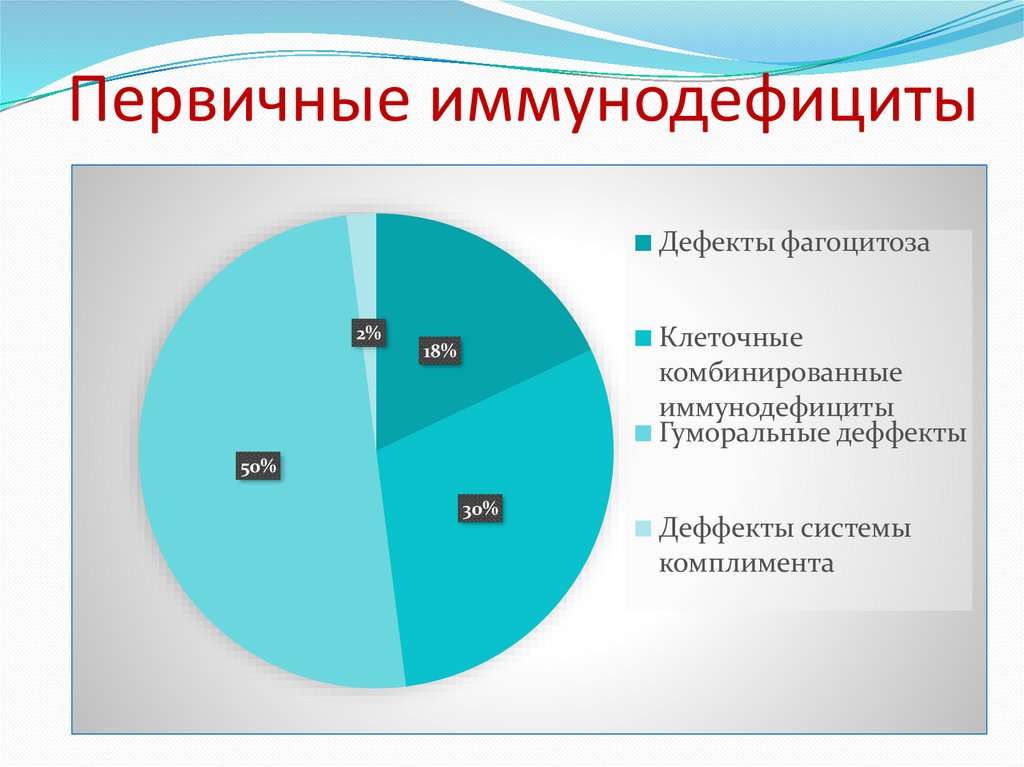
Выделяют 5 основных подгрупп ПИД.
№ | название | *распространенность, % |
1 | Нарушения клеточного иммунитета | 5 |
2 | Расстройства гуморального иммунитета (их еще называют синдромами недостаточности антител) | 70 |
3 | Комбинированные первичные иммунодефициты | 16 |
4 | Дефекты фагоцитозов | 10 |
5 | Дефициты белков комплементов | 1 |
*Распространенность той или иной разновидности недуга варьируется в зависимости от региона.
Симптомы
Даже в рамках одной подгруппы первичных иммунодефицитов клиническая картина может очень сильно отличаться. Тем не менее существует общая симптоматика:
- Более тяжелое, чем это обычно бывает, протекание вирусных инфекций;
- Особая уязвимость к грибковым заболеваниям;
- Повышенная чувствительность к бактериальным агентам;
- Анемия;
- Отклонения в развитии.
Люди с ПИД чаще других сталкиваются с тяжелыми инфекционными осложнениями. Могут оказаться поражены органы дыхания, кожа, ЖКТ. Лекарственные препараты действуют на человека, страдающего от неисправности иммунной системы, слабее или не помогают вообще. Любое инфекционное заболевание может закончиться для такого пациента в стационаре.
Как часто встречается?
Согласно статистике тяжелые дефекты иммунитета достаточно редки: речь идет об 1 заболевшем ребенке к 10 000 новорожденных. Вариации ПИД с легким течением распространены больше: 1 на 1 000.
Специалисты считают, что реальное количество больных врожденным или наследственным иммунодефицитом серьезно недооценивается. Далеко не все жертвы этого расстройства получают верный диагноз.
Когда проявляется?
В большинстве случаев проявления первичного иммунодефицита дают о себе знать сразу после рождения. В некотором случае они откладываются на 5-7 месяцев (иногда до года). По прошествии этого периода снижаются защитные функции материнских антител.
Слабо выраженные формы ПИД часто долгое время остаются незамеченными врачами. Иногда их диагностируют даже у взрослых. Человек может десятки лет страдать от аллергии, вирусов, инфекций, не догадываясь об истинных причинах.
Диагностика
Как правило для выявления и подтверждения врожденного нарушения защитных механизмов организма используется комплекс мер. Среди них:
Общий осмотр
При тяжелых формах этого простейшего диагностического метода достаточно для того, чтобы заподозрить высокую вероятность проблем с иммунитетом. У детей с подобными расстройствами часто наблюдаются грибковые болезни кожи, псориаз, эрозии слизистых оболочек, отеки подкожной жировой клетчатки.
У детей с подобными расстройствами часто наблюдаются грибковые болезни кожи, псориаз, эрозии слизистых оболочек, отеки подкожной жировой клетчатки.
Физикальный осмотр пациента также производится для того, чтобы корректно интерпретировать результаты других форм диагностики.
Лабораторные анализы
Назначают клинический анализ крови. Изучают общий белок и белковые фракции IgG, IgA, IgM в сыворотке крови.
Исследование иммунограммы
Чтобы определить, какие именно звенья иммунной системы оказались повреждены, проводят целую серию тестов. Определяют количество разных субклассов IgG.
Молекулярно-генетический анализ
Его обычно проводят, когда факт наличия ПИД уже подтвержден, но нужно установить конкретный вид расстройства. Например, таким образом диагностируют синдромы Ди Джорджи, Брутона, Вискотта-Олдрича и т.д.
Лечение
Важно понимать, что при врожденных изъянах иммунитета рядовые иммуномодуляторы не помогут. Однако способы лечения ПИД существуют:
Заместительная терапия
Работает при иммунной недостаточности гуморального характера. Пациенту ежемесячно вводят донорский иммуноглобулин недостающих классов. Регулярное введение препарата способно поддерживать иммунную систему на должном уровне. В результате у проходящего лечение наблюдается стойкая ремиссия, риск возникновения тяжелых осложнений в случае заражения инфекционным заболеванием существенно снижается.
Пациенту ежемесячно вводят донорский иммуноглобулин недостающих классов. Регулярное введение препарата способно поддерживать иммунную систему на должном уровне. В результате у проходящего лечение наблюдается стойкая ремиссия, риск возникновения тяжелых осложнений в случае заражения инфекционным заболеванием существенно снижается.
Пересадка костного мозга, стволовых клеток
Рекомендуется при клеточных и комбинированных видах иммунодефицита. Донорский материал полностью замещает исходный. Эффективность этой методики крайне высока, однако и риски, связанные с ее реализацией, значительны.
Профилактика
Как снизить риски для человека с диагнозом ПИД?
В первую очередь требуется ограничить контакты с возможными источниками инфекционного заражения, избегать переохлаждения, обращаться к врачу при первых признаках недомогания.
К профилактическим мерам относят также консультирование перед зачатием ребенка, пренатальный скрининг.
Прогноз
Возможные исходы заболевания сильно варьируются в зависимости от многих факторов:
- Вида патологии.
 Тяжелые виды врожденного иммунодефицита могут привести к смерти в раннем возрасте. Легкие, при регулярном обращении к заместительной терапии, можно взять под контроль.
Тяжелые виды врожденного иммунодефицита могут привести к смерти в раннем возрасте. Легкие, при регулярном обращении к заместительной терапии, можно взять под контроль. - Сроках постановки диагноза. Ранняя диагностика существенно повышает вероятность благоприятного прогноза.
- Образа жизни. Курение, употребление наркотических веществ для людей с нарушением защитных способностей организма категорически противопоказаны.
Популярные акции
Смотреть все акции
Снижение цены на инъекцию красоты
Акция на инъекцию препарата «Диспорт»
Подробнее…
Консультация ЛОР-врача
Акция на консультацию лор-врача!
Подробнее…
SMAS лифтинг тела на аппарате UCOS HIFU
Акция на процедуру «SMAS-лифтинг тела на аппарате UCOS HIFU»!
Подробнее…
Снижение цен на консультации
Уважаемые Пациенты!
Только до конца сентября Вы можете пройти консультацию по сниженным ценам.
Подробнее…
симптомы, причины, диагностика, лечение| АО «Медицина» (клиника академика Ройтберга)
Содержание статьи
- Общие сведения
- Причины первичных иммунодефицитов
- Виды патологии
- Симптомы первичных иммунодефицитов
- Диагностика заболевания
- Лечение первичных иммунодефицитов
- Вопросы и ответы
- Источники
Первичные иммунодефициты — общее название группы патологических состояний, характеризующихся нарушениями в работе иммунитета человека. В большинстве случаев заболевания носят врождённый характер. Симптоматика зависит от типа расстройства, имеющегося у ребёнка или взрослого. Часто пациенты страдают от повышенной восприимчивости к бактериальным и вирусным инфекциям.
В большинстве случаев заболевания носят врождённый характер. Симптоматика зависит от типа расстройства, имеющегося у ребёнка или взрослого. Часто пациенты страдают от повышенной восприимчивости к бактериальным и вирусным инфекциям.
Общие сведения
Иммунодефицитные состояния стали предметом клинических исследований во второй половине XX века. Современная иммунология выделяет более двух десятков заболеваний рассматриваемого типа. Значительная часть патологий относится к генетическим дефектам. Наиболее часто диагноз «первичный иммунодефицит» ставится детям в возрасте до пяти лет. Взрослые могут страдать от слабовыраженных форм заболевания. Некоторые пациенты узнают о том, что являются носителями первичного иммунодефицита, только после прохождения диагностических тестов в клинических условиях. Отдельные типы патологии сопровождаются многочисленными пороками развития и отличаются высокой летальностью.
Причины первичных иммунодефицитов
Первичные иммунодефициты формируются на этапе внутриутробного развития плода под действием внешних факторов. Заболевания этой группы часто осложняются пороками — дистрофиями, дефектами органов, ферментопатиями.
Заболевания этой группы часто осложняются пороками — дистрофиями, дефектами органов, ферментопатиями.
Иммунологи выделяют две основных причины развития иммунных патологий:
- генетические мутации;
- тератогенные воздействия (токсины, медикаменты, вирусные и бактериальные инфекции, перенесённые женщиной в период вынашивания плода).
Иммунодефицитные состояния могут характеризоваться как идиопатические при отсутствии в анамнезе пациента сведений о генетических патологиях или тератогенных воздействиях.
Виды патологии
Общее количество патологических состояний, относящихся к первичным иммунодефицитам, превышает два десятка наименований. Базовая классификация, используемая иммунологами, предусматривает выделение пяти основных групп заболеваний:
- первичных дефицитов клеточного иммунитета — проявляются на фоне низкой активности или недостаточного количества T-лимфоцитов;
- первичных дефицитов гуморального иммунитета — развиваются из-за сниженной функции B-лимфоцитов и нарушений в синтезе иммуноглобулинов;
- комбинированных первичных иммунодефицитов — становятся следствием снижения активности клеточных и гуморальных звеньев иммунитета;
- первичных недостаточностей фагоцитов — возникают при недостаточной активности моноцитов и гранулоцитов;
- дефицитов белков комплемента — обусловлены мутациями генов, кодирующих компоненты комплемента (каскадной системы защитных белков).

Диагностика перечисленных заболеваний выполняется в клинических условиях. Отдельные признаки врождённых патологий иммунной системы проявляются в первые дни жизни ребёнка.
Симптомы первичных иммунодефицитов
Клиническая картина первичных иммунодефицитов разнообразна, но у каждой из рассмотренных выше групп патологий существуют общие признаки. Их выявление позволяет врачам поставить пациентам точный диагноз.
При дефицитах клеточного иммунитета дети часто страдают от вирусных и грибковых инфекций. Они тяжелее своих сверстников переносят ветряную оспу, паротит, герпетические поражения. Часто у носителей патологии выявляется кандидоз полости рта, грибковые поражения лёгких.
Дефекты гуморальной защиты организма становятся причиной повышенной чувствительности пациентов к бактериальным инфекциям: пневмониям, пиодермиям, стрептодермиям. Бактерии поражают слизистые оболочки, бронхи, кишечник.
Комбинированные иммунодефициты и ослабления функций фагоцитов провоцируют развитие вирусных, бактериальных и грибковых заболеваний. Часто течение одной патологии осложняется присоединением вторичной инфекции. Пациенты страдают от образования абсцессов в различных органах, флегмон и очагов септического поражения.
Часто течение одной патологии осложняется присоединением вторичной инфекции. Пациенты страдают от образования абсцессов в различных органах, флегмон и очагов септического поражения.
Диагностика заболевания
Первичные иммунодефициты могут проявляться в первые дни и недели жизни ребёнка. Родителям следует обратиться к иммунологу или педиатру при частых вирусных и простудных заболеваниях.
Врач проводит осмотр пациента. Признаком иммунодефицитного состояния может стать дерматомикоз, эрозии или атрофии слизистых оболочек. Иногда первичный иммунодефицит приводит к отёкам подкожной жировой клетчатки.
Лабораторные анализы крови подтвердят снижение уровня лейкоцитов и фагоцитов. На фоне гуморального иммунодефицита в плазме присутствуют необычные метаболиты — результаты развития ферментопатий.
Специфические иммунологические тесты применяются для выявления конкретной формы патологии, от которой страдает пациент. Сотрудники клинических лабораторий изучают концентрацию активированных лейкоцитов в крови, фагоцитарную активность гранулоцитов, определяют общий уровень иммуноглобулинов и их отдельных фракций.
Молекулярно-генетический анализ позволяет выявить наследственные формы первичных иммунодефицитов. Во время исследования врачи определяют гены, подвергшиеся мутации и спровоцировавшие развитие иммунодефицитного состояния.
Лечение первичных иммунодефицитов
Отдельные формы заболевания купируются при трансплантации костного мозга или эмбриональной ткани тимуса. Угнетение функций клеточного иммунитета ослабляется при использовании стимулирующих препаратов. Ферментопатии лечатся с помощью средств на основе энзимов или специфичных метаболитов. При первичном гуморальном иммунодефиците пациенты получают заместительную терапию — инъекции иммуноглобулинов.
Значительная роль в лечении патологии отводится профилактике инфекционных заболеваний. Детям, страдающим от иммунодефицитов, назначаются максимальные дозы медикаментов при выявлении первых признаков бактериальных, вирусных или грибковых поражений.
Вопросы и ответы
- Какие врачи занимаются лечением первичных иммунодефицитов?
- Постановка диагноза и разработка тактики лечения осуществляется иммунологом или педиатром.
 Пациентам могут потребоваться консультации других врачей: инфекционистов, гастроэнтерологов, кардиологов, пульмонологов и т. д.
Пациентам могут потребоваться консультации других врачей: инфекционистов, гастроэнтерологов, кардиологов, пульмонологов и т. д. - В каком возрасте у детей проявляются признаки первичного иммунодефицита?
- Отдельные симптомы патологии можно заметить в первые дни жизни новорождённого. Манифестация заболевания проходит в течение полугода после рождения ребёнка.
- Чем опасны первичные иммунодефициты?
- Заболевания этой группы часто осложняются различными аномалиями. При отсутствии лечения замедляется развитие ребёнка, формируются угрожающие жизни новорождённого состояния.
Источники
При подготовке статьи использованы следующие материалы:
- Ивановская Т. Е., Цинзерлинг А. В. Патологическая анатомия (болезни детского возраста). — М., 1976.
- Пальцев М. А., Аничков Н. М. Патологическая анатомия: В 2 т.— Т. 1.— М., 2001.
- Стефани Д.
 В., Вельтищев Ю. Е. Иммунология и иммунопатология детского возраста. — М., 1996.
В., Вельтищев Ю. Е. Иммунология и иммунопатология детского возраста. — М., 1996.
Первичный иммунодефицит у детей. Клинические рекомендации.
Оглавление
Ключевые слова
-
Первичный иммунодефицит
-
Синдрм Оменн
-
Гены RAG1\RAG2
-
Тяжелая комбинированная иммунная недостаточность
-
Олигоклональная пролиферация лимфоцитов
-
Пневмоцистная пневмония
-
Материнский химеризм
-
Пренатальная диагностика
-
Трансплантация гематопоэтических стволовых клеток
-
Внутривенный иммуноглобулин
Список сокращений
АЛТ — аланинаминотрансфераза
AР — аутосомно-рецессивный тип наследования
АСТ — аспартатаминотрансфераза
АТГ — антитимоцитарный глобулин
АХЗ — анемии хронических заболеваний
БЦЖ — бацилла Кальметта–Герена
ВВИГ — внутривенные иммуноглобулины
ГКС — глюкокортикостероиды
ДНК — дезоксирибонуклеиновая кислота
ЖКТ — желудочно-кишечный тракт
КТ — компьютерная томография
ЛПУ — лечебно-профилактическое учреждение
МЗ — Министерство здравоохранения
МКБ-10 — Международная классификация болезней 10-го пересмотра
МРТ —магнитно-резонансная томография
ПЦР — полимеразная цепная реакция
СО – синдром Оменн
РКИ — рандомизированные контролируемые исследования
РНК — рибонуклеиновая кислота
РТПХ — реакция «трансплантат против хозяина»
РФ — Российская Федерация
ТГСК — трансплантация гемопоэтических стволовых клеток
ТКИН — тяжелая комбинированная иммунная недостаточность
УЗИ — ультразвуковое исследование
ФНКЦ ДГОИ — Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии
ЦНС — центральная нервная система
ЭКГ — электрокардиография
CD — cluster of differentiation – кластер дифференцировки
CРБ — C-реактивный белок
EBV- Epstein-Barre visrus- вирус Эпштейн-Барр
GPPs — good practice points
HLA – human leukocyte antigens – антигены гистосовместимости человек
IL — интерлейкин
RAG1\2 — Recombination Activating Gene 1 –ген, активирующий рекомбинацию 1
Термины и определения
Внутривенные иммуноглобулины – препараты, содержащие преимущественно нормальный человеческий IgG. Изготовляются из пулированной плазмы тысяч здоровых доноров, с применением специальных методов очистки и вирусинактивации.
Изготовляются из пулированной плазмы тысяч здоровых доноров, с применением специальных методов очистки и вирусинактивации.
Полимеразная цепная реакция — метод молекулярной биологии, позволяющий амплифицировать (размножить) определённый участок ДНК
Реакция трансплантант против хозяина – заболевание, возникающее при приживлении алллогенных лимфоцитов и их иммуноопосредованной «атаке» на органы хозяина (кожа, печень, кишечник, др). Состояние наиболее характерно для аллогенной ТГСК, однако также встречается у больных с ТКИН при приживлении материнских или трансфузированных с эритроцитарной массой лимфоцитов.
Секвенирование ДНК — определение ее нуклеотидной последовательности. В результате секвенирования получают описание первичной структуры линейной ДНК в виде последовательности нуклеотидов в текстовом виде.
Трансплантация гематопоэтических стволовых клеток – метод лечения некоторых наследственных и приобретенных гематологических, онкологических и иммунных заболеваний, основанный на замене собственного, патологического кроветворения больного на нормальное кроветворение донора.
Аутосомно-рецессивный тип наследования – наследование мутации генов, когда для проявления болезни мутация гена, локализованного в аутосоме, должна быть унаследована от обоих родителей. Мутация проявляется только в гомозиготном состоянии, то есть тогда, когда обе копии гена, расположенные на гомологичных аутосомах, являются повреждёнными. Если мутация находится в гетерозиготном состоянии, и мутантному аллелю сопутствует нормальный функциональный аллель, то аутосомно-рецессивная мутация не проявляется (носительство).
TREC – кольцевые фрагменты ДНК, образующиеся при развитии Т лимфоцитов в тимусе, в частности, в процессе формирования Т клеточного рецептора. Их концентрация в крови отражает эффективность тимопоэза. Используется для скрининга Т клеточных иммунодефицитов.
1. Краткая информация
1.1 Определение
Синдром Оменн (СО) – наиболее тяжелый вариант первичного иммунодефицита — тяжелой комбинированной иммунной недостаточности (ТКИН) — характеризующийся олигоклональной пролиферацией аутореактивных Т лимфоцитов, что ведет, помимо характерных для всех ТКИН крайне тяжелых инфекций вирусной, бактериальной и оппортунистической природы, к иммунному поражению органов (кожи, печени, кишечника др) и, в отсутствие патогенетической терапии, смерти в первые два года жизни [1-3].
1.2 Этиология и патогенез
СО чаще всего вызван мутациями в генах RAG1 и RAG2, есть сообщения о редких случаях синдрома Оменн, вызванного мутацией в генах IL7R?, DCLRE1C-Artemis и др. Все эти гены ответственны за созревание и функцию в первую очередь Т лимфоцитов, а также В лимфоцитов [3,4]. Так, гены активации рекомбинации RAG1\2 необходимы для формирования антиген-распознающих Т и В клеточного рецепторов, без которых созревание этих клеток невозможно.
Как известно, Т лимфоциты являются основными эффекторными и регуляторными клетками специфического иммунитета. В их отсутствие (как при традиционных ТКИН) страдают функции противомикробного, противовирусного иммунитета, нарушается формирование аутотолерантности. В случае синдрома Оменн отмечается олигоклональная пролиферация небольшого числа прошедших этот блок лимфоцитов, которые как правило имеют аутореативную направленность, инфильтрируют и поражают органы, в первую очередь кожу, кишечник, печень и др.
Заболевание наследуется аутосомно-рецессивно.
1.3 Эпидемиология
Частота рождения пациентов с СО составляет 1:1 000 000 новорожденных, лица мужского и женского пола поражаются одинаково [5,6]
1.4 Кодирование по МКБ-10
Комбинированные иммунодефициты (D81):
D81.1 – Тяжелый комбинированный иммунодефицит с низким содержанием T- и B-клеток.
1.5 Классификация
Классификации СО не существует. По данным классификации ПИДС 2015 г, утвержденной Международным союзом иммунологических обществ (IUIS), СО относится к Т-В- ТКИН [7,8].
2. Диагностика
2.1 Жалобы и анамнез
Родители больного как правило предъявляют жалобы на появившееся с первых месяцев, иногда даже с рождения, эритематозно-сквамозное поражение кожи, а также жидкий стул, плохую прибавку в весе, трудно поддающиеся лечению пеленочный дерматит и молочница во рту. Иногда родители сообщают об одной или нескольких перенесенной тяжелых инфекциях (пневмония, сепсис), но нередко первая же респираторная инфекция протекает настолько тяжело, что наводит на мысль об иммунологической недостаточности [1-6].
При сборе семейного анамнеза надо выяснить степень родства родителей (близкородственный брак, семьи из одного региона), так как близкородственный брак увеличивает вероятность развития аутосомно-рецессивно наследуемого СО. Семейный анамнез ТКИН как правило отсутствует.
При опросе родителей следует уточнить особенности физического развития ребенка, прибавку в весе, особенности поражения кожи, сроки возникновения, частоту и тяжесть проявления инфекционных заболеваний (диареи, грибковых поражений кожи и слизистых, пневмонии и инфекций других локализаций). Также необходимо узнавать, проводилась ли вакцинация БЦЖ в роддоме, отмечались ли изменения в месте вакцинации БЦЖ и регионарных лимфоузлах через 3-4 мес после вакцинации [9].
2.2 Физикальное обследование
Пациенты с СО могут отставать в массе с первых месяцев жизни. У них нередко отмечаются «немотивированные» субфебрилитеты и лихорадка без явного на момент обращения очага инфекции. Однако нередко бывает и обратная ситуация — отсутствие температурной реакции на тяжелую, генерализованную инфекцию.
Однако нередко бывает и обратная ситуация — отсутствие температурной реакции на тяжелую, генерализованную инфекцию.
При осмотре в первую очередь обращает на себя внимание эритематозное поражение кожи, как правило сопровождающееся пластинчатым шелушением, инфицированием и мокнутием, что является патогномоничным признаком СО. Эритродермия может сочетаться с полиморфной сыпью, как проявлением реакции трансплантат против хозяина за счет материнского химеризма [10]. Кроме того, может иметь место кандидозного поражения кожи и слизистых, наличия мацерации перианальной области (вследствие хронической диареи). Необходимо осмотреть левое плечо в месте вакцинации БЦЖ для исключения локального БЦЖита и остальные кожные покровы на предмет инфильтративных полиморфных элементов (генерализованный БЦЖит) [9].
Для СО характерно увеличение лимфоузлов всех групп. Помимо этого, в случае БЦЖита может отмечаться особое увеличение подмышечных лимфоузлов слева.
Пневмонии при СО нередко имеют этиологию P. carinii. Как известно, такие пневмонии сопровождаются прогрессирующей дыхательной недостаточностью с тахипноэ, снижением сатурации кислородом, обилием крепитирующих хрипов.
carinii. Как известно, такие пневмонии сопровождаются прогрессирующей дыхательной недостаточностью с тахипноэ, снижением сатурации кислородом, обилием крепитирующих хрипов.
Для СО характерно увеличение печени, реже – спленомегалия [5].
2.3 Лабораторная диагностика
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Для больных с СО, в отличие от других ТКИН, характерны лейкоцитоз, эозинофилия, может может отмечаться анемия хронического воспаления.
- Рекомендуется определение биохимических показателей крови (мочевины, креатинина, фракций билирубина, аспартатаминотрансферазы, аланинаминотрансферазы, лактатдегидрогеназы, щелочной фосфатазы), а также парциального давления кислорода (рО2)[11-13].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Для больных СО характерно поражение печени с синдромом цитолиза.
- Рекомендуется исследование уровня иммуноглобулинов сыворотки [11-13].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Коментарии: В большинстве случаев у больных с СО выявляется снижение иммуноглобулинов G, A, M и значительное повышение иммуноглобулина Е. В первые месяцы жизни нормальные уровни IgG обусловлены персистенцией материнского иммуноглобулина, полученного трансплацентарно. У некоторых больных с СО отмечается нормальная концентрация иммуноглобулинов, однако их специфичность значительно страдает, что можно определить по низкому титру поствакцинальных антител в случае вакцинации ребенка.
- Рекомендуется фенотипирование субпопоуляций лимфоцитов [11-13].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: При СО встречается сниженное или нормальное число CD3+ Т лимфоцитов. При более детальном фенотипировании можно увидеть однако что большинство этих Т лимфоцитов имеет фенотип клеток памяти. Как правило полностью отсутствуют В лимфоциты, в норме или увеличены НК лимфоциты. Как и для других вариантов ТКИН характерно значительное снижение пролиферативной активности лимфоцитов.
При более детальном фенотипировании можно увидеть однако что большинство этих Т лимфоцитов имеет фенотип клеток памяти. Как правило полностью отсутствуют В лимфоциты, в норме или увеличены НК лимфоциты. Как и для других вариантов ТКИН характерно значительное снижение пролиферативной активности лимфоцитов.
- Рекомендуется исследование TREC (Т cell excision circles) [11-13].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: TREC являются критерием эффективности продукции Т лимфоцитов в тимусе. Концентрация TREC значительно снижена при всех видах ТКИН, в том числе и при СО.
- Рекомендуется молекулярно-генетическое исследование соответствующих генов [11-13].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Клинико-лабораторная картина как правило бывает достаточна для подтверждения диагноза СО. В связи с необходимостью немедленной трансплантации стволовых клеток при СО, генетическое подтверждение диагноза не требуется для ее проведения, однако необходимо для семейного консультирования. Выявление мутаций причинных генов проводится с помощью полимеразной цепной реакции и последующего секвенирования полученных продуктов или с применением методов секвенирования нового поколения (NGS), с последующим подтверждение дефекта методом ПЦР. Обычно начинают с исследования генов RAG1\RAG2, при нормальной их последовательности — других генов (IL7R?, DCLRE1C-Artemis)
В связи с необходимостью немедленной трансплантации стволовых клеток при СО, генетическое подтверждение диагноза не требуется для ее проведения, однако необходимо для семейного консультирования. Выявление мутаций причинных генов проводится с помощью полимеразной цепной реакции и последующего секвенирования полученных продуктов или с применением методов секвенирования нового поколения (NGS), с последующим подтверждение дефекта методом ПЦР. Обычно начинают с исследования генов RAG1\RAG2, при нормальной их последовательности — других генов (IL7R?, DCLRE1C-Artemis)
- Рекомендуются микробиологические и вирусологические исследования [11-13].
Уровень убедительности рекомендаций В (уровень достоверности доказательств 2)
Комментарии: Серологические исследования у больных с СО не информативны и не должны применяться. Вирусологический статус больного характеризуется количественным (предпочтительно) или качественным определением вирусов методом полимеразной цепной реакции (ПЦР) в крови, кале, ликворе, бронхо-альвеолярном лаваже, биопсийном материале. Необходимо помнить, что отсутствие виремии не является свидетельством негативного вирусологического статуса, необходимо исследование соответствующих сред при поражении тех или иных органов (вплоть до проведения из биопсии). Посевы биоматериала (на флору и грибы) с определением антибиотикочувствительности со слизистых, из очагов инфекции (включая посев крови и мочи при соответствующей симптоматике), а также посевы кала, бронхоальвеолярного лаважа, ликвора и биопсионного материала необходимо проводить всегда при наличии инфекционных очагов.
Необходимо помнить, что отсутствие виремии не является свидетельством негативного вирусологического статуса, необходимо исследование соответствующих сред при поражении тех или иных органов (вплоть до проведения из биопсии). Посевы биоматериала (на флору и грибы) с определением антибиотикочувствительности со слизистых, из очагов инфекции (включая посев крови и мочи при соответствующей симптоматике), а также посевы кала, бронхоальвеолярного лаважа, ликвора и биопсионного материала необходимо проводить всегда при наличии инфекционных очагов.
- Рекомендуется HLA-типирование [11-13].
Уровень убедительности рекомендаций А (уровень достоверности доказательств 1)
Комментарии: Так как скорейшее проведение трансплантация гематопоэтических стволовых клеток (ТГСК) при СО является единственным условием сохранения жизни этим больным, HLA-типирование с сиблингами, родителями (при отсутсвии сиблингов), или типирование для поиска неродственного донора должно проводиться сразу после постановки диагноза СО.
2.4 Инструментальная диагностика
Необходима компьютерная томография легких для оценки поражения этого органа. Интерстициальные поражения легких, характерные для СО, не могут быть в полной мере оценены с помощью рентгенографии легких, поэтому КТ легких должно проводиться даже при нормальной рентгенограмме.
Всем больным показано проведение ультразвукового исследование брюшной полости и забрюшинного пространства для оценки вовлеченности внутренних органов.
Компьютерная томография органов брюшной полости с контрастным усилением необходима для оценки поражения печени, степени внутрибрюшной лимфаденопатии. Для СО характерны гепатоспленомегалия, лимфаденопатия.
Другие инструментальные исследования проводятся при наличии соответствующих клинических показаний.
2.5 Иная диагностика
В связи с частым вирусным поражением глаз у больных с СО необходим осмотр офтальмолога, в том числе и в щелевой лампе. При поражении легких проводится бронхо-альвеолярный лаваж, при поражении ЦНС – люмбальная пункция, с последующим микробиологически и вирусологическим исследованием сред.
При поражении легких проводится бронхо-альвеолярный лаваж, при поражении ЦНС – люмбальная пункция, с последующим микробиологически и вирусологическим исследованием сред.
При сомнении в диагнозе возможно проведение биопсии кожи.
Дифференциальный диагноз следует в первую очередь проводить с:
? с генодерматозами;
? РТПХ при других видах ТКИН.
3. Лечение
3.1 Консервативное лечение
Цель лечения: стабилизация состояния и предотвращение новых инфекционных эпизодов на период подготовки к ТГСК.
- Сразу после постановки диагноза ТКИН рекомендуется нахождение ребенка в гнотобиологических условиях (стерильный бокс) [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: СО, как и другие виды ТКИН, является неотложным состоянием в педиатрии.
- Не рекомендовано сохранение грудного вскармливания в связи с риском инфицирования, в первую очередь ЦМВ, а также в связи с усилением диарейного синдрома при использовании лактозо-содержащих продуктов.
 Рекомендовано искусственное вскармливание, основанное на гидролизатных смесях, безмолочных кашах и других продуктах по возрасту, прошедших тщательную термическую обработку [14].
Рекомендовано искусственное вскармливание, основанное на гидролизатных смесях, безмолочных кашах и других продуктах по возрасту, прошедших тщательную термическую обработку [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- В отсутствии инфекционных очагов рекомендуется постоянная профилактическая противомикробная терапия препаратом широкого спектра, противогрибковая — флуконазолом (при получении высевов – по чувтствиетльности), профилактика пневмоцистной инфекции ко-тримоксазолом (профилактическая доза 5 мг/кг, терапевтическая 20 мг/кг по ко-тримоксазолу внутривенно), профилактика ЦМВ-инфекции ганцикловиром [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Так как в России вакцинация БЦЖ проводится в первые дни жизни, то дети с ТКИН в большинстве случаев оказываются инфицированными, и у них развиваются БЦЖ-иты различной тяжести (от локальной до генерализованной инфекции). БЦЖ-инфекция требует назначения длительной интенсивной терапии не менее, чем 3 противомикобактериальными препаратами. В случае присоединения инфекций проводится интенсивная противомикробная, противовирусная и противогрибковая терапия по чувствительности.
БЦЖ-инфекция требует назначения длительной интенсивной терапии не менее, чем 3 противомикобактериальными препаратами. В случае присоединения инфекций проводится интенсивная противомикробная, противовирусная и противогрибковая терапия по чувствительности.
- При наличии симптомов РТПХ и\или иммунного поражения органов рекомендуется иммуносупресивная терапия глюкокортикостероидными, другими иммуносупрессивными препаратами – индивидуально [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- При необходимости проведения переливаний компонентов крови (эритроцитарная масса, тромбоконцентрат) рекомендутся использовать только облученные и отфильтрованные препараты. В случае переливания необлученных эритроцитов и тромбоцитов развивается посттрансфузионная РТПХ [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
- В связи с массивным иммунным поражением органов, рекомендована иммуносупрессивная терапия в виде глюкокортикостероидов (ГКС) 1-1.
 5 г/кг массы тела до момента ТГСК. При неполном эффекте и/или развитии значимых побочных эффектов от терапии ГКС рекомендована терапия иммуноглобулином антитимоцитарным в дозе 10 мг/кг 3 дня [14].
5 г/кг массы тела до момента ТГСК. При неполном эффекте и/или развитии значимых побочных эффектов от терапии ГКС рекомендована терапия иммуноглобулином антитимоцитарным в дозе 10 мг/кг 3 дня [14].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
- Рекомендуется профилактическое лечение с помощью внутривенного переливания иммуноглобулинов (ВВИГ) с момента постановки диагноза до восстановления иммунной функции после ТГСК, так как у всех больных СО, независимо от уровня иммуноглобулинов сыворотки, наблюдается нарушение продукции антител [14].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: У больных СО лечение проводится еженедельно в дозе 400–600 мг/кг. Для лечения тяжелых инфекций применяется ВВИГ в дозе 1 г/кг, при лечении септических состояний – ВВИГ, обогащенный IgM ( Иммуноглобулин человека нормальный [IgG + IgM + IgA] ) в дозе 3 мл/кг в сутки 2-5 введений.
3.2 Трансплантация гематопоэтических стволовых клеток
Цель лечения: спасение жизни пациента.
- Всем больным СО рекомендована ТГСК [14-16]
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Если СО диагностирована в течение первого месяца жизни, до наступления инфекционных осложнений, адекватная терапия и проведение аллогенной HLA идентичной или гаплоидентичной ТГСК обеспечивает выживание более 90% пациентов независимо от формы иммунодефицита. В случае более поздней диагностики развиваются тяжелые инфекции, плохо поддающиеся терапии, и выживаемость пациентов резко падает – до 40-50%. В любом случае, проведение ТГСК является единствнным куративным методом лечения у больных с СО, без проведения ТГСК смертность составляет 100% в первые 12-18 мес жизни [14-16].
Проводится от родственного совместимого, неродственного совместимого или гаплоидентичного донора по методикам, используемым в конкретном центре. В зависимости от инфекционного статуса и развившихся осложнений определяется наличие и интенсивность кондиционирования. При отсутствии совместимого родственного донора результаты гаплотрансплантации сравнимы с результатами неродственной трансплантации от полностью совместимого донора, однако проведение гаплотрансплантации возможно в кратчайшие сроки, поэтому при нестабильном состоянии больного трансплантация от родителей является предпочтительной [16].
В зависимости от инфекционного статуса и развившихся осложнений определяется наличие и интенсивность кондиционирования. При отсутствии совместимого родственного донора результаты гаплотрансплантации сравнимы с результатами неродственной трансплантации от полностью совместимого донора, однако проведение гаплотрансплантации возможно в кратчайшие сроки, поэтому при нестабильном состоянии больного трансплантация от родителей является предпочтительной [16].
3.3 Хирургическое лечение
Проводится по показаниям, в зависимости от осложнений.
4. Реабилитация
С момента постановки диагноза и до начала восстановления иммунной функции после ТГСК больной должен находиться в стационаре, специализирующемся на ведении больных с СО.
5. Профилактика и диспансерное наблюдение
Профилактические меры включают медико-генетическое консультирование семей и пренатальную диагностику, которая проводится с помощью молекулярно-генетического исследования биоптата хориона с выявлением мутации соответствующего гена, что позволяет предотвратить рождение других больных с данным заболеванием в семьях СО.
Пренатальная диагностика показана только в близкородственном браке. В других случаях риск заболевания у детей больного составляет менее 0,1%. Все дети больного являются носителями мутатного гена, им необходимо семейное консультирование.
6. Дополнительная информация, влияющая на течение и исход заболевания
При успешной ТГСК прогноз качества и продолжительности жизни в целом благоприятный, он во многом определяется тяжестью сформировавшихся к моменту трансплантации хронических очагов инфекции и поражения органов. Средняя продолжительность жизни больных СО без проведения ТГСК в настоящий момент составляет 7 месяцев [13-14].
Критерии оценки качества медицинской помощи
|
Критерий качества
|
Значение
|
|
Выполнена оценка необходимости в ургентных медицинских мероприятиях (искусственная вентиляция легких)
|
Да\нет
|
|
Выполнены клинический анализ крови , биохимический анализ крови, клинический анализ мочи, коагулограмма, определение инфицированности ВИЧ, вирусами гепатита В и С, ЭКГ, УЗИ брюшной полости, рентгенография грудной клетки
|
Да\нет
|
|
Выполнена определение иммуноглобулинов сыворотки крови и специфических поствакцинальных антител и фенотипирование лимфоцитов крови
|
Да\нет
|
|
Выполнено вирусологическое исследование для исключения вирусного поражения органов с помощью метода ПЦР (с учетом иммунодефицита и неинформативности серологических методов обследования)?
|
Да\нет
|
|
Выполнено молекулярно-генетическое исследование потенциально пораженных генов с целью выявления мутаций данного гена?
|
Да\нет
|
|
Проведена заместительная терапия препаратами внутривенных иммуноглобулинов, не зависимо от уровня иммуноглобулина G
|
Да\нет
|
|
Пациент и его семья проинформированы о необходимости проведения трансплантации стволовых клеток для излечения заболевания
|
Да\нет
|
|
Проведено семейное генетическое консультирование
|
Да\нет
|
Список литературы
- Иммунология детского возраста.
 Практическое руководство по детским болезням.Под ред. А.Ю. Щербины и Е.Д. Пашанова. М.: Медпрактика-М; 2006.
Практическое руководство по детским болезням.Под ред. А.Ю. Щербины и Е.Д. Пашанова. М.: Медпрактика-М; 2006. - Щербина А.Ю. Маски первичных иммунодефицитных состояний: проблемы диагностики и терапии. Российский журнал детской гематологии и онкологии (РЖДГиО). 2016;3(1):52-58.
- Aleman K, Noordzij JG, de Groot R, van Dongen JJ, Hartwig NG. Reviewing Omenn syndrome. Eur J Pediatr 2001; 160 :718-724
- Gennery AR, Hodges E, Williams AP, et al. Omenn”s syndrome occuring in patients without mutations in recombination activating genes. Clin Immunol 2005; 116 :246-256
- Kwan A, Abraham RS, Currier R, Brower A et al. Newborn screening for severe combined immunodeficiency in 11 screening programs in the United States. JAMA. 2014 20;312(7):729-38.
- Ryser O, Morell A, Hitzig WH. Primary immunodeficiencies in Switzerland: first report of the national registry in adults and children. J Clin Immunol. 1988;8(6):479-485.
- Van der Burg M, Gennery AR. Educational paper. The expanding clinical and immunological spectrum of severe combined immunodeficiency. Eur J Pediatr. 2011;170(5):561-71
- Bousfiha A, Jeddane L, Al-Herz W, Ailal F et al.The 2015 IUIS Phenotypic Classification for Primary Immunodeficiencies J Clin Immunol 2015, 35(8): 727–738
- Marciano BE, Huang CY, Joshi G, Rezaei N, Carvalho BC, Allwood Z, Ikinciogullari A, Reda SM, Gennery A, Thon V, Espinosa-Rosales F, Al-Herz W, Porras O, Shcherbina A et al BCG vaccination in patients with severe combined immunodeficiency: complications, risks, and vaccination policies. J Allergy Clin Immunol. 2014;133(4):1134-41.
- M?ller SM, Ege M, Pottharst A, Schulz AS, Schwarz K, Friedrich W. Transplacentally acquired maternal T lymphocytes in severe combined immunodeficiency: a study of 121 patients.2001;98(6):1847-51.
- Gruber TA, Shah AJ, Hernandez M, Crooks GM, Abdel-Azim H, Gupta S, McKnight S, White D, Kapoor N, Kohn DB.
 Clinical and genetic heterogeneity in Omenn syndrome and severe combined immune deficiency. Pediatr Transplant. 2009;13(2):244-50.
Clinical and genetic heterogeneity in Omenn syndrome and severe combined immune deficiency. Pediatr Transplant. 2009;13(2):244-50. - Dvorak CC, Cowan MJ, Logan BR, Notarangelo LD, Griffith LM, Puck JM, Kohn DB, Shearer WT, O»Reilly RJ, Fleisher TA, Pai SY, Hanson IC, Pulsipher MA, Fuleihan R, Filipovich A, Goldman F, Kapoor N, Small T, Smith A, Chan KW, Cuvelier G, Heimall J, Knutsen A, Loechelt B, Moore T, Buckley RH. The natural history of children with severe combined immunodeficiency: baseline features of the first fifty patients of the primary immune deficiency treatment consortium prospective study 6901. J Clin Immunol. 2013;33(7):1156-64
- Lehman H, Hernandez-Trujillo V, Ballow M. Diagnosing primary immunodeficiency: a practical approach for the non-immunologist. Curr Med Res Opin. 2015 Apr;31(4):697-706
- Rivers L, Gaspar HB. Severe combined immunodeficiency: recent developments and guidance on clinical management. Arch Dis Child.
 2015;100(7):667-72
2015;100(7):667-72 - Antoine C, M?ller S, Cant A, et al. Long-term survival and transplantation of haemopoietic stem cells for immunodeficiencies: report of the European experience 1968-99. Lancet 2003; 361:553.
- Buckley RH. Transplantation of hematopoietic stem cells in human severe combined immunodeficiency: longterm outcomes. Immunol Res 2011; 49:25-28.
- Кузьменко Н.Б., Варламова Т.В., Мерсиянова И.В., Райкина Е.В., Бобрнина В.О., Щербина А.Ю. Молекулярно-генетическая диагностика первичных иммунодефицитных состояний. Вопросы гематологии\онкологии и иммунопатологии в педиатрии. 2016; 15(1):10-16
Приложение А1. Состав рабочей группы
Балашов Дмитрий Николаевич — доктор медицинских наук, член Национального общества экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член Европейского общества иммунодефицитов
Румянцев Александр Григорьевич — доктор медицинских наук, профессор, академик РАМН, президент Национального общества экспертов в области первичных иммунодефицитов, член Нациоанального общества детских гематологов и онкологов, член Европейского общества гематологов
Щербина Анна Юрьевна — доктор медицинских наук, исполнительный директор Национального общества экспертов в области первичных иммунодефицитов, член Национального общества детских гематологов и онкологов, член Европейского общества иммунодефицитов
Конфликт интересов: Шербина А. Ю. в течение последних 5 лет осуществляла лекторскую деятельность при поддержке компаний CSL Behring, Kedrion, Biotest, РФарм, являющиеся изготовителями/дистрибьюторами препаратов внутривенных иммуноглобулинов.
Ю. в течение последних 5 лет осуществляла лекторскую деятельность при поддержке компаний CSL Behring, Kedrion, Biotest, РФарм, являющиеся изготовителями/дистрибьюторами препаратов внутривенных иммуноглобулинов.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
-
Гематологи 14.01.21;
-
Иммунологи 14.03.09;
-
Педиатры 14.01.08;
-
Врачи общей практики 31.08.54.
Таблица П1 – Уровни достоверности доказательств
|
Уровень достоверности
|
Источник доказательств
|
|
I (1)
|
Проспективные рандомизированные контролируемые исследования
Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных
Крупные мета-анализы
Как минимум одно хорошо организованное рандомизированное контролируемое исследование
Репрезентативная выборка пациентов
|
|
II (2)
|
Проспективные с рандомизацией или без исследования с ограниченным количеством данных
Несколько исследований с небольшим количеством пациентов
Хорошо организованное проспективное исследование когорты
Мета-анализы ограничены, но проведены на хорошем уровне
Результаты не презентативны в отношении целевой популяции
Хорошо организованные исследования «случай-контроль»
|
|
III (3)
|
Нерандомизированные контролируемые исследования
Исследования с недостаточным контролем
Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками
Ретроспективные или наблюдательные исследования
Серия клинических наблюдений
Противоречивые данные, не позволяющие сформировать окончательную рекомендацию
|
|
IV (4)
|
Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные
|
Таблица П2 – Уровни убедительности рекомендаций
|
Уровень убедительности
|
Описание
|
Расшифровка
|
|
A
|
Рекомендация основана на высоком уровне доказательности (как минимум 1 убедительная публикация I уровня доказательности, показывающая значительное превосходство пользы над риском)
|
Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией
|
|
B
|
Рекомендация основана на среднем уровне доказательности (как минимум 1 убедительная публикация II уровня доказательности, показывающая значительное превосходство пользы над риском)
|
Метод/терапия второй линии; либо при отказе, противопоказании, или неэффективности стандартной методики/терапии.
|
|
C
|
Рекомендация основана на слабом уровне доказательности (но как минимум 1 убедительная публикация III уровня доказательности, показывающая значительное превосходство пользы над риском) или
нет убедительных данных ни о пользе, ни о риске)
|
Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии
Рекомендовано при отказе, противопоказании, или неэффективности стандартной методики/терапии, при условии отсутствия побочных эффектов
|
|
D
|
Отсутствие убедительных публикаций I, II или III уровня доказательности, показывающих значительное превосходство пользы над риском, либо убедительные публикации I, II или III уровня доказательности, показывающие значительное превосходство риска над пользой
|
Не рекомендовано
|
Порядок обновления клинических рекомендаций – пересмотр 1 раз в 3 года.
Приложение В. Информация для пациентов
Синдром Оменн — генетически обусловленное заболевание, в основе которого лежит тяжелейший дефект иммунитета. Заболевание характеризуется иммунным поражением кожи, печени, других органов, тяжелыми инфекциями вирусной и бактериальной природы и, в отсутствие трансплантации стволовых клеток, смертью в первые два года жизни.
СО вызван поломками (мутациями) в генах RAG1/2, ответственных за созревание и функцию в первую очередь Т лимфоцитов, а также В лимфоцитов. Для больных с СО характерно раннее (в первые недели или месяцы жизни) начало клинических проявлений заболевания в виде гиперемии и шелушения кожи, жидкого стула, упорной молочницы, пеленочного дерматита и тяжелых инфекций. В случае вакцинации ребенка БЦЖ в роддоме или позже характерно развитие регионарной и/или и генерализованной БЦЖ-инфекции.
На фоне тяжелых инфекций наблюдается отставание в физическом и моторном развитии. Следует помнить, что даже при наличии СО у младенцев не сразу развиваются все вышеперечисленные симптомы, и в течение нескольких месяцев они могут расти и развиваться нормально.
ТГСК является единственным способом сохранить пациенту жизнь. ТГСК проводится от совместимого брата/сестры, в их отсутствие – от неродственного совместимого донора или от родителей. Исходы ТГСК зависят во многом от имеющегося инфекционного статуса, поражения органов и систем.
Риски рождения других детей с СО в данной семье составляют примерно 25%. Рекомендовано проведение семейного консультирования и пренатальной/преимплантационнной диагностики, для исключения рождения других детей с данным заболеванием.
Первичные иммунодефициты: не заразны, но очень опасны
Ежегодно в России рождается более 250 детей с врожденными дефектами иммунной системы: в какой-то момент жизни они получают диагноз «первичный иммунодефицит» и становятся подопечными фондов.
Безусловно, речь идет о редких заболеваниях — даже с учетом того, что в России, по мнению многих экспертов, многие случаи первичных иммунодефицитов (ПИД) пока что не выявляются и не попадают в поле зрения специалистов. Однако проблема является социально значимой. Главное, что нужно знать: если раньше дети с наиболее тяжелыми дефектами иммунитета были обречены, то сейчас подавляющему большинству можно эффективно помочь. А для этого нужно вовремя поставить диагноз и начать правильное лечение.
Однако проблема является социально значимой. Главное, что нужно знать: если раньше дети с наиболее тяжелыми дефектами иммунитета были обречены, то сейчас подавляющему большинству можно эффективно помочь. А для этого нужно вовремя поставить диагноз и начать правильное лечение.
Что такое первичный иммунодефицит?
Вокруг первичных иммунодефицитов есть немало мифов. Ведь это редкие болезни, которые, как говорится, не на слуху, да и настоящее их изучение началось только в последние десятилетия.
Во-первых, при слове «иммунодефицит» многие сразу вспоминают о СПИДе. Нет, первичные иммунодефициты не имеют к нему никакого отношения. СПИД возникает на фоне инфекции, вызванной вирусом иммунодефицита человека. А причина первичных иммунодефицитов — врожденные «поломки» в генах, отвечающих за работу иммунной системы. Эти поломки могут наследоваться от родителей (которые чаще всего не подозревают, что являются носителями аномального гена), могут случайно возникать в момент зачатия, но никак не могут быть заразными для других людей.
У Гели редчайший вариант первичного иммунодефицита: она даже летала в Америку на обследование, ее случай признан уникальным. Совсем недавно девочка выписалась из клиники в стабильном состоянии
Также бывает путаница с терминами «первичный» и «вторичный» иммунодефицит. С первичным иммунодефицитом человек рождается. Вторичный же связан с последствиями каких-то событий в течение жизни. Скажем, после трансплантации костного мозга иммунная защита резко ослабевает и восстанавливается только спустя некоторое время.
Во-вторых, люди часто подозревают врожденные дефекты иммунитета там, где их нет. «Мой ребенок не может и двух недель походить в детский садик, сразу насморк и кашель — наверное, у него плохой иммунитет». Но обычно постоянные детские простуды все-таки не имеют отношения к первичным иммунодефицитам. А вот если у ребенка очень частые гнойные отиты, или многократные пневмонии, или регулярные тяжелые инфекции пазух носа, или другие настораживающие признаки — тут стоит посетить специалиста.
первичных иммунодефицитов известно сегодня
В-третьих, надо понимать, что первичные иммунодефициты неодинаковы — это огромная группа болезней. За работу иммунной системы человека отвечают тысячи генов, дефекты которых могут привести к нарушению работы какого-то звена иммунитета. Сейчас выявлено около 400 вариантов ПИД, относящихся к 9 классам, и постоянно появляются сообщения о новых генетических дефектах у больных. Разные ПИД наследуются по-разному — скажем, одни встречаются у девочек и мальчиков с одинаковой частотой, а другие почти исключительно у мальчиков. Первые проявления могут возникнуть и в первые месяцы или годы жизни, и в школьном и даже взрослом возрасте — все зависит от конкретного заболевания. Да и проявления могут быть совсем разными. Чаще всего это действительно низкая сопротивляемость инфекциям. Но могут быть и другие аномалии иммунной системы — например, аутовоспалительные синдромы, при которых в организме возникают воспаления вне связи с инфекцией. Или иногда подозрение на первичный иммунодефицит возникает тогда, когда у ребенка возникает злокачественное заболевание, нехарактерное для его возраста, — скажем, лимфома Ходжкина у дошкольника. А бывают и вовсе удивительные заболевания: скажем, наследственный ангионевротический отек, когда внезапно как будто без повода возникает (и потом проходит) сильная отечность лица, шеи, туловища, конечностей… Словом, очень разнообразные болезни — и лечатся они тоже по-разному.
Или иногда подозрение на первичный иммунодефицит возникает тогда, когда у ребенка возникает злокачественное заболевание, нехарактерное для его возраста, — скажем, лимфома Ходжкина у дошкольника. А бывают и вовсе удивительные заболевания: скажем, наследственный ангионевротический отек, когда внезапно как будто без повода возникает (и потом проходит) сильная отечность лица, шеи, туловища, конечностей… Словом, очень разнообразные болезни — и лечатся они тоже по-разному.
Назар болел с рождения. В двухлетнем возрасте ему провели трансплантацию по поводу синдрома Вискотта-Олдрича, произошло отторжение, но после повторной трансплантации дела наладились
Варианты первичных иммунодефицитов
Перечислим некоторые из тех ПИД, с которыми сравнительно часто сталкиваются врачи в наших подопечных клиниках.
Тяжелая комбинированная иммунная недостаточность (ТКИН). У таких детей нарушены функции обоих главных типов иммунных клеток: и В-, и Т-лимфоцитов. Такие дети подвержены тяжелейшим инфекциям с первых же месяцев жизни, причем для них смертельно опасны даже те микроорганизмы и вирусы, которые безопасны для обычных детей.
 Опасны также любые «живые» вакцины. Без интенсивного лечения большинство этих детей не сможет прожить больше 1-2 лет. К счастью, сейчас для лечения разных вариантов ТКИН успешно применяется трансплантация костного мозга — особенно велики шансы на успех, особенно если провести пересадку достаточно рано, до развития тяжелых инфекционных процессов. Интересно, что в 1968 году именно ребенку с ТКИН была проведена первая в мире аллогенная трансплантация от донора, который не являлся идентичным близнецом. Малыш, который казался обреченным, выздоровел и вырос, и эта история вдохновила многих врачей-трансплантологов.
Опасны также любые «живые» вакцины. Без интенсивного лечения большинство этих детей не сможет прожить больше 1-2 лет. К счастью, сейчас для лечения разных вариантов ТКИН успешно применяется трансплантация костного мозга — особенно велики шансы на успех, особенно если провести пересадку достаточно рано, до развития тяжелых инфекционных процессов. Интересно, что в 1968 году именно ребенку с ТКИН была проведена первая в мире аллогенная трансплантация от донора, который не являлся идентичным близнецом. Малыш, который казался обреченным, выздоровел и вырос, и эта история вдохновила многих врачей-трансплантологов.Синдром Вискотта-Олдрича — один из тех ПИД, которые встречаются почти исключительно у мальчиков. А мальчики наследуют дефектный ген от здоровой мамы-носительницы (это называется Х-сцепленным наследованием). Это очень тяжелое заболевание, при котором не только повышен риск инфекций и опухолей (в первую очередь лимфом), но и нарушена свертываемость крови из-за недостатка тромбоцитов, а также возникает кожная экзема.
 Диагноз «синдром Вискотта-Олдрича» — показание к трансплантации костного мозга, которая в случае успеха приводит к выздоровлению.
Диагноз «синдром Вискотта-Олдрича» — показание к трансплантации костного мозга, которая в случае успеха приводит к выздоровлению.
У Насти была тяжелая врожденная нейтропения. Некоторое время девочка получала лекарства, потом все-таки провели трансплантацию костного мозга. Сейчас все хорошо!
Хроническая гранулематозная болезнь тоже обычно встречается у мальчиков, хотя иногда поражает и девочек. При этой болезни определенные клетки иммунной системы неспособны эффективно бороться с некоторыми бактериями и грибами. К тому же в местах инфекции и очагах воспаления образуются скопления иммунных клеток — гранулёмы (отсюда и название). Часто эта болезнь проявляется уже в младенчестве (в частности, в форме тяжелой реакции на прививку БЦЖ), но диагноз может ставиться в разном возрасте, не обязательно в первые годы жизни. Части больных показана трансплантация костного мозга — в случае успеха она приводит к излечению. Но многие пациенты могут прожить достаточно долгую и полноценную жизнь, просто принимая лекарства и соблюдая некоторые ограничения.

Синдром Ниймеген поражает в равной степени и мальчиков, и девочек. Он очень редок, но среди славянских народов — так уж получилось по историческим причинам — его частота повышена. У этого синдрома есть много разных проявлений, от характерных особенностей внешности до сниженной сопротивляемости инфекциям и, к сожалению, крайне высокого риска развития лимфом, лейкозов и аутоиммунных заболеваний. Кроме того, эти больные очень чувствительны к облучению, и это влияет на их терапию. Сейчас при синдроме Ниймеген нередко используется трансплантация костного мозга: она решает далеко не все проблемы, но все же приводит к значимому повышению выживаемости.
Тяжелая врожденная нейтропения — болезнь, при которой в крови очень мало нейтрофилов, основного типа лейкоцитов. Так как нейтрофилы играют огромную роль в борьбе с бактериями, их отсутствие может привести к молниеносному развитию смертельно опасных инфекций. Больные с этим диагнозом получают лекарства, стимулирующие выработку нейтрофилов, но при неэффективности терапии бывает опять-таки нужна трансплантация костного мозга.

потрачено фондом в 2021 году на поиск и активацию доноров для детей с ПИД
Есть множество других диагнозов: общая вариабельная иммунная недостаточность, различные лимфопролиферативные синдромы, аутовоспалительные синдромы, агаммаглобулинемии и многое, многое другое. Какие-то из этих болезней требуют трансплантации, какие-то — просто периодического приема лекарств, но наблюдение специалистов необходимо всегда.
Какова роль фонда?
Лечение пациентов с первичными иммунодефицитами может быть связано со значительными финансовыми расходами, в оплате которых помогает фонд «Подари жизнь».
Как видно из сказанного выше, при многих первичных иммунодефицитах шанс на выздоровление дает трансплантация костного мозга. А значит, возникают расходы, связанные именно с трансплантацией: оплата поиска и активации неродственного донора, очистки трансплантата, лекарств для подготовки к пересадке и для борьбы с посттрансплантационными осложнениями.

Лекарства часто нужны детям с первичными иммунодефицитами и вне связи с трансплантацией. Нужны антибиотики и противогрибковые препараты для лечения инфекционных осложнений, очень нужны иммуноглобулины. При аутовоспалительных синдромах могут потребоваться препараты для борьбы с нежелательными иммунными реакциями, в том числе дорогостоящие, такие как канакинумаб («Иларис»), тофацитиниб («Яквинус») и другие.
Наконец, диагностика многих первичных иммунодефицитов требует сложных дорогостоящих анализов, в том числе генетических. Благодаря помощи фонда необходимые исследования могут проводиться всем нуждающимся. А ведь это очень важно и для назначения терапии, и для генетического консультирования семей.
Сейчас в большинстве случаев диагноз «первичный иммунодефицит» уже совсем не приговор. Мы убеждены, что с развитием медицины эти тяжелые болезни будут становиться все более излечимыми — так, сейчас большие надежды связаны с развитием генной терапии первичных иммунодефицитов (это совсем новый метод, пока еще не реализованный в России). И, конечно, мы сердечно благодарим всех наших благотворителей: ведь без их помощи оптимальное лечение детей с врожденными дефектами иммунитета было бы невозможным!
И, конечно, мы сердечно благодарим всех наших благотворителей: ведь без их помощи оптимальное лечение детей с врожденными дефектами иммунитета было бы невозможным!
В заключение мы хотели бы поблагодарить наших коллег из благотворительного фонда «Подсолнух» за поддержку людей с первичными иммунодефицитами и за публикацию важных и полезных информационных материалов, которые использовались и при написании этой статьи.
Иммунодефицит у детей — причины, симптомы, диагностика и лечение
Иммунодефицит у детей подразделяется на первичный (врожденный) и вторичный, вызванный экзогенными влияниями, тяжелыми инфекциями, ятрогенными факторами. Симптомы патологии включают частые и затяжные инфекционные заболевания различной локализации, задержку физического и психического развития, аллергические и аутоиммунные расстройства. Для диагностики назначают общеклинические анализы, расширенную иммунограмму, серологические и генетические тесты. Лечение иммунодефицитов состоит из заместительной и антибактериальной терапии, хирургических методов (трансплантация костного мозга и тимуса).
Лечение иммунодефицитов состоит из заместительной и антибактериальной терапии, хирургических методов (трансплантация костного мозга и тимуса).
Общие сведения
Частота встречаемости иммунодефицитов в детском возрасте колеблется от 1:10000 до 1:100000. Вариативность данных обусловлена большим разнообразием клинических форм патологии и полиморфностью симптоматики. Легкие вторичные иммунодефициты обычно не диагностируются и не попадают в общую статистику. Лечение заболевания, особенно связанного с генетическим дефектом, представляет большие трудности. При тяжелых нарушениях иммунной системы нередки инвалидизации и летальные исходы.
Иммунодефицит у детей
Причины
Этиологическая структура первичных иммунодефицитов включает врожденные дефекты иммунной системы — как наследственные заболевания, так и пороки развития (эмбриопатии, фетопатии), возникшие под действием тератогенных факторов. Большинство случаев обусловлено генетическими аномалиями, передающимися аутосомно или сцепленными с половыми хромосомами. Причины вторичных форм более обширны и включают следующие категории:
Причины вторичных форм более обширны и включают следующие категории:
- Недостаточность питания. Дефицит белка приводит к недостатку строительного материала для иммунных молекул, вследствие чего снижается активность гуморального звена защиты. При нехватке эссенциальных микроэлементов и витаминов нарушается функционирование Т-клеточной системы.
- Потеря иммуноглобулинов. В норме защитные молекулы постоянно циркулируют в крови, а при патологических процессах они усиленно выводятся из организма. Подобная ситуация наблюдается при нефротическом синдроме на фоне гломерулонефрита, массивных кровотечениях или лимфорее, обширных ожогах.
- Экзогенные вредные воздействия. Иммунитет ухудшается под влиянием физических факторов: ионизирующего излучения, высокой или низкой температуры, радиоактивных волн, что часто связано с местом проживания ребенка. Причиной иммунного расстройства также может послужить загрязнение окружающей среды пестицидами и промышленными выбросами.

- Инфекции. Иммунодефициты встречаются при заражении типичными детскими инфекциями (корью, краснухой, эпидемическим паротитом), могут быть результатом опасных хронических заболеваний — гепатита В, СПИДа, подострого склерозирующего энцефалита. Реже болезнь обусловлена бактериальной или протозойной инвазией.
- Злокачественные новообразования. Нарушения защитных сил организма возникают при любых лимфопролиферативных процессах, поскольку они затрагивают процесс образования и функционирования иммунокомпетентных клеток. Недостаточность гуморального звена преимущественно вызвана миеломной болезнью.
- Ятрогенные факторы. После спленэктомии страдает гуморальный иммунный ответ, поскольку селезенка является основным органом антителопродукции. Нарушения Т-клеточного звена зачастую отмечаются, когда проводится длительное лечение иммуносупрессорами, кортикостероидами, химиотерапевтическими препаратами.
Патогенез
Заболевание проявляется нарушениями в одном или нескольких звеньях иммунного ответа, в результате чего у ребенка повышается чувствительность к инфекциям. Если есть дефект иммуноглобулинов или комплемента, у детей в основном возникают рецидивирующие гнойные патологии, вызванные инкапсулированными бактериями. Дефицит клеточного звена иммунитета повышает частоту оппортунистических инфекций.
Если есть дефект иммуноглобулинов или комплемента, у детей в основном возникают рецидивирующие гнойные патологии, вызванные инкапсулированными бактериями. Дефицит клеточного звена иммунитета повышает частоту оппортунистических инфекций.
Классификация
В детской иммунологии все иммунодефициты разделяют на 2 категории согласно причине появления: первичные (ПИД), связанные с врожденными факторами, и вторичные (ВИД), вызванные внешним воздействием или соматическим заболеванием. Вторые, в свою очередь, делятся на индуцированные, приобретенные и спонтанные. Среди ПИД выделяют 5 основных разновидностей:
- В-клеточные иммунодефициты. Самая распространенная форма, составляющая до 50% от общего числа патологий. Она обусловлена недостаточной продукцией защитных антител, которые в норме синтезируются при активации В-лимфоцитов. В эту категорию входят болезнь Брутона, гипер-IgM синдром, делеция генов тяжелых цепей иммуноглобулинов.
- Т—клеточные иммунодефициты.
 Вызваны снижением количества или нарушением функциональной активности Т-лимфоцитов. К ним принадлежат синдром Ди Джорджи, первичный дефицит CD4-клеток, дефицит ИЛ-2.
Вызваны снижением количества или нарушением функциональной активности Т-лимфоцитов. К ним принадлежат синдром Ди Джорджи, первичный дефицит CD4-клеток, дефицит ИЛ-2. - Комбинированные иммунодефициты. Тяжело протекающие процессы, которые сочетают в себе признаки двух предыдущих форм. Встречаются в 30% случаев. К комбинированным патологиям относят синдром Вискотта-Олдрича, синдром Луи-Бар (атаксия-телеангиоэктазия).
- Дефекты фагоцитоза. При этой форме иммунодефицитов нарушается переваривание инфекционных агентов, возникают проблемы с антигенпрезентацией и выработкой антител. Сюда относят разные формы наследственных нейтропений.
- Дефекты комплемента. Нехватка этого фактора делает невозможным уничтожение антигена после присоединения к нему антитела, поэтому наблюдается несостоятельность В-лимфоцитов. Такие состояния составляют не более 2% от иммунодефицитов у детей.
Симптомы иммунодефицита у детей
Основным признаком иммунодефицитов является инфекционный синдром, который встречается у 95-100% детей. Заболевание отличается затяжным и рецидивирующим течением, а стандартное лечение не дает результатов. При первичных иммунодефицитах, которые протекают более тяжело, часто сочетается несколько инфекций разной локализации, что ухудшает состояние ребенка. Типичными маркерами являются гнойные отиты (6-8 раз в год), синуситы (4 раза в год), пневмонии (1 раз в полгода).
Заболевание отличается затяжным и рецидивирующим течением, а стандартное лечение не дает результатов. При первичных иммунодефицитах, которые протекают более тяжело, часто сочетается несколько инфекций разной локализации, что ухудшает состояние ребенка. Типичными маркерами являются гнойные отиты (6-8 раз в год), синуситы (4 раза в год), пневмонии (1 раз в полгода).
У детей с первичными иммунодефицитами, как правило, возникает задержка роста и нервно-психического развития. Она наиболее характерна для дефицитов клеточного звена, которые сопровождаются хронической диареей, мальабсорбцией и мальдигестией. У 18% детей болезнь дополняется системными аллергическими реакциями, в 6% случаев — аутоиммунными поражениями тканей.
Клиническая картина иммунодефицитов отличается при нарушениях Т-клеточного или В-клеточного звеньев иммунитета. В первом случае симптомы проявляются сразу после рождения, у младенца выявляются кандидоз полости рта, гнойничковые высыпания на коже, затяжная диарея. Позже присоединяются рекуррентные вирусные и микотические инфекции, наблюдается гепатоспленомегалия и костные аномалии.
Позже присоединяются рекуррентные вирусные и микотические инфекции, наблюдается гепатоспленомегалия и костные аномалии.
Для дефицита В-клеточного иммунитета характерно начало после 6-месячного возраста, когда из крови ребенка исчезают материнские антитела. Типичным симптомом являются затяжные респираторные инфекции, вызванные бактериальной флорой или микоплазмами. Если лечение отсутствует, начинаются менингоэнцефалиты, артриты, энтеровирусные гастроэнтериты.
Вторичный иммунодефицит протекает в легкой форме, если он не спровоцирован ВИЧ-инфекцией или онкологическими процессами. При ВИД повышается частота ОРВИ и кишечных инфекций, болезни хуже поддаются терапии, а выздоровление наступает медленнее. Больных относят к группе длительно и часто болеющих детей. При отсутствии медицинской помощи и коррекции иммунитета возможно отставание в физическом развитии, снижается успеваемость в школе.
Осложнения
При тяжелых первичных иммунодефицитах и отсутствии адекватной терапии смертность достигает 30-50% в первые годы жизни ребенка. Пациенты, которым удалось выжить, зачастую становятся инвалидами из-за последствий инфекционных болезней, неизлечимых злокачественных или аутоиммунных процессов. У большинства детей с ПИД определяются интеллектуальные нарушения разной степени выраженности.
Пациенты, которым удалось выжить, зачастую становятся инвалидами из-за последствий инфекционных болезней, неизлечимых злокачественных или аутоиммунных процессов. У большинства детей с ПИД определяются интеллектуальные нарушения разной степени выраженности.
Диагностика
При первом обследовании ребенка иммунолог-аллерголог собирает подробный анамнез о всех перенесенных заболеваниях и полученных прививках, факторах риска беременности и родов, материально-бытовых и экологических условиях проживания. Для обнаружения дефектов иммунного ответа и установления их причин назначают ряд инструментальных и лабораторных методов, основными из которых являются:
- Иммунограмма. Врач оценивает количество Т- и В-лимфоцитов и их соотношение, смотрит на уровни разных типов иммуноглобулинов. Полученные показатели сопоставляются с симптоматикой и данными общеклинических тестов. Для оценки тяжести и течения иммунодефицита выполняют несколько иммунограмм в динамике.

- Анализы крови. Гемограмма показывает признаки воспалительного процесса, по наличию лейкопении судят о недостаточном иммунном ответе. В биохимическом исследовании интересует значение острофазовых белков, протеинограммы. Ставится тест на ВИЧ, ИФА или РИФ на другие специфические инфекции.
- Расширенные тесты. Для выявления клеточного иммунодефицита проводится исследование на Т-рецепторные эксцизионные кольца, серологическое HLA-типирование. Чтобы оценить нарушения фагоцитоза, применяется проточная цитометрия, оценка хемотаксической активности нейтрофилов. Недостаточность системы комплемента определяется с помощью теста CH50.
- Пренатальная диагностика. Многие ПИД удается выявить во время беременности, если у родителей отягощена наследственность. Для пренатального скрининга осуществляют биопсию ворсин хориона, цитологию амниотической жидкости или анализ фетальной крови.
Лечение иммунодефицита у детей
Консервативная терапия
Лечебная схема подбирается с учетом формы патологии, причины и степени ее тяжести. Для большинства вторичных иммунодефицитов основу терапии составляет ликвидация факторов риска и устранение хронических вялотекущих инфекций. Это позволяет нормализовать работу иммунной системы. Лечение первичных иммунодефицитов у детей сложное и комплексное, оно включает 3 основных направления:
Для большинства вторичных иммунодефицитов основу терапии составляет ликвидация факторов риска и устранение хронических вялотекущих инфекций. Это позволяет нормализовать работу иммунной системы. Лечение первичных иммунодефицитов у детей сложное и комплексное, оно включает 3 основных направления:
- Заместительная терапия. При дефиците гуморального звена рекомендуют длительное и постоянное введение гамма-глобулинов с антителами. Таким образом работа иммунной системы восстанавливается, пациенты доживают до зрелых лет и ведут активный образ жизни.
- Антибиотикотерапия. Лечение противомикробными препаратами применяется для ликвидации основного кинического проявления иммунодефицитов — бактериальных и грибковых инфекций. Чтобы минимизировать риски длительного употребления антибиотиков, показаны пробиотики, антимикотики.
- Иммуномодулирующее лечение. Использование иммуномодуляторов у детей, страдающих первичными иммунодефицитами, не так эффективно, как при вторичных нарушениях иммунитета, но в ряде случаев препараты усиливают эффективность заместительного лечения.
 Они активируют систему фагоцитоза, нормализуют функции Т-лимфоцитов.
Они активируют систему фагоцитоза, нормализуют функции Т-лимфоцитов.
Хирургическое лечение
При нарушении В-клеточной системы иммунитета перспективным методом терапии является пересадка костного мозга. Процедура ликвидирует врожденные аномалии, нормализует выработку и активность лимфоцитов, оказывает пожизненный лечебный эффект. Для коррекции патологии Т-лимфоцитов производят трансплантацию тимуса как основного источника иммунных клеток у детей.
Прогноз и профилактика
Прогноз при иммунодефицитах сомнительный, но раннее начало терапии позволяет скорректировать нарушения и улучшить качество жизни больных. Профилактика ПИД включает медико-генетическое консультирование пар с отягощенным семейным анамнезом, антенатальную охрану плода. Для предупреждения вторичных иммунодефицитов необходимо своевременное лечение инфекционных и соматических заболеваний, устранение негативного влияния неблагоприятных внешних факторов.
Вторичные иммунодефициты — ГОБУЗ «Областной клинический родильный дом»
Вторичные иммунодефициты – это болезни иммунной системы, возникающие у детей и взрослых, не связанные с генетическими дефектами и характеризующиеся развитием повторных, затяжных инфекционно-воспалительных патологических процессов, плохо поддающихся этиотропному лечению. Выделяют приобретенную, индуцированную и спонтанную форму вторичных иммунодефицитов. Симптоматика обусловлена снижением иммунитета и отражает конкретное поражение того или иного органа (системы). Диагностика основана на анализе клинической картины и данных иммунологических исследований. В лечении используется вакцинация, заместительная терапия, иммуномодуляторы.
Выделяют приобретенную, индуцированную и спонтанную форму вторичных иммунодефицитов. Симптоматика обусловлена снижением иммунитета и отражает конкретное поражение того или иного органа (системы). Диагностика основана на анализе клинической картины и данных иммунологических исследований. В лечении используется вакцинация, заместительная терапия, иммуномодуляторы.
Общие сведения
Вторичные иммунодефициты – нарушения иммунитета, которые развиваются в поздний постнатальный период и не связаны с генетическими дефектами, возникают на фоне исходно нормальной реактивности организма и обусловлены конкретным причинным фактором, вызвавшим развитие дефекта иммунной системы.
Причинные факторы, приводящие к нарушению иммунитета, многообразны. Среди них — длительное неблагоприятное воздействие внешних факторов (экологических, инфекционных), отравления, токсическое действие лекарственных препаратов, хронические психоэмоциональные перегрузки, недоедание, травмы, оперативные вмешательства и тяжелые соматические заболевания, приводящие к нарушению работы иммунной системы, снижению сопротивляемости организма, развитию аутоиммунных расстройства и новообразований.
Течение заболевания может быть скрытым (жалобы и клиническая симптоматика отсутствует, наличие иммунодефицита выявляется только при лабораторном исследовании) или активным с наличием признаков воспалительного процесса на коже и в подкожной клетчатке, верхних дыхательных путях, легких, мочеполовой системе, пищеварительном тракте и в других органах. В отличие от преходящих сдвигов в иммунитете, при вторичном иммунодефиците патологические изменения сохраняются и после ликвидации возбудителя заболевания и купирования воспаления.
Причины
Привести к выраженному и стойкому снижению иммунной защиты организма могут самые разнообразные этиологические факторы – как внешние, так и внутренние. Вторичный иммунодефицит нередко развивается при общем истощении организма. Длительное недоедание с дефицитом в рационе белка, жирных кислот, витаминов и микроэлементов, нарушения всасывания и расщепления питательных веществ в пищеварительном тракте приводят к нарушению процессов созревания лимфоцитов и снижают сопротивляемость организма.
Тяжелые травматические повреждения опорно-двигательного аппарата и внутренних органов, обширные ожоги, серьезные оперативные вмешательства, как правило, сопровождаются кровопотерей (наряду с плазмой теряются белки системы комплемента, иммуноглобулины, нейтрофилы и лимфоциты), а выброс кортикостероидных гормонов, предназначенных для поддержания жизненно-важных функций (кровообращения, дыхания и др.) еще больше угнетает работу иммунитета.
Ведущую роль в развитии вторичных иммунодефицитов играют хронические вирусные инфекционные заболевания (ВИЧ, цитомегаловирусная инфекция, вирусы Эпштейна-Барр и другие герпес-вирусы, реже корь, краснуха, вирусные гепатиты и т. д.), вызывая подавление клеточного и гуморального иммунитета. Неблагоприятное влияние на иммунный статус оказывает бактериальная и грибковая инфекция, паразитарные заболевания.
Выраженное нарушение обменных процессов в организме при соматических заболеваниях (хронические гломерулонефриты, почечная недостаточность) и эндокринных расстройствах (диабете, гипо- и гипертиреозе) приводит к угнетению хемотаксиса и фагоцитирующей активности нейтрофилов и, как следствие, к вторичному иммунодефициту с возникновением воспалительных очагов различной локализации (чаще это пиодермии, абсцессы и флегмоны).
Снижается иммунитет при длительном приеме некоторых лекарственных препаратов, обладающих подавляющим действием на костный мозг и кроветворение, нарушающих формирование и функциональную активность лимфоцитов (цитостатики, глюкокортикоиды и пр.). Схожий эффект оказывает и лучевое воздействие.
При злокачественных новообразованиях происходит продукция опухолью иммуномодулирующих факторов и цитокинов, в результате чего снижается количество T-лимфоцитов, увеличивается активность клеток-супрессоров, угнетается фагоцитоз. Ситуация усугубляется при генерализации опухолевого процесса и метастазировании в костный мозг. Вторичные иммунодефициты нередко развиваются при аутоиммунных заболеваниях, острых и хронических отравлениях, у людей старческого возраста, при длительных физических и психоэмоциональных перегрузках.
Симптомы вторичных иммунодефицитов
Клинические проявления характеризуются наличием в организме затяжного, устойчивого к этиотропной терапии хронического инфекционного гнойно-воспалительного заболевания на фоне снижения иммунной защиты. При этом изменения могут быть преходящими, временными или имеют необратимый характер. Выделяют индуцированную, спонтанную и приобретенную формы вторичных иммунодефицитов.
При этом изменения могут быть преходящими, временными или имеют необратимый характер. Выделяют индуцированную, спонтанную и приобретенную формы вторичных иммунодефицитов.
К индуцированной форме относят нарушения, возникающие вследствие конкретных причинных факторов (рентгеновское излучение, длительный прием цитостатиков, кортикостероидных гормонов, тяжелые травмы и обширные хирургические операции с интоксикацией, кровопотерей), а также при тяжелой соматической патологии (сахарный диабет, гепатиты, циррозы, хроническая почечная недостаточность) и злокачественных опухолях.
При спонтанной форме видимый этиологический фактор, вызвавший нарушение иммунной защиты, не определяется. Клинически при этой форме отмечается наличие хронических, трудно поддающихся лечению и часто обостряющихся заболеваний верхних дыхательных путей и легких (синуситы, бронхоэктазы, пневмонии, абсцессы легких), пищеварительного тракта и мочевыводящих путей, кожи и подкожной клетчатки (фурункулы, карбункулы, абсцессы и флегмоны), которые вызваны условно-патогенными микроорганизмами. В отдельную – приобретенную форму выделен синдром приобретенного иммунодефицита (СПИД), вызванный ВИЧ-инфекцией.
В отдельную – приобретенную форму выделен синдром приобретенного иммунодефицита (СПИД), вызванный ВИЧ-инфекцией.
О наличии вторичного иммунодефицита при всех стадиях можно судить по общим клиническим проявлениям инфекционно-воспалительного процесса. Это может быть длительный субфебрилитет или лихорадка, увеличение лимфатических узлов и их воспаление, боли в мышцах и суставах, общая слабость и утомляемость, снижение работоспособности, частые простудные заболевания, повторные ангины, часто рецидивирующие хронические гаймориты, бронхиты, повторные пневмонии, септические состояния и т. п. При этом эффективность стандартной антибактериальной и противовоспалительной терапии невысока.
Диагностика
Выявление вторичных иммунодефицитов требует комплексного подхода и участия в процессе диагностики различных врачей-специалистов – аллерголога-иммунолога, гематолога, онколога, инфекциониста, оториноларинголога, уролога, гинеколога и др. При этом учитывается клиническая картина заболевания, свидетельствующая о наличии хронической инфекции, трудно поддающейся лечению, а также выявление оппортунистических инфекций, вызванных условно-патогенными микроорганизмами.
Необходимо изучение иммунного статуса организма с использованием всех доступных методик, применяемых в аллергологии и иммунологии. Диагностика основана на исследовании всех звеньев иммунитета, участвующих в защите организма от инфекционных агентов. При этом изучается фагоцитарная система, система комплемента, субпопуляции T- и B-лимфоцитов. Исследования выполняются путем проведения тестов первого (ориентировочного) уровня, позволяющего выявить грубые общие нарушения иммунитета и второго (дополнительного) уровня с идентификацией конкретного дефекта.
При проведении скрининговых исследований (тесты 1 уровня, которые можно выполнить в любой клинико-диагностической лаборатории) можно получить информацию об абсолютном количестве лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов (встречается как лейкопения, так и лейкоцитоз, относительный лимфоцитоз, повышенная СОЭ), уровне белка и сывороточных иммуноглобулинов G, A, M и E, гемолитической активности комплемента. Кроме того, можно выполнить необходимые кожные пробы для выявления гиперчувствительности замедленного типа.
При углубленном анализе вторичного иммунодефицита (тесты 2 уровня) определяется интенсивность хемотаксиса фагоцитов, завершенность фагоцитоза, субклассы иммуноглобулинов и специфические антитела к конкретным антигенам, продукция цитокинов, индукторов T-клеток и другие показатели. Анализ полученных данных должен проводиться только с учетом конкретного состояния данного пациента, сопутствующих заболеваний, возраста, наличия аллергических реакций, аутоиммунных расстройств и других факторов.
В процессе обследования проводится дифференциальная диагностика с первичными иммунодефицитами, затяжными инфекционными заболеваниями вирусной, бактериальной, грибковой и паразитарной природы, соматическими заболеваниями, эндокринными расстройствами, новообразованиями.
Лечение вторичных иммунодефицитов
Эффективность лечения вторичных иммунодефицитов зависит от правильности и своевременности выявления этиологического фактора, вызвавшего появление дефекта иммунной системы и возможности его устранения.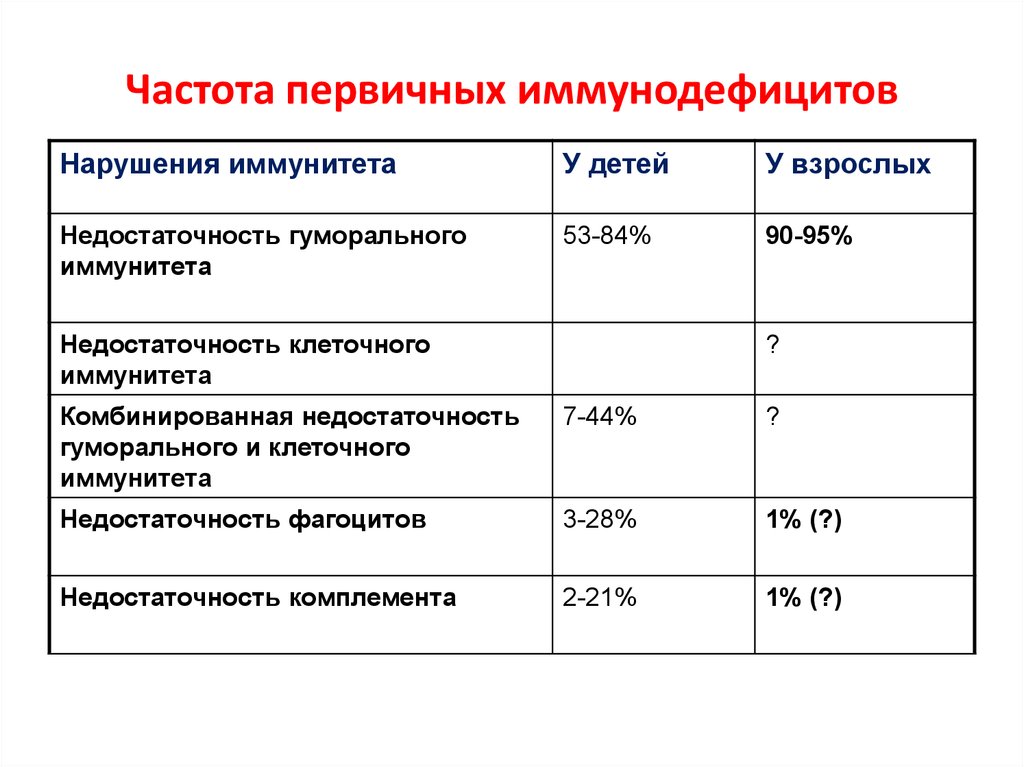 Если нарушение иммунитета возникло на фоне хронической инфекции, применяются меры по ликвидации очагов воспаления с использованием антибактериальных препаратов с учетом чувствительности к ним возбудителя, проведением адекватной противовирусной терапии, использованием интерферонов и т. п. Если причинный фактор – недостаточное питание и авитаминоз, проводятся мероприятия по разработке правильного рациона питания со сбалансированным сочетанием белков, жиров, углеводов, микроэлементов и необходимой калорийности. Также устраняются имеющиеся нарушения обмена веществ, восстанавливается нормальный гормональный статус, проводится консервативное и оперативное лечение основного заболевания (эндокринная, соматическая патология, новообразования).
Если нарушение иммунитета возникло на фоне хронической инфекции, применяются меры по ликвидации очагов воспаления с использованием антибактериальных препаратов с учетом чувствительности к ним возбудителя, проведением адекватной противовирусной терапии, использованием интерферонов и т. п. Если причинный фактор – недостаточное питание и авитаминоз, проводятся мероприятия по разработке правильного рациона питания со сбалансированным сочетанием белков, жиров, углеводов, микроэлементов и необходимой калорийности. Также устраняются имеющиеся нарушения обмена веществ, восстанавливается нормальный гормональный статус, проводится консервативное и оперативное лечение основного заболевания (эндокринная, соматическая патология, новообразования).
Важный компонент лечения больных вторичным иммунодефицитом – иммунотропная терапия с использованием активной иммунизации (вакцинации), заместительного лечения препаратами крови (внутривенное введение плазмы, лейкоцитарной массы, человеческого иммуноглобулина), а также использованием препаратов иммунотропного действия (иммуностимуляторов). Целесообразность назначения того или иного лечебного средства и подбор дозировки осуществляется врачом аллергологом-иммунологом с учетом конкретной ситуации. При преходящем характере иммунных нарушений, своевременном выявлении вторичного иммунодефицита и подборе правильного лечения, прогноз заболевания может быть благоприятным.
Целесообразность назначения того или иного лечебного средства и подбор дозировки осуществляется врачом аллергологом-иммунологом с учетом конкретной ситуации. При преходящем характере иммунных нарушений, своевременном выявлении вторичного иммунодефицита и подборе правильного лечения, прогноз заболевания может быть благоприятным.
Иммунодефицит у детей подразделяется на первичный (врожденный) и вторичный, вызванный экзогенными влияниями, тяжелыми инфекциями, ятрогенными факторами. Симптомы патологии включают частые и затяжные инфекционные заболевания различной локализации, задержку физического и психического развития, аллергические и аутоиммунные расстройства. Для диагностики назначают общеклинические анализы, расширенную иммунограмму, серологические и генетические тесты. Лечение иммунодефицитов состоит из заместительной и антибактериальной терапии, хирургических методов (трансплантация костного мозга и тимуса).
МКБ-10
Общие сведения
Частота встречаемости иммунодефицитов в детском возрасте колеблется от 1:10000 до 1:100000. Вариативность данных обусловлена большим разнообразием клинических форм патологии и полиморфностью симптоматики. Легкие вторичные иммунодефициты обычно не диагностируются и не попадают в общую статистику. Лечение заболевания, особенно связанного с генетическим дефектом, представляет большие трудности. При тяжелых нарушениях иммунной системы нередки инвалидизации и летальные исходы.
Вариативность данных обусловлена большим разнообразием клинических форм патологии и полиморфностью симптоматики. Легкие вторичные иммунодефициты обычно не диагностируются и не попадают в общую статистику. Лечение заболевания, особенно связанного с генетическим дефектом, представляет большие трудности. При тяжелых нарушениях иммунной системы нередки инвалидизации и летальные исходы.
Причины
Этиологическая структура первичных иммунодефицитов включает врожденные дефекты иммунной системы — как наследственные заболевания, так и пороки развития (эмбриопатии, фетопатии), возникшие под действием тератогенных факторов. Большинство случаев обусловлено генетическими аномалиями, передающимися аутосомно или сцепленными с половыми хромосомами. Причины вторичных форм более обширны и включают следующие категории:
- Недостаточность питания.Дефицит белка приводит к недостатку строительного материала для иммунных молекул, вследствие чего снижается активность гуморального звена защиты.
 При нехватке эссенциальных микроэлементов и витаминов нарушается функционирование Т-клеточной системы.
При нехватке эссенциальных микроэлементов и витаминов нарушается функционирование Т-клеточной системы. - Потеря иммуноглобулинов. В норме защитные молекулы постоянно циркулируют в крови, а при патологических процессах они усиленно выводятся из организма. Подобная ситуация наблюдается при нефротическом синдроме на фоне гломерулонефрита, массивных кровотечениях или лимфорее, обширных ожогах.
- Экзогенные вредные воздействия. Иммунитет ухудшается под влиянием физических факторов: ионизирующего излучения, высокой или низкой температуры, радиоактивных волн, что часто связано с местом проживания ребенка. Причиной иммунного расстройства также может послужить загрязнение окружающей среды пестицидами и промышленными выбросами.
- Инфекции. Иммунодефициты встречаются при заражении типичными детскими инфекциями (корью, краснухой, эпидемическим паротитом), могут быть результатом опасных хронических заболеваний — гепатита В, СПИДа, подострого склерозирующего энцефалита.
 Реже болезнь обусловлена бактериальной или протозойной инвазией.
Реже болезнь обусловлена бактериальной или протозойной инвазией. - Злокачественные новообразования. Нарушения защитных сил организма возникают при любых лимфопролиферативных процессах, поскольку они затрагивают процесс образования и функционирования иммунокомпетентных клеток. Недостаточность гуморального звена преимущественно вызвана миеломной болезнью.
- Ятрогенные факторы. После спленэктомии страдает гуморальный иммунный ответ, поскольку селезенка является основным органом антителопродукции. Нарушения Т-клеточного звена зачастую отмечаются, когда проводится длительное лечение иммуносупрессорами, кортикостероидами, химиотерапевтическими препаратами.
Патогенез
Заболевание проявляется нарушениями в одном или нескольких звеньях иммунного ответа, в результате чего у ребенка повышается чувствительность к инфекциям. Если есть дефект иммуноглобулинов или комплемента, у детей в основном возникают рецидивирующие гнойные патологии, вызванные инкапсулированными бактериями. Дефицит клеточного звена иммунитета повышает частоту оппортунистических инфекций.
Дефицит клеточного звена иммунитета повышает частоту оппортунистических инфекций.
Классификация
В детской иммунологии все иммунодефициты разделяют на 2 категории согласно причине появления: первичные (ПИД), связанные с врожденными факторами, и вторичные (ВИД), вызванные внешним воздействием или соматическим заболеванием. Вторые, в свою очередь, делятся на индуцированные, приобретенные и спонтанные. Среди ПИД выделяют 5 основных разновидностей:
- В-клеточные иммунодефициты. Самая распространенная форма, составляющая до 50% от общего числа патологий. Она обусловлена недостаточной продукцией защитных антител, которые в норме синтезируются при активации В-лимфоцитов. В эту категорию входят болезнь Брутона, гипер-IgM синдром, делеция генов тяжелых цепей иммуноглобулинов.
- Т—клеточные иммунодефициты. Вызваны снижением количества или нарушением функциональной активности Т-лимфоцитов. К ним принадлежат синдром Ди Джорджи, первичный дефицит CD4-клеток, дефицит ИЛ-2.

- Комбинированные иммунодефициты. Тяжело протекающие процессы, которые сочетают в себе признаки двух предыдущих форм. Встречаются в 30% случаев. К комбинированным патологиям относят синдром Вискотта-Олдрича, синдром Луи-Бар (атаксия-телеангиоэктазия).
- Дефекты фагоцитоза. При этой форме иммунодефицитов нарушается переваривание инфекционных агентов, возникают проблемы с антигенпрезентацией и выработкой антител. Сюда относят разные формы наследственных нейтропений.
- Дефекты комплемента. Нехватка этого фактора делает невозможным уничтожение антигена после присоединения к нему антитела, поэтому наблюдается несостоятельность В-лимфоцитов. Такие состояния составляют не более 2% от иммунодефицитов у детей.
Симптомы иммунодефицита у детей
Основным признаком иммунодефицитов является инфекционный синдром, который встречается у 95-100% детей. Заболевание отличается затяжным и рецидивирующим течением, а стандартное лечение не дает результатов. При первичных иммунодефицитах, которые протекают более тяжело, часто сочетается несколько инфекций разной локализации, что ухудшает состояние ребенка. Типичными маркерами являются гнойные отиты (6-8 раз в год), синуситы (4 раза в год), пневмонии (1 раз в полгода).
При первичных иммунодефицитах, которые протекают более тяжело, часто сочетается несколько инфекций разной локализации, что ухудшает состояние ребенка. Типичными маркерами являются гнойные отиты (6-8 раз в год), синуситы (4 раза в год), пневмонии (1 раз в полгода).
У детей с первичными иммунодефицитами, как правило, возникает задержка роста и нервно-психического развития. Она наиболее характерна для дефицитов клеточного звена, которые сопровождаются хронической диареей, мальабсорбцией и мальдигестией. У 18% детей болезнь дополняется системными аллергическими реакциями, в 6% случаев — аутоиммунными поражениями тканей.
Клиническая картина иммунодефицитов отличается при нарушениях Т-клеточного или В-клеточного звеньев иммунитета. В первом случае симптомы проявляются сразу после рождения, у младенца выявляются кандидоз полости рта, гнойничковые высыпания на коже, затяжная диарея. Позже присоединяются рекуррентные вирусные и микотические инфекции, наблюдается гепатоспленомегалия и костные аномалии.
Для дефицита В-клеточного иммунитета характерно начало после 6-месячного возраста, когда из крови ребенка исчезают материнские антитела. Типичным симптомом являются затяжные респираторные инфекции, вызванные бактериальной флорой или микоплазмами. Если лечение отсутствует, начинаются менингоэнцефалиты, артриты, энтеровирусные гастроэнтериты.
Вторичный иммунодефицит протекает в легкой форме, если он не спровоцирован ВИЧ-инфекцией или онкологическими процессами. При ВИД повышается частота ОРВИ и кишечных инфекций, болезни хуже поддаются терапии, а выздоровление наступает медленнее. Больных относят к группе длительно и часто болеющих детей. При отсутствии медицинской помощи и коррекции иммунитета возможно отставание в физическом развитии, снижается успеваемость в школе.
Осложнения
При тяжелых первичных иммунодефицитах и отсутствии адекватной терапии смертность достигает 30-50% в первые годы жизни ребенка. Пациенты, которым удалось выжить, зачастую становятся инвалидами из-за последствий инфекционных болезней, неизлечимых злокачественных или аутоиммунных процессов. У большинства детей с ПИД определяются интеллектуальные нарушения разной степени выраженности.
У большинства детей с ПИД определяются интеллектуальные нарушения разной степени выраженности.
Диагностика
При первом обследовании ребенка иммунолог-аллерголог собирает подробный анамнез о всех перенесенных заболеваниях и полученных прививках, факторах риска беременности и родов, материально-бытовых и экологических условиях проживания. Для обнаружения дефектов иммунного ответа и установления их причин назначают ряд инструментальных и лабораторных методов, основными из которых являются:
- Иммунограмма. Врач оценивает количество Т- и В-лимфоцитов и их соотношение, смотрит на уровни разных типов иммуноглобулинов. Полученные показатели сопоставляются с симптоматикой и данными общеклинических тестов. Для оценки тяжести и течения иммунодефицита выполняют несколько иммунограмм в динамике.
- Анализы крови. Гемограмма показывает признаки воспалительного процесса, по наличию лейкопении судят о недостаточном иммунном ответе. В биохимическом исследовании интересует значение острофазовых белков, протеинограммы.
 Ставится тест на ВИЧ, ИФА или РИФ на другие специфические инфекции.
Ставится тест на ВИЧ, ИФА или РИФ на другие специфические инфекции. - Расширенные тесты. Для выявления клеточного иммунодефицита проводится исследование на Т-рецепторные эксцизионные кольца, серологическое HLA-типирование. Чтобы оценить нарушения фагоцитоза, применяется проточная цитометрия, оценка хемотаксической активности нейтрофилов. Недостаточность системы комплемента определяется с помощью теста CH50.
- Пренатальная диагностика. Многие ПИД удается выявить во время беременности, если у родителей отягощена наследственность. Для пренатального скрининга осуществляют биопсию ворсин хориона, цитологию амниотической жидкости или анализ фетальной крови.
Лечение иммунодефицита у детей
Консервативная терапия
Лечебная схема подбирается с учетом формы патологии, причины и степени ее тяжести. Для большинства вторичных иммунодефицитов основу терапии составляет ликвидация факторов риска и устранение хронических вялотекущих инфекций. Это позволяет нормализовать работу иммунной системы.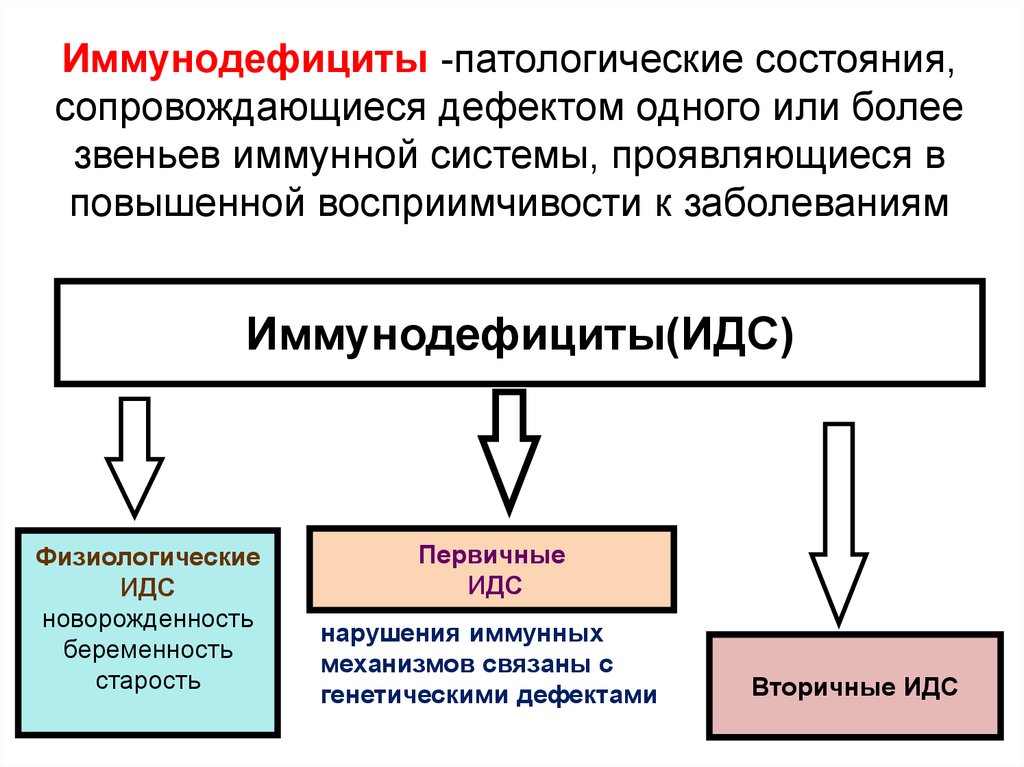 Лечение первичных иммунодефицитов у детей сложное и комплексное, оно включает 3 основных направления:
Лечение первичных иммунодефицитов у детей сложное и комплексное, оно включает 3 основных направления:
- Заместительная терапия. При дефиците гуморального звена рекомендуют длительное и постоянное введение гамма-глобулинов с антителами. Таким образом работа иммунной системы восстанавливается, пациенты доживают до зрелых лет и ведут активный образ жизни.
- Антибиотикотерапия. Лечение противомикробными препаратами применяется для ликвидации основного кинического проявления иммунодефицитов — бактериальных и грибковых инфекций. Чтобы минимизировать риски длительного употребления антибиотиков, показаны пробиотики, антимикотики.
- Иммуномодулирующее лечение. Использование иммуномодуляторов у детей, страдающих первичными иммунодефицитами, не так эффективно, как при вторичных нарушениях иммунитета, но в ряде случаев препараты усиливают эффективность заместительного лечения. Они активируют систему фагоцитоза, нормализуют функции Т-лимфоцитов.
Хирургическое лечение
При нарушении В-клеточной системы иммунитета перспективным методом терапии является пересадка костного мозга. Процедура ликвидирует врожденные аномалии, нормализует выработку и активность лимфоцитов, оказывает пожизненный лечебный эффект. Для коррекции патологии Т-лимфоцитов производят трансплантацию тимуса как основного источника иммунных клеток у детей.
Процедура ликвидирует врожденные аномалии, нормализует выработку и активность лимфоцитов, оказывает пожизненный лечебный эффект. Для коррекции патологии Т-лимфоцитов производят трансплантацию тимуса как основного источника иммунных клеток у детей.
Прогноз и профилактика
Прогноз при иммунодефицитах сомнительный, но раннее начало терапии позволяет скорректировать нарушения и улучшить качество жизни больных. Профилактика ПИД включает медико-генетическое консультирование пар с отягощенным семейным анамнезом, антенатальную охрану плода. Для предупреждения вторичных иммунодефицитов необходимо своевременное лечение инфекционных и соматических заболеваний, устранение негативного влияния неблагоприятных внешних факторов.
1. Первичные иммунодефициты. Актуальные проблемы диагностики и лечения/ Л.Н. Ончул// Здоровье ребенка. — 2015.
2. Введение в клиническую иммунологию и аллергологию. Первичные и вторичные иммунодефицитные состояния. Методические рекомендации/ Е.В. Нусинов.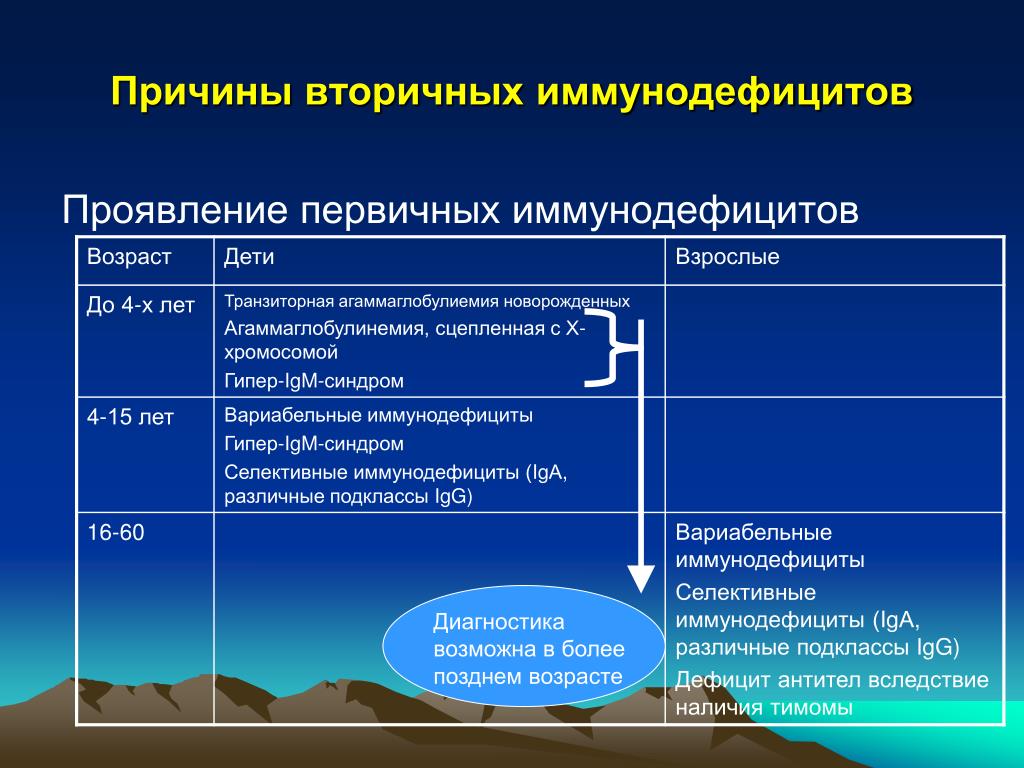 — 2012.
— 2012.
3. Первичные и вторичные иммунодефициты/ Л.М. Карзакова, О.М. Мучукова, Н.Л. Рассказова// В помощь практикующему врачу. — 2008.
Первичные иммунодефициты – группа патологических состояний преимущественно врожденного характера, при которых наблюдается нарушение работы определенных звеньев иммунитета. Симптомы варьируются, зависят от типа заболевания, в основном наблюдается повышенная восприимчивость к бактериальным и вирусным агентам. Диагностика патологии производится посредством лабораторных методов исследования, молекулярно-генетического анализа (при наследственных формах), изучения анамнеза больного. Лечение включает в себя заместительную терапию, трансплантацию костного мозга, мероприятия по борьбе с инфекциями. Некоторые формы иммунодефицитов являются неизлечимыми.
Общие сведения
Первичные иммунодефициты стали активно изучаться с 50-х годов XX века – после того, как в 1952 году американским педиатром Огденом Брутоном было описано первое состояние такого типа, получившее его имя. На настоящий момент известно свыше 25 разновидностей патологии, большая часть из них – генетически детерминированные болезни. Встречаемость разных типов иммунодефицита колеблется от 1:1 000 до 1:5 000 000. Подавляющее большинство больных – дети в возрасте младше 5 лет, слабовыраженные формы могут впервые обнаруживаться у взрослых. В отдельных случаях иммунодефицитное состояние выявляется только по результатам лабораторных анализов. Некоторые виды заболевания сочетаются с многочисленными пороками развития, обладают высокой летальностью.
На настоящий момент известно свыше 25 разновидностей патологии, большая часть из них – генетически детерминированные болезни. Встречаемость разных типов иммунодефицита колеблется от 1:1 000 до 1:5 000 000. Подавляющее большинство больных – дети в возрасте младше 5 лет, слабовыраженные формы могут впервые обнаруживаться у взрослых. В отдельных случаях иммунодефицитное состояние выявляется только по результатам лабораторных анализов. Некоторые виды заболевания сочетаются с многочисленными пороками развития, обладают высокой летальностью.
Причины первичных иммунодефицитов
Иммунодефицитные состояния первичного характера начинают формироваться на этапе внутриутробного развития под воздействием различных факторов. Нередко они сочетаются с иными пороками (дистрофиями, аномалиями тканей и органов, ферментопатиями). По этиологическому признаку выделяют три основные группы врожденных патологий иммунной системы:
- Вследствие генетических мутаций. Подавляющее большинство заболеваний возникает из-за дефектов в генах, ответственных за развитие и дифференцировку иммунокомпетентных клеток.
 Обычно отмечается аутосомно-рецессивное или сцепленное с полом наследование. Имеется небольшая доля спонтанных и герминативных мутаций.
Обычно отмечается аутосомно-рецессивное или сцепленное с полом наследование. Имеется небольшая доля спонтанных и герминативных мутаций. - В результате тератогенного воздействия. К врожденным проблемам с иммунитетом может приводить влияние на плод токсинов различной природы. Иммунодефицит часто сопровождает пороки развития, обусловленные TORCH-инфекциями.
- Неясной этиологии. К данной группе относят случаи, когда выявить причину слабости иммунной системы не удается. Это могут быть еще неизученные генетические аномалии, слабое или неустановленное тератогенное воздействие.
Изучение причин, патогенеза и поиск методик лечения первичных иммунодефицитов продолжается. Уже имеются указания на целую группу подобных состояний, которые не проявляют себя выраженными симптомами, но при определенных условиях могут провоцировать инфекционные осложнения.
Патогенез
Механизм развития недостаточности иммунитета зависит от этиологического фактора. При наиболее распространенном генетическом варианте патологии из-за мутации некоторых генов кодируемые ими белки либо не синтезируются, либо имеют дефект. В зависимости от функций протеина нарушаются процессы формирования лимфоцитов, их трансформации (в Т- или В-клетки, плазмоциты, натуральные киллеры) или выделения антител и цитокинов. Некоторые формы заболевания характеризуются снижением активности макрофагов или комплексной недостаточностью множества звеньев иммунитета. Разновидности иммунодефицита, обусловленные влиянием тератогенных факторов, чаще всего возникают из-за поражения зачатков иммунных органов – тимуса, костного мозга, лимфоидной ткани. Недоразвитие отдельных элементов иммунной системы приводит к ее дисбалансу, что проявляется ослаблением защитных сил организма. Первичный иммунодефицит любого генеза становится причиной развития частых грибковых, бактериальных или вирусных инфекций.
В зависимости от функций протеина нарушаются процессы формирования лимфоцитов, их трансформации (в Т- или В-клетки, плазмоциты, натуральные киллеры) или выделения антител и цитокинов. Некоторые формы заболевания характеризуются снижением активности макрофагов или комплексной недостаточностью множества звеньев иммунитета. Разновидности иммунодефицита, обусловленные влиянием тератогенных факторов, чаще всего возникают из-за поражения зачатков иммунных органов – тимуса, костного мозга, лимфоидной ткани. Недоразвитие отдельных элементов иммунной системы приводит к ее дисбалансу, что проявляется ослаблением защитных сил организма. Первичный иммунодефицит любого генеза становится причиной развития частых грибковых, бактериальных или вирусных инфекций.
Классификация
Количество видов первичных иммунодефицитов достаточно велико. Это объясняется сложностью иммунной системы и тесной интеграцией ее отдельных звеньев, в результате чего нарушение работы или «выключение» одной части способствует ослаблению всей защиты организма в целом. На сегодняшний день разработана сложная разветвленная классификация подобных состояний. Она состоит из пяти главных групп иммунодефицитов, каждая из которых включает несколько наиболее распространенных типов патологии. В упрощенном варианте данную классификацию можно представить следующим образом:
На сегодняшний день разработана сложная разветвленная классификация подобных состояний. Она состоит из пяти главных групп иммунодефицитов, каждая из которых включает несколько наиболее распространенных типов патологии. В упрощенном варианте данную классификацию можно представить следующим образом:
- Первичные дефициты клеточного иммунитета. Группа объединяет состояния, обусловленные недостаточной активностью или низким уровнем Т-лимфоцитов. Причиной может выступать недостаточность тимуса, ферментопатии и иные (преимущественно генетические) нарушения. Наиболее распространенными формами иммунодефицитов такого типа являются синдромы Ди Джорджи и Дункана, оротацидурия, недостаточность ферментов лимфоцитов.
- Первичные дефициты гуморального иммунитета. Группа состояний, при которых понижена функция преимущественно В-лимфоцитов, нарушен синтез иммуноглобулинов. Большинство форм относится к категории дисгаммаглобулинемий. Наиболее известны синдромы Брутона, Веста, дефициты IgM или транскобаламина II.

- Комбинированные первичные иммунодефициты. Обширная группа заболеваний с пониженной активностью как клеточных, так и гуморальных звеньев иммунитета. По некоторым данным, этот тип включает более половины всех разновидностей иммунной недостаточности. Среди них выделяют тяжелые (синдром Гланцманна-Риникера), умеренные (болезнь Луи-Бар, аутоиммунный лимфопролиферативный синдром) и минорные иммунодефициты.
- Первичная недостаточность фагоцитов. Генетические патологии, вызывающие пониженную активность макро- и микрофагов – моноцитов и гранулоцитов. Все заболевания этого типа разделяются на две большие группы – нейтропении и дефекты активности и хемотаксиса лейкоцитов. Примерами являются нейтропения Костмана, синдром «ленивых лейкоцитов».
- Дефициты белков комплемента. Группа иммунодефицитных состояний, развитие которых обусловлено мутациями генов, кодирующих компоненты комплемента. В результате нарушается образование мембраноатакующего комплекса, страдают другие функции, в которых участвуют данные белки.
 Это вызывает комплемент-зависимые первичные иммунодефициты, аутоиммунные состояния или наследственный ангионевротический отек.
Это вызывает комплемент-зависимые первичные иммунодефициты, аутоиммунные состояния или наследственный ангионевротический отек.
Симптомы первичных иммунодефицитов
Клиническая картина различных форм дефицита иммунитета очень разнообразна, может включать не только иммунологические нарушения, но и пороки развития, опухолевые процессы, дерматологические проблемы. Это позволяет врачам-педиатрам или иммунологам дифференцировать разные типы патологии еще на этапе физикального осмотра и базовых лабораторных исследований. Тем не менее, существуют определенные общие симптомы, схожие у заболеваний каждой группы. Их наличие указывает, какое звено или часть иммунной системы были поражены в большей степени.
При первичных дефицитах клеточного иммунитета превалируют вирусные и грибковые заболевания. Таковыми выступают частые простуды, более тяжелое, нежели в норме, протекание детских вирусных инфекций (ветряной оспы, паротита), выраженные герпетические поражения. Нередко возникает кандидоз полости рта, половых органов, велика вероятность грибковых поражений легких, ЖКТ. У лиц с недостатками клеточного звена иммунной системы повышен риск развития злокачественных новообразований – лимфом, рака различной локализации.
У лиц с недостатками клеточного звена иммунной системы повышен риск развития злокачественных новообразований – лимфом, рака различной локализации.
Ослабление гуморальной защиты организма обычно проявляется повышенной чувствительностью к бактериальным агентам. У больных развиваются пневмонии, гнойничковые поражения кожи (пиодермия), часто принимающие тяжелый характер (стафило- или стрептодермия, рожистое воспаление). При уменьшении уровня секреторного IgA поражаются преимущественно слизистые оболочки (конъюнктива глаз, поверхности ротовой и носовой полостей), а также бронхи и кишечник. Комбинированные иммунодефициты сопровождаются как вирусными, так и бактериальными осложнениями. Зачастую на первый план выступают не проявления недостатка иммунитета, а иные, более специфические симптомы – мегалобластная анемия, пороки развития, опухоли тимуса и лимфоидной ткани.
Для врожденных нейтропений и ослабления фагоцитоза гранулоцитов также характерно частое возникновение бактериальных инфекций. Нередки гнойно-воспалительные процессы с образованием абсцессов в различных органах, при отсутствии лечения возможно формирование флегмон, сепсис. Клиническая картина комплемент-ассоциируемых иммунодефицитов представлена либо как снижение устойчивости организма к бактериям, либо в форме аутоиммунных поражений. Отдельный вариант комплемент-зависимого нарушения иммунитета – наследственный АНО – проявляется рецидивирующими отеками различных участков тела.
Нередки гнойно-воспалительные процессы с образованием абсцессов в различных органах, при отсутствии лечения возможно формирование флегмон, сепсис. Клиническая картина комплемент-ассоциируемых иммунодефицитов представлена либо как снижение устойчивости организма к бактериям, либо в форме аутоиммунных поражений. Отдельный вариант комплемент-зависимого нарушения иммунитета – наследственный АНО – проявляется рецидивирующими отеками различных участков тела.
Осложнения
Все виды первичного иммунодефицита объединяет повышенный риск тяжелых инфекционных осложнений. Из-за ослабления защиты организма болезнетворные микробы вызывают тяжелые поражения различных органов. Чаще всего страдают легкие (пневмонии, бронхиты, бронхоэктатическая болезнь), слизистые оболочки, кожа, органы желудочно-кишечного тракта. При тяжелых вариантах заболевания именно инфекция становится причиной смерти в младенческом возрасте. К усугублению патологии могут приводить сопутствующие нарушения – мегалобластная анемия, аномалии развития сердца и сосудов, поражение селезенки и печени. Некоторые формы иммунодефицитных состояний в отдаленной перспективе могут стать причиной образования злокачественных опухолей.
Некоторые формы иммунодефицитных состояний в отдаленной перспективе могут стать причиной образования злокачественных опухолей.
Диагностика
В иммунологии используется огромное количество методик для определения наличия и идентификации типа первичного иммунодефицита. Чаще иммунодефицитные состояния являются врожденными, поэтому могут быть выявлены уже в первые недели и месяцы жизни ребенка. Поводом для обращения к специалисту становятся частые бактериальные или вирусные заболевания, отягощенный наследственный анамнез, наличие иных пороков развития. Разновидности слабо проявляющихся иммунодефицитов могут определяться позже, зачастую обнаруживаются случайно при проведении лабораторных исследований. Основными методами диагностики наследственных и врожденных нарушений иммунитета считаются:
- Общий осмотр. Заподозрить наличие выраженного иммунодефицита можно еще при осмотре кожных покровов. У больных детей часто выявляют выраженные дерматомикозы, гнойничковые поражения, атрофии и эрозии слизистых оболочек.
 Некоторые формы также проявляются отеком подкожной жировой клетчатки.
Некоторые формы также проявляются отеком подкожной жировой клетчатки. - Лабораторные анализы. Лейкоцитарная формула в общем анализе крови нарушается – отмечаются лейкопении, нейтропении, агранулоцитоз и другие аномалии. При некоторых разновидностях возможно увеличение уровня отдельных классов лейкоцитов. Биохимический анализ крови при первичном иммунодефиците гуморального типа подтверждает дисгаммаглобулинемию, наличие необычных метаболитов (при ферментопатиях).
- Специфические иммунологические исследования. Для уточнения диагноза применяют ряд методик, направленных на определение активности иммунной системы. К таковым относят анализ на активированные лейкоциты, фагоцитарную активность гранулоцитов, уровень иммуноглобулинов (в целом и отдельных фракций – IgA, E, G, M). Также производят исследование уровня фракций комплемента, интерлейкинового и интерферонового статусов больного.
- Молекулярно-генетический анализ. Наследственные разновидности первичных иммунодефицитов можно диагностировать путем секвенирования генов, мутации которых приводят к той или иной форме заболевания.
 Так подтверждают диагноз при синдромах Ди Джорджи, Брутона, Дункана, Вискотта-Олдрича и ряде других иммунодефицитных состояний.
Так подтверждают диагноз при синдромах Ди Джорджи, Брутона, Дункана, Вискотта-Олдрича и ряде других иммунодефицитных состояний.
Дифференциальную диагностику в первую очередь производят с приобретенными вторичными иммунодефицитами, которые могут быть вызваны радиоактивным заражением, отравлением цитотоксическими веществами, аутоиммунными и онкологическими патологиями. Особенно тяжело бывает различить причину дефицита при сглаженных формах, определяемых преимущественно у взрослых людей.
Лечение первичных иммунодефицитов
Единых для всех форм патологии принципов лечения не существует из-за различий в этиологии и патогенезе. В наиболее тяжелых случаях (синдром Гланцманна-Риникера, агранулоцитоз Костмана) любые терапевтические мероприятия носят временный характер, больные умирают из-за инфекционных осложнений. Некоторые виды первичных иммунодефицитов лечат путем трансплантации костного мозга или эмбриональной ткани тимуса. Недостаточность клеточного иммунитета можно ослабить использованием специальных колоний-стимулирующих факторов. При ферментопатиях терапию производят применением недостающих энзимов или метаболитов – например, препаратов биотина.
При ферментопатиях терапию производят применением недостающих энзимов или метаболитов – например, препаратов биотина.
При дисглобулинемиях (первичном гуморального иммунодефиците) используют заместительную терапию – введение иммуноглобулинов недостающих классов. В лечении любых форм крайне важно уделять внимание устранению и профилактике инфекций. При первых признаках бактериального, вирусного или грибкового заражения больным назначают курс соответствующих препаратов. Нередко для полного излечения инфекционных патологий требуются повышенные дозировки лекарственных средств. У детей отменяют все вакцинации – они в большинстве случаев неэффективны, а некоторые даже опасны.
Прогноз и профилактика
Прогноз первичного иммунодефицита сильно варьируется при разных типах патологии. Тяжелые формы могут быть неизлечимыми, приводить к гибели в первые месяцы или годы жизни ребенка. Другие разновидности могут успешно контролироваться посредством заместительной терапии или иными методиками лечения, лишь незначительно ухудшая качество жизни пациента. Легкие формы не требуют регулярного врачебного вмешательства, однако больным следует избегать переохлаждения и контактов с источниками инфекции, при признаках вирусного или бактериального заражения обращаться к специалисту. Меры профилактики, учитывая наследственный и часто врожденный характер первичных иммунодефицитов, ограничены. К ним относят медико-генетическое консультирование родителей перед зачатием ребенка (при отягощенной наследственности) и пренатальную генетическую диагностику. В период беременности женщинам необходимо избегать контакта с токсичными веществами или источниками вирусных инфекций.
Легкие формы не требуют регулярного врачебного вмешательства, однако больным следует избегать переохлаждения и контактов с источниками инфекции, при признаках вирусного или бактериального заражения обращаться к специалисту. Меры профилактики, учитывая наследственный и часто врожденный характер первичных иммунодефицитов, ограничены. К ним относят медико-генетическое консультирование родителей перед зачатием ребенка (при отягощенной наследственности) и пренатальную генетическую диагностику. В период беременности женщинам необходимо избегать контакта с токсичными веществами или источниками вирусных инфекций.
Иммунная система человека – сложный механизм, который включает в себя различные органы, ткани, клетки, белки и другие составляющие. Ее основная задача – защищать организм от опасных чужеродных микробов и вирусов, предупреждать развитие инфекционного заболевания и эффективно с ним справляться.
Мы не замечаем и даже не задумываемся об иммунной системе, считая ее работу естественным процессом. И вспоминаем исключительно в том случае, когда она не справляется со своими обязанностями. Вот тут-то и возникает слово «иммунодефицит». Понятие, которое окутано различными мифами и предубеждениями.
И вспоминаем исключительно в том случае, когда она не справляется со своими обязанностями. Вот тут-то и возникает слово «иммунодефицит». Понятие, которое окутано различными мифами и предубеждениями.
MedAboutMe узнал у врача-иммунолога, что такое первичный иммунодефицит, и какие мифы на самом деле правда, а какие – фикция.
Первичный и вторичный иммунодефицит – в чем разница?
Говоря об иммунодефиците у ребенка, врач аллерголог-иммунолог подразумевает частые и тяжелые инфекционные заболевания, которые возникают из-за снижения активности основных компонентов иммунной системы. В первую очередь, нарушение работы клеточного или гуморального звена.
Причины появления иммунодефицитного состояния многообразны и определяют возможности и тактику лечения.
Вторичный или приобретенный иммунодефицит развивается на фоне исходно нормальной реактивности организма и вызван конкретными причинами.
Угнетать работу иммунной системы могут хронические вирусные, бактериальные, паразитарные инфекции, декомпенсированные хронические соматические заболевания, прием определенных групп лекарственных препаратов, голодание, авитаминоз, длительный стресс и т.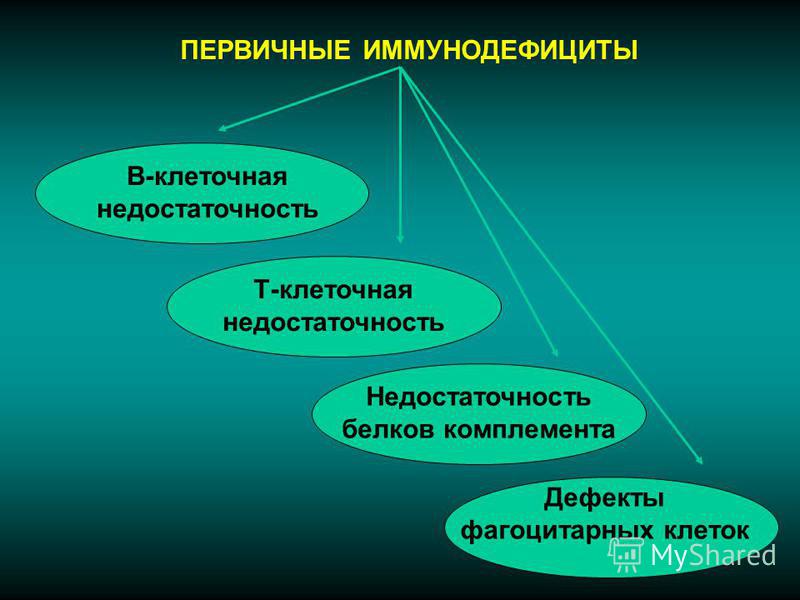 д.
д.
После устранения причинного фактора и проведения иммунотропной терапии функции иммунной системы восстанавливаются.
Первичный или врожденный иммунодефицит – это генетическая поломка или наследственное нарушение работы иммунной системы, которое невозможно устранить. Можно лишь поддерживать иммунный ответ с помощью определенной терапии.
Поговорим подробнее о первичном иммунодефиците и развеем распространенные мифы.
Врожденный иммунодефицит: крайне редкая патология
Первичный иммунодефицит традиционно считается редким заболеванием. Действительно, тяжелые генетические дефекты иммунной системы, не совместимые с жизнью, встречаются примерно в 1 случае на 10 тысяч новорожденных. А вот легкие формы, например, селективный дефицит иммуноглобулина А диагностируют значительно чаще – в 1 случае на 500-1000 человек.
Получается, столкнуться с врожденным гуморальным иммунодефицитом (нарушение выработки антител) у ребенка вполне реально. Он может дебютировать уже в возрасте 5-7 месяцев, когда в крови снижается уровень защитных антител, полученных от матери.
Однако впервые проявить себя данная патология может и намного позже – в подростковом периоде или вовсе станет случайной находкой у взрослого человека. Это объясняется тем, что другие звенья иммунной системы берут на себя функции неполноценного звена, и в целом защита осуществляется на должном уровне.
Вакцинация детям с врожденным иммунодефицитом запрещена
Кажется правильным не вакцинировать ребенка с врожденным иммунодефицитом. Ведь его иммунная система неполноценна и не может бороться с инфекциями в полную силу. Как же она справится с вакциной, которая, по сути, содержит в себе опасные микробы и вирусы?
Не все прививки противопоказаны детям с иммунодефицитами. Запрещено вводить лишь живые вакцины, содержащие ослабленные вирусы и бактерии. Например, живую коревую вакцину.
Инактивированные вакцины, содержащие частички убитых инфекционных агентов, наоборот, показаны детям с иммунодефицитами. Информацию об этом можно увидеть в разделе «показания» соответствующей вакцины.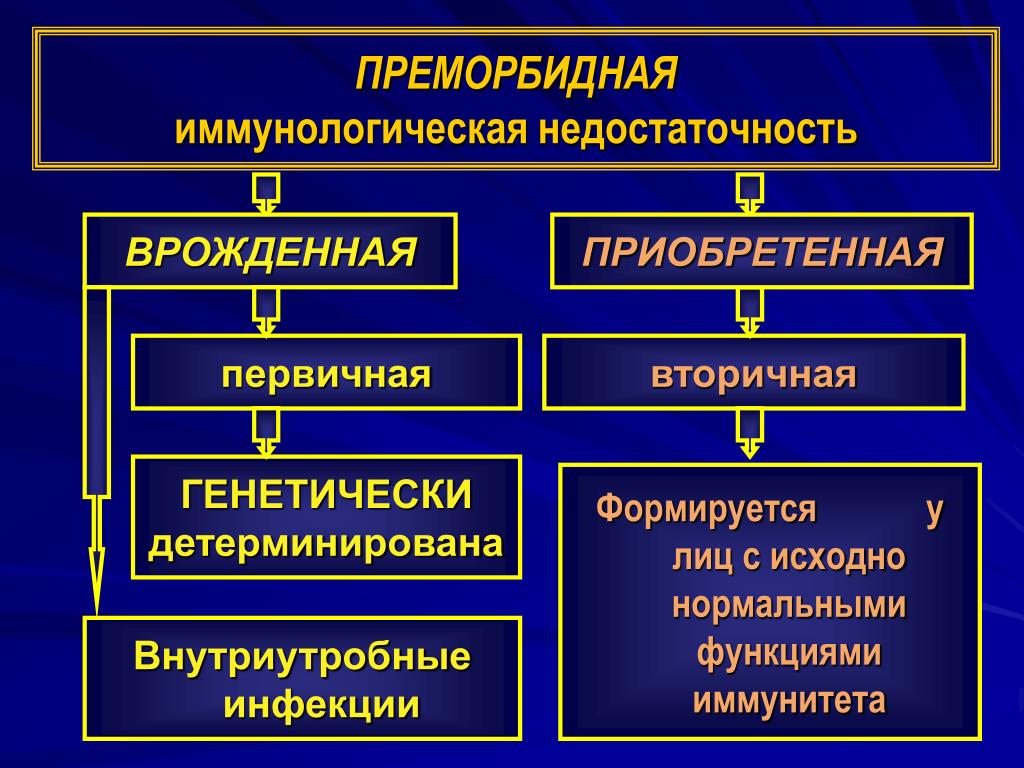
Прививка против гриппа особенно нужна детям из группы риска!
Она увеличит шансы избежать инфекционное заболевание или перенести его в более легкой форме.
Часто болеющий ребенок = врожденный иммунодефицит
Родители, чей ребенок часто болеет острыми респираторными вирусными инфекциями (ОРВИ), обращаются к врачу аллергологу-иммунологу, чтобы выяснить причину такого состояния. Неужели это иммунодефицит?
Иммунная система ребенка развивается постепенно и набирается опыта, встречаясь и сражаясь с инфекцией. Увы, но часто болеть в детском возрасте – это нормально.
Другой вопрос, как именно болеет ребенок. Если малыш, посещающий детский сад, заболевает ОРВИ, достаточно быстро идет на поправку при минимальном симптоматическом лечении и скоро снова чувствует себя здоровым, то это естественно для его возраста.
Если любая банальная «простуда» затягивается, развиваются бактериальные осложнения, справиться с которыми сложно даже с помощью антибиотиков, то стоит задуматься о врожденном иммунодефиците.
Первичный иммунодефицит – помогут иммуномодуляторы
Иммуномодуляторы – препараты, которые способны восстанавливать функции иммунной системы. Они эффективны при диагностированном вторичном иммунодефиците, а вот при врожденной патологии помочь не смогут.
На сегодняшний день наиболее изученным и эффективным методом лечения первичного гуморального иммунодефицита является заместительная терапия внутривенными иммуноглобулинами человека.
Иными словами, ребенок нуждается в регулярном ежемесячном введении защитных антител, полученных от доноров.
Терапия иммуноглобулинами человека является эффективным способом лечения при вторичном иммунодефиците у детей.
При таком диагнозе любые разрекламированные средства не помогают поддерживать защиту против вирусов и бактерий.
Селективная недостаточность иммуноглобулина А: исследование
Селективный дефицит иммуноглобулина А (IgA) – один из наиболее распространенных врожденных иммунодефицитов, который характеризуется снижением или полным отсутствием иммуноглобулинов класса А.
Эти антитела защищают слизистые оболочки дыхательных путей, желудочно-кишечного тракта, мочевыделительной системы и кожу от бактериальных инфекций. Дети, страдающие данной патологией, страдают хроническими рецидивирующими инфекциями различной локализации.
В Смоленском областном центре аллергологии и иммунологии было проведено исследование с целью изучить основные проявления селективного дефицита иммуноглобулина А у детей в возрасте от 6 месяцев до 4 лет и сопоставить их с данными общего анализа крови.
Дети с клиническими проявлениями инфекционного синдрома чаще всего страдают от бронхолегочных инфекций (54%), включая рецидивирующие бронхиты и бронхиты с обструктивным компонентом, и сочетанных инфекций (20%), включая рецидивирующие ринофарингиты, бронхиты и отиты.
При оценке общего анализа крови исследователи отметили, что изменения показателей белой крови (лейкоциты) у детей с селективным дефицитом иммуноглобулина A в момент острой инфекции отсутствуют. Нет характерного для нормально функционирующей иммунной системы ответа, и это основной биомаркер для диагностики данной формы иммунодефицита.
Несмотря на то, что первичный иммунодефицит – заболевание достаточно редкое, никогда не стоит исключать вероятность его развития.
Если ребенок часто и долго болеет, каждый эпизод ОРВИ сопровождается у него бактериальным осложнением и заканчивается приемом антибиотиков, присутствуют хронические очаги инфекций, то необходимо обратиться к врачу аллергологу-иммунологу, а не тестировать различные препараты, которые в лучшем случае не окажут влияния, а в худшем – только навредят здоровью.
Склонен ли ваш ребенок к аллергическим заболеваниям и что является аллергеном? Пройдите тест и узнайте чего стоит ребенку избегать и какие меры предпринять.
Первичный иммунодефицит | Boston Children’s Hospital
In-Depth
Мы понимаем, что вам может понадобиться больше узнать о PIDD вашего ребенка, чтобы найти наиболее подходящее лечение. На следующих страницах мы предоставили ответы на часто задаваемые вопросы, и наши специалисты могут полностью объяснить состояние вашего ребенка.
Что такое иммунная система?
Иммунная система находит и атакует инфекционные организмы, включая бактерии, вирусы и грибки. Иммунная система состоит из нескольких различных типов лейкоцитов. Каждый тип лейкоцитов имеет специализированные функции. Например, нейтрофилы важны для борьбы с бактериями и грибками, тогда как лимфоциты обычно борются с вирусами. Некоторые Т-лимфоциты могут убивать другие клетки, инфицированные вирусом, а В-лимфоциты вырабатывают антитела — белки, борющиеся с инфекцией. Обычно многие различные типы лейкоцитов работают вместе, чтобы бороться со всеми видами инфекций. Таким образом, иммунная система — это действительно система, и проблема в любой части системы может привести к тому, что легкие инфекции перерастут в серьезные.
Что такое первичный иммунодефицит?
Первичные иммунодефицитные состояния (ПИДЗ) представляют собой группу наследственных состояний, поражающих иммунную систему. С момента рождения иммунная система ребенка с PIDD не функционирует должным образом и не может бороться с инфекциями из-за проблем с лейкоцитами, такими как Т-лимфоциты или В-лимфоциты. Дефектная иммунная система может привести к более быстрому и длительному заболеванию детей обычными детскими инфекциями. Эти дети также восприимчивы к инфекции от обычно безвредных организмов. Большинство PIDD не смертельны, но по-прежнему важно диагностировать и лечить их на ранней стадии, чтобы они не стали опасными для жизни.
Дефектная иммунная система может привести к более быстрому и длительному заболеванию детей обычными детскими инфекциями. Эти дети также восприимчивы к инфекции от обычно безвредных организмов. Большинство PIDD не смертельны, но по-прежнему важно диагностировать и лечить их на ранней стадии, чтобы они не стали опасными для жизни.
Известно более 180 видов PIDD. Некоторые дети с PIDD рождаются без определенных типов лейкоцитов. Например, у детей с тяжелым комбинированным иммунодефицитом отсутствуют Т-лимфоциты; у людей с синдромом Костманна нейтрофилы отсутствуют. Дети с другими заболеваниями, такими как синдром Вискотта-Олдрича, имеют нормальное количество лимфоцитов, но их лимфоциты выполняют лишь частичную функцию.
Существует шесть основных типов ПИДЗ в зависимости от пораженной части иммунной системы
- Дефицит В-лимфоцитов (антител)
- Дефицит Т-лимфоцитов
- комбинированная недостаточность В- и Т-клеток
- дефекты фагоцитов
- недостаток комплемента
- другие формы и неизвестные причины
Дефицит В-клеток является наиболее распространенным типом ПИДД
Что вызывает первичные иммунодефицитные состояния?
Приобретенные иммунодефициты возникают после инфекций или воздействия окружающей среды у людей, которые ранее были совершенно здоровы. PIDD присутствуют при рождении, хотя симптомы могут проявиться только в более позднем возрасте, иногда даже в подростковом или взрослом возрасте. Таким образом, PIDD не вызваны воздействием окружающей среды, лекарствами, травмами, диетой или событиями, происходящими во время беременности.
PIDD присутствуют при рождении, хотя симптомы могут проявиться только в более позднем возрасте, иногда даже в подростковом или взрослом возрасте. Таким образом, PIDD не вызваны воздействием окружающей среды, лекарствами, травмами, диетой или событиями, происходящими во время беременности.
ПИДЗ — это генетические нарушения, означающие, что каждая клетка в организме ребенка обычно несет дефектный или мутировавший ген, вызывающий заболевание. У некоторых детей с ПИДД есть родственники с таким же заболеванием. Иногда родители ребенка являются носителями гена, из-за которого будущие дети рискуют родиться с той же проблемой. В других случаях дефектный ген развивался у ребенка спонтанно, и в этом случае будущие братья и сестры ребенка не подвергались риску.
Признаки и симптомы
Хотя генетический дефект, вызывающий ПИДД, присутствует при рождении, у детей с ПИДД могут не проявляться симптомы, пока им не исполнится несколько месяцев. В некоторых случаях они не диагностируются до более позднего детства или даже во взрослом возрасте. Поскольку ПИДЗ влияют на иммунную систему, у детей с этими нарушениями развиваются частые, тяжелые или необычные инфекции. Часто простая простуда приводит к тяжелым бактериальным инфекциям, чаще всего к пневмонии, бронхиту, синуситу и ушным инфекциям (отиту).
Поскольку ПИДЗ влияют на иммунную систему, у детей с этими нарушениями развиваются частые, тяжелые или необычные инфекции. Часто простая простуда приводит к тяжелым бактериальным инфекциям, чаще всего к пневмонии, бронхиту, синуситу и ушным инфекциям (отиту).
Предупреждающие признаки того, что у вашего ребенка может быть ВЗОМТ:
- инфекции
- 4 или более новых инфекций в год, включая инфекции кожи и слизистых оболочек глаз, рта и половых органов
- инфекции требуют внутривенного введения антибиотиков
- 2 или более глубоких инфекций, таких как септицемия
- персистирующая молочница (грибковая инфекция полости рта)
- 2 или более серьезных инфекций носовых пазух в год
- антибиотики практически не действуют в течение 2 и более месяцев
- 2 или более пневмоний в течение года
- видимых знака
- тяжелая экзема
- серьезные кожные инфекции
- неспособность расти и набирать вес в младенчестве
- увеличенные лимфатические узлы
- тяжелые хронические проблемы с пищеварением, такие как спазмы и диарея
- внутренних знака
- аутоиммунные заболевания, такие как волчанка, ревматоидный артрит или диабет 1 типа
- воспаление и инфекция внутренних органов, таких как печень
- увеличенная селезенка
- PIDD в семье
У ребенка, у которого есть только один из этих симптомов или признаков, маловероятно наличие ПИДД. Но если у ребенка есть несколько из этих симптомов или повторные инфекции в течение короткого периода времени, у ребенка может быть ПИДД.
Но если у ребенка есть несколько из этих симптомов или повторные инфекции в течение короткого периода времени, у ребенка может быть ПИДД.
Часто задаваемые вопросы
В: Будет ли мой ребенок в порядке?
A: Большинство детей с PIDD ведут активный образ жизни. Иногда настолько, что их состояние не вызывает подозрений. Раннее выявление, диагностика и лечение имеют решающее значение для снижения риска хронических заболеваний, необратимого повреждения органов или даже смерти.
В: Мог ли я предотвратить развитие ПИДД у моего ребенка?
A: Нет. Пока что исследования показывают только генетику как причину PID. При этом вы можете соблюдать надлежащую гигиену, обеспечить здоровую диету, избегать контакта с инфекциями и принимать назначенные лекарства, чтобы инфекции не атаковали ослабленную иммунную систему вашего ребенка.
В: Может ли ПИДД проявиться в более позднем возрасте, даже если он передается по наследству?
А: Да. Существует форма PIDD, называемая общим вариабельным иммунодефицитом, симптомы которого могут проявляться в любой момент жизни, хотя у большинства людей, страдающих этим заболеванием, оно определяется генетически.
Существует форма PIDD, называемая общим вариабельным иммунодефицитом, симптомы которого могут проявляться в любой момент жизни, хотя у большинства людей, страдающих этим заболеванием, оно определяется генетически.
В: Может ли мой ребенок передать PIDD или заразиться PIDD?
A: Нет. PIDD передается по наследству и передается по наследству. Таким образом, ваш ребенок не может дать или получить PIDD от контакта с другим человеком или его микробами. Однако, если у вашего ребенка есть PIDD, он может быть более уязвимым для инфекций.
В: Есть ли лекарство?
А: Да. При трансплантации стволовых клеток используются стволовые клетки донора, обычно родителя или родственника, для создания нормально функционирующей иммунной системы. Донором обычно является родитель или родственник, поэтому антигены схожи, и тело пациента принимает стволовые клетки донора. Однако таким образом лечат только самые серьезные ПИДЗ. Большинству детей с ПИДД трансплантация стволовых клеток не требуется.
Большинству детей с ПИДД трансплантация стволовых клеток не требуется.
В: Существуют ли другие методы лечения ПИДД?
Ответ: Да. Многие люди с ПИДД, которым не нужна трансплантация стволовых клеток, будут получать заместительную терапию IgG. Это обеспечивает их антителами, которые они не могут вырабатывать сами. Многие пациенты также принимают различные виды антибиотиков и других лекарств для предотвращения определенных типов инфекций.
Вопросы, которые следует задать врачу вашего ребенка
После того, как вашему ребенку поставлен диагноз ПИДД, вы можете чувствовать себя перегруженным информацией. Может быть легко потерять след от вопросов, которые возникают у вас.
Многие родители считают полезным записывать вопросы по мере их возникновения — таким образом, когда вы разговариваете с врачами вашего ребенка, вы можете быть уверены, что получите ответы на все свои вопросы. Если ваш ребенок достаточно взрослый, вы можете предложить ему или ей записать то, что он хочет, и своему лечащему врачу.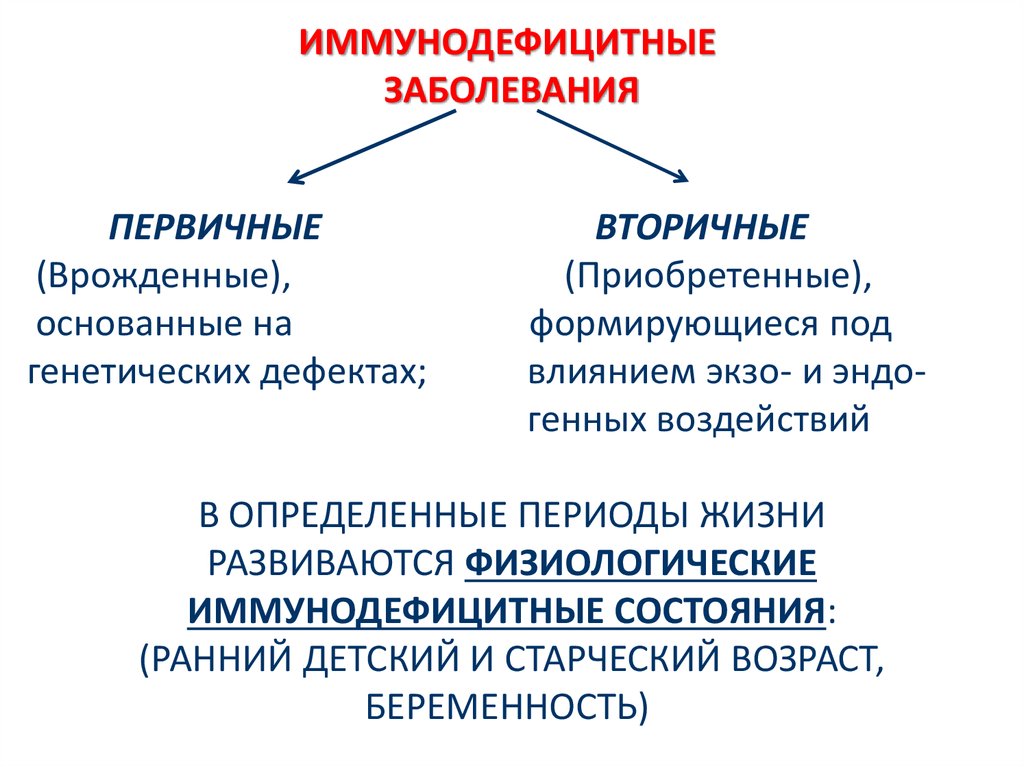
Вот несколько вопросов для начала:
- Как лекарства или лечение PIDD повлияют на успеваемость моего ребенка?
- Как лекарства или лечение ПИДД могут взаимодействовать с другими текущими схемами лечения моего ребенка?
- Потребуется ли изменение диеты моего ребенка во время приема лекарств или лечения ПИДД?
- Что я могу сделать, чтобы свести к минимуму возможность заражения моего ребенка инфекциями?
- Как я могу предоставить своему ребенку инструменты, чтобы помочь себе, если меня нет рядом?
- Как ПИДД повлияет на их взрослую жизнь?
- Какие службы поддержки доступны для информирования моего ребенка о его PIDD?
- Какие шаги я должен предпринять, если у моего ребенка серьезная инфекция?
- Признаком каких других заболеваний могут быть эти симптомы?
- Как определить, связан ли симптом с ПИДД, другим заболеванием или, возможно, ПИД в сочетании с другим заболеванием?
- Как я могу подготовить своего ребенка к любому тестированию?
Помимо того, что вы должны быть готовы задавать вопросы, вы можете подготовиться и получить информацию, чтобы иметь возможность ответить на следующие вопросы вашего врача:
- Когда вы впервые заметили эти симптомы у вашего ребенка?
- Какова частота этих симптомов?
- Какова обычная продолжительность этих симптомов?
- Какова частота инфекций?
- Какова обычная продолжительность инфекций?
- Как ваш ребенок реагирует на антибиотики для лечения инфекций?
- Каков был ваш предыдущий режим антибиотикотерапии для вашего ребенка?
- Есть ли в семейном анамнезе ПИДД?
Иммунодефицитные состояния (детские) | КолумбияДокторс
Записаться на прием
Что такое иммунодефицитные состояния?
Иммунная система представляет собой сеть высокоспециализированных клеток крови и других механизмов в организме, которые борются с болезнями, будь то инфекции, вызванные бактериями или вирусами, или болезни, возникающие внутри организма, такие как рак.
Иммунодефицит (или « иммунодефицит ») — это термин, обозначающий любое из ряда состояний, при которых иммунная система частично или полностью теряет способность бороться с инфекционными заболеваниями. В некоторых случаях иммунодефицит также может повлиять на способность организма выполнять свою естественную функцию по атаке клеток, которые могут стать раковыми.
Человек с иммунодефицитом любого вида считается иммунодефицитом .
Человек с ослабленным иммунитетом может быть особенно уязвим к оппортунистическим инфекциям, таким как грибковые и вирусные заболевания, а также к обычным инфекциям, которые могут поражать всех.
Некоторые люди рождаются с дефектами иммунной системы, что называется «первичным» иммунодефицитом. Большинство случаев иммунодефицита являются приобретенными («вторичными»), то есть они не являются состояниями, с которыми пациент родился, а были вызваны заболеванием или токсином позже.
Первичный иммунодефицит
Первичный иммунодефицит связан с дефектами самой иммунной системы. Многие состояния, вызывающие иммунодефицит, являются редкими заболеваниями, передающимися от одного или обоих родителей. Существует более 80 признанных первичных иммунодефицитных состояний; они обычно маркируются той частью иммунной системы, которая не работает. Примеры включают:
Многие состояния, вызывающие иммунодефицит, являются редкими заболеваниями, передающимися от одного или обоих родителей. Существует более 80 признанных первичных иммунодефицитных состояний; они обычно маркируются той частью иммунной системы, которая не работает. Примеры включают:
- Дефицит гуморального иммунитета связан с состоянием, называемым «гипогаммаглобулинемия», при котором организм не вырабатывает достаточное количество определенных важных видов антител. Общим симптомом его расстройства являются повторные респираторные инфекции.
- Дефицит клеточного иммунитета, включая иммунодефицит Т-клеток Дефекты структур иммунных клеток, таких как Т-клетки, могут сделать пациента уязвимым ко многим инфекциям, которые не поражают людей с нормальной иммунной функцией 1 Отсутствие Т-клеток может быть результатом наследственных состояний, таких как тяжелый комбинированный иммунодефицит (SCID) . Частичная функция Т-клеток возникает при таких состояниях, как синдром приобретенного иммунодефицита (СПИД) и генетических состояниях, таких как синдром Ди Джорджи, атаксия, телеангиэктазия и синдром Вискотта-Олдрича.

- Дефицит гранулоцитов включает низкое количество или отсутствие иммунных клеток, называемых гранулоцитами, которые выполняют важную работу по атаке бактерий 2 Нарушения гранулоцитов также включают снижение функции отдельных гранулоцитов, например, при хронической гранулематозной болезни
- Аспления , при которой отсутствует функция селезенки, которая помогает бороться с инфекцией как ключевой частью лимфатической системы организма
- Нарушения комплемента являются дефицитом системы комплемента, которая представляет собой группу белков в крови, которые обычно помогают лейкоцитам бороться с инфекцией 3
Большинство синдромов иммунодефицита поражают несколько систем и не изолированы только от одной части иммунной системы. Примеры включают SCID, который является первичным, и AIDS, который является вторичным.
Вторичные иммунодефициты
Вторичные иммунодефициты, также известные как приобретенные иммунодефициты, могут быть результатом использования различных лекарств, таких как химиотерапия или токсины окружающей среды, которые подавляют действие иммунной системы (эти вещества называются «иммунодепрессантами»), недоедание, старение и лекарства, такие как химиотерапия, иммунодепрессанты после трансплантации органов и глюкокортикоиды.
Для лекарств термин иммуносупрессия обычно относится как к полезным, так и к потенциальным побочным эффектам снижения функции иммунной системы, в то время как термин иммунодефицит обычно относится только к побочным эффектам повышенного риска инфекции.
Наш подход к иммунодефицитным состояниям
Первичное обследование пациентов с подозрением на иммунодефицит включает общий анализ крови, измерение различных типов клеток крови в крови и их количества; измерения иммуноглобулина и титры антител, оба из которых являются показателями типов антител в крови; и кожные пробы на замедленную гиперчувствительность, другой тип иммунной реакции. Дополнительное тестирование показано, если эти первоначальные тесты указывают на специфическое нарушение функции иммунных клеток или системы комплемента. Они могут включать дополнительное тестирование крови, клеток и генетическое тестирование на определенные мутации.
Лечение обычно включает лечение любых инфекций, которые уже присутствуют, и предотвращение инфекции в будущем, а также замену или укрепление поврежденных или отсутствующих частей иммунной системы.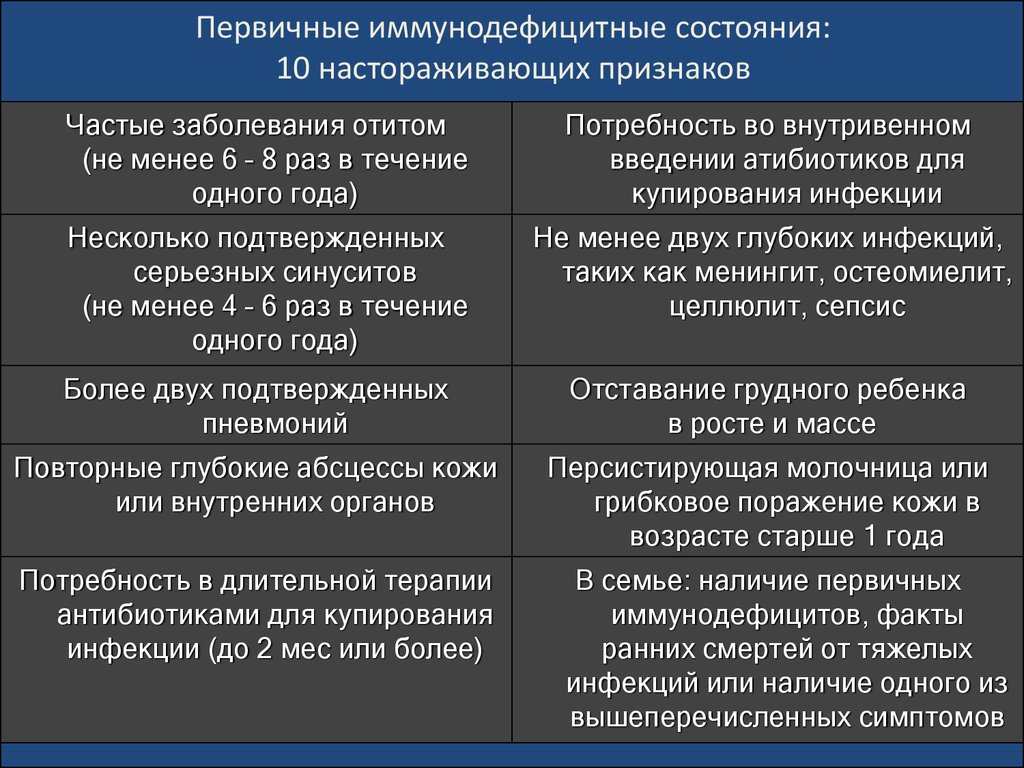 Терапия может включать трансплантацию стволовых клеток и генную терапию.
Терапия может включать трансплантацию стволовых клеток и генную терапию.
Лечение первичных иммунодефицитов:
Лечение первичных иммунодефицитов зависит от характера заболевания и может включать инфузии антител для укрепления иммунной системы, длительное применение антибиотиков и, в некоторых случаях, трансплантацию стволовых клеток.
При лечении первичных иммунодефицитов могут также использоваться некоторые методы лечения вторичных иммунодефицитов, описанные ниже.
Лечение вторичных иммунодефицитов:
Многие специфические заболевания прямо или косвенно вызывают иммунодефицит, например рак, особенно лейкемию, лимфому и некоторые хронические инфекции.
Иммунодефицит также является отличительной чертой синдрома приобретенного иммунодефицита (СПИД), вызываемого вирусом иммунодефицита человека (ВИЧ). ВИЧ напрямую заражает небольшое количество Т-хелперов, а также косвенно ослабляет другие реакции иммунной системы.
Существует большое количество синдромов иммунодефицита, которые могут быть аутоиммунными, при которых известно, что иммунная система атакует клетки и ткани собственного тела пациента. Снижение способности иммунной системы устранять инфекции у этих пациентов может быть причиной аутоиммунитета, поскольку иммунная система постоянно активна, даже если она не работает должным образом.
Снижение способности иммунной системы устранять инфекции у этих пациентов может быть причиной аутоиммунитета, поскольку иммунная система постоянно активна, даже если она не работает должным образом.
Примеры аутоиммунных состояний включают воспалительное заболевание кишечника, аутоиммунную тромбоцитопению (нарушение свертываемости крови), аутоиммунное заболевание щитовидной железы (которое влияет на гормональную систему организма) и семейный гемофагоцитарный лимфогистиоцитоз (наследственное заболевание, при котором определенные иммунные клетки выходят из-под контроля).
Терапия этих состояний направлена на устранение причины расстройства, устранение симптомов, лечение инфекций и лечение каждого состояния с помощью соответствующих методов лечения.
Четыре наиболее распространенных иммунодефицита у детей
Обзор
. 2008 г., апрель 5(2):227-34.
дои: 10. 1080/15476
1080/15476
E Ричард Стим
1
принадлежность
- 1 Отделение иммунологии/аллергологии/ревматологии, Детская больница Mattel в Калифорнийском университете в Лос-Анджелесе, Медицинская школа Дэвида Геффена в Калифорнийском университете в Лос-Анджелесе, Лос-Анджелес, Калифорния
- , США. [email protected]
PMID:
18569394
DOI:
10.1080/15476
2129646 Обзор
E Ричард Стим.
J Иммунотоксикол.
2008 Апрель
.
 2008 г., апрель 5(2):227-34.
2008 г., апрель 5(2):227-34.дои: 10.1080/15476
2129646. Автор
E Ричард Стим
1
принадлежность
- 1 Отделение иммунологии/аллергологии/ревматологии, Детская больница Mattel в Калифорнийском университете в Лос-Анджелесе, Медицинская школа Дэвида Геффена в Калифорнийском университете в Лос-Анджелесе, Лос-Анджелес, Калифорния
- , США. [email protected]
PMID:
18569394
DOI:
10.1080/15476
2129646 Абстрактный
Четырьмя наиболее распространенными иммунодефицитами у детей являются транзиторная гипогамма-глобулинемия младенческого возраста, дефицит подкласса IgG, нарушение реакции на полисахариды (частичный дефицит антител) и селективный дефицит IgA.
 Большинство этих пациентов имеют нормальную клеточную иммунную систему, функцию фагоцитов и уровень комплемента. Все четыре заболевания характеризуются рецидивирующими бактериальными респираторными инфекциями, такими как гнойный ринит, синусит, отит и бронхит. За исключением некоторых пациентов с дефицитом IgA, молекулярная основа этих заболеваний неизвестна, и действительно каждый синдром является гетерогенным, с множеством причин, включая генетические факторы, воздействие лекарственных средств/токсикантов окружающей среды и/или пренатальные физиологические события. В этой статье описаны клинические и лабораторные признаки, предполагаемые причины, текущее лечение и прогноз. Только в некоторых из этих случаев требуется внутривенное введение IgG (ВВИГ), и прогноз на долгую жизнь превосходен.
Большинство этих пациентов имеют нормальную клеточную иммунную систему, функцию фагоцитов и уровень комплемента. Все четыре заболевания характеризуются рецидивирующими бактериальными респираторными инфекциями, такими как гнойный ринит, синусит, отит и бронхит. За исключением некоторых пациентов с дефицитом IgA, молекулярная основа этих заболеваний неизвестна, и действительно каждый синдром является гетерогенным, с множеством причин, включая генетические факторы, воздействие лекарственных средств/токсикантов окружающей среды и/или пренатальные физиологические события. В этой статье описаны клинические и лабораторные признаки, предполагаемые причины, текущее лечение и прогноз. Только в некоторых из этих случаев требуется внутривенное введение IgG (ВВИГ), и прогноз на долгую жизнь превосходен.Похожие статьи
Увеличение сывороточных иммуноглобулинов до возрастного нормального уровня у детей с дефицитом подкласса IgA и/или IgG.

Кутукчулер Н., Караджа Н.Е., Демирчиоглу О., Аксу Г.
Кутуккулер Н. и соавт.
Детская Аллергия Иммунол. 2007 март; 18(2):167-73. doi: 10.1111/j.1399-3038.2006.00491.x.
Детская Аллергия Иммунол. 2007.PMID: 17338791
Случай дефицита подкласса IgG с начальным проявлением преходящей гипогаммаиммуноглобулинемии младенчества и обзор дефицита подкласса IgG.
Неттагул Р., Визитсунторн Н., Вичьянонд П.
Неттагул Р. и др.
J Med Assoc Thai. 2003 г., июль; 86 (7): 686-92.
J Med Assoc Thai. 2003.PMID: 12948264
Ревматологические проявления у пациентов с отдельными первичными иммунодефицитами оценивались в университетской больнице.
Santaella ML, Cox PR, Colón M, Ramos C, Disdier OM.
Сантаэлла М. Л. и соавт.
Л. и соавт.
PR Health Sci J. 2005 Sep;24(3):191-5.
PR Health Sci J. 2005.PMID: 16329682
Роль гамма-глобулина.
Бергер М., Гилберт И.
Бергер М. и соавт.
Семин Респир Инфекция. 1989 декабрь; 4 (4): 272-83.
Семин Респир Инфекция. 1989.PMID: 2516639
Обзор.
Общий вариабельный иммунодефицит: диагностика и лечение.
Эйзенштейн Э.М., Снеллер М.С.
Эйзенштейн Э.М. и соавт.
Энн Аллергия. 1994 г., октябрь; 73 (4): 285–92; викторина 293-4.
Энн Аллергия. 1994.PMID: 7943995
Обзор.
Посмотреть все похожие статьи
Цитируется
Гуморальный ответ IgA, нейтрализующий SARS-CoV-2, возникает раньше, но скромнее и уменьшается быстрее по сравнению с ответом IgG.

Такамацу Ю., Омата К., Симидзу Ю., Киношита-Ивамото Н., Терада М., Судзуки Т., Мориока С., Уэмура Ю., Омагари Н., Маэда К., Мицуя Х.
Такамацу Ю. и др.
bioRxiv. 2022 9 июня: 2022.06.09.495422. дои: 10.1101/2022.06.09.495422. Препринт.
bioRxiv. 2022.PMID: 35702154
Бесплатная статья ЧВК.Новый метод стандартизации измерений IgA в сыворотке показывает повышенную распространенность дефицита IgA у детей раннего возраста с рецидивирующими инфекциями дыхательных путей.
Koenen MH, Bosma M, Roorda UA, Wopereis FM, Roos A, van der Vries E, Bogaert D, Sanders EA, Boes M, Heidema J, van Montfrans JM, Balemans WA, van Holten TC, Verhagen LM.
Коенен М.Х. и соавт.
Клин Трансл Иммунология. 2021 29 октября; 10 (11): e1344. doi: 10.1002/cti2.1344. Электронная коллекция 2021.
Клин Трансл Иммунология. 2021.PMID: 34745609
Бесплатная статья ЧВК.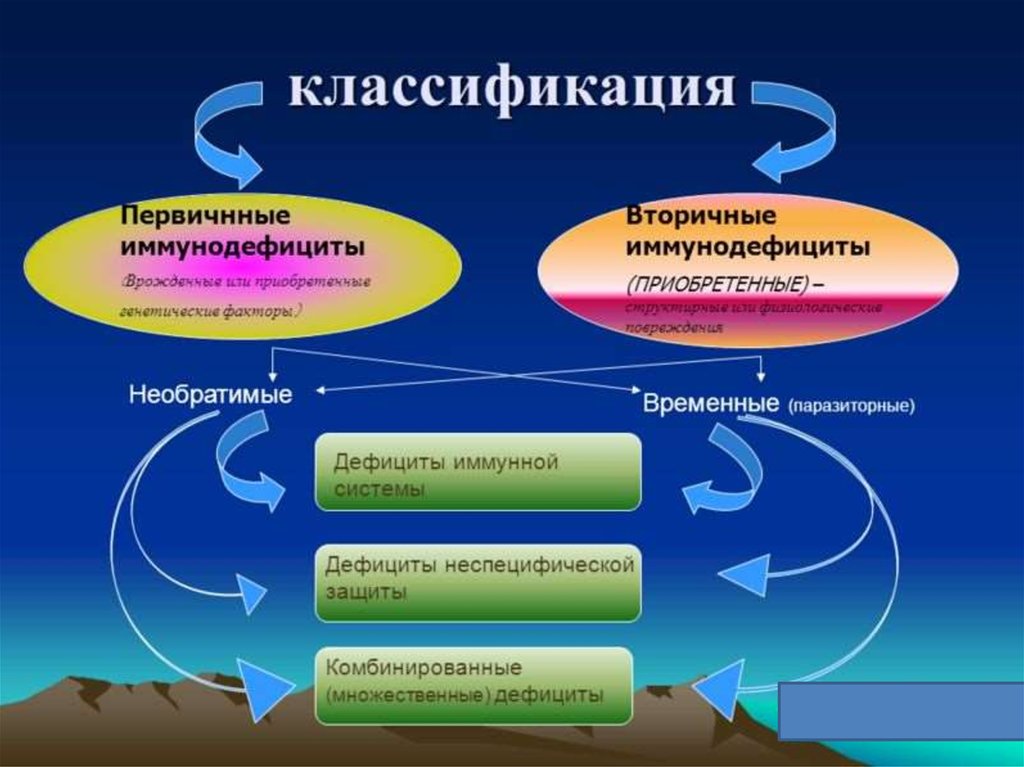
Ринофарингит.
Le Gac MS, Delahaye L, Martins-Carvalho C, Marianowski R.
Ле Гак М.С. и др.
ЕМС Педиатр. 2010;45(2):1-5. doi: 10.1016/S1245-1789(10)70176-1. Epub 2011 10 августа.
ЕМС Педиатр. 2010.PMID: 32308526
Бесплатная статья ЧВК.Испанский.
M281, антитело против FcRn: фармакодинамика, фармакокинетика и безопасность во всем диапазоне снижения IgG в первом исследовании на людях.
Линг Л.Э., Хиллсон Дж.Л., Тиссен Р.Г., Босье Т., ван Ирсель М.П., Никс Д.Дж., Марковиц Л., Силфоне Н.А., Даффнер Дж., Стрейзанд Дж.Б., Мэннинг А.М., Арройо С.
Линг Л.Э. и соавт.
Клин Фармакол Тер. 2019 Апрель; 105 (4): 1031-1039. doi: 10.1002/cpt.1276. Epub 2018 4 декабря.
Клин Фармакол Тер. 2019.PMID: 30402880
Бесплатная статья ЧВК.
Клиническое испытание.
Клиническая полезность измерения иммуноглобулинов подкласса IgG во время иммунологического исследования при подозрении на дефицит первичных антител.
Паркер А.Р., Скольд М., Рамсден Д.Б., Осехо-Виньялс Дж.Г., Лопес-Ойос М., Хардинг С.
Паркер А.Р. и соавт.
Лаборатория мед. 2017 8 ноября; 48 (4): 314-325. doi: 10.1093/labmed/lmx058.
Лаборатория мед. 2017.PMID: 29126302
Бесплатная статья ЧВК.Обзор.
Просмотреть все статьи «Цитируется по»
Типы публикаций
термины MeSH
Младенцы и дети, живущие с PI
Когда у ребенка диагностируют первичный иммунодефицит, каждый член семьи начинает неожиданное и сложное путешествие.
 Вся семья должна смириться с болезнью и, возможно, внести серьезные изменения в расписание и приоритеты. В результате это путешествие может иметь непредвиденные повороты, но также много радостей и наград — путешествие, которое может быть значимым.
Вся семья должна смириться с болезнью и, возможно, внести серьезные изменения в расписание и приоритеты. В результате это путешествие может иметь непредвиденные повороты, но также много радостей и наград — путешествие, которое может быть значимым.Помощь вашему ребенку в понимании
Понимание детьми своего первичного иммунодефицита зависит от того, на каком этапе когнитивного развития они находятся. Они по-разному приспосабливаются к болезни и семейной жизни на каждой стадии развития. Вот информация о том, как дети справляются с проблемами в разном возрасте и как вы можете помочь своему ребенку лучше понять:
Младенцы и малыши (возраст 0-2) только начинают развивать доверие и безопасность, и у них обычно нет понимания их первичный иммунодефицит. У них могут возникнуть проблемы с развитием доверия и безопасности, когда они испытывают боль, ограничение движения и разлуку с родителями. Вы можете помочь, оставаясь с ребенком во время медицинских процедур и госпитализаций, а также поддерживая его, утешая и взаимодействуя с ним в максимально возможной степени.
 Также может быть полезно взять с собой на процедуры любимую мягкую игрушку, соску или одеяло.
Также может быть полезно взять с собой на процедуры любимую мягкую игрушку, соску или одеяло.Дети дошкольного возраста (3-4 года) готовы стать независимыми и готовы делать выбор. Они могут понимать, что значит заболеть, но могут не понимать, почему и как. Пребывание в больнице или приспособление к графику приема лекарств иногда может лишать их свободы и выбора. Дети могут пытаться бросить вызов ограничениям, установленным родителями, чтобы получить некоторый контроль. Вы можете помочь, будучи твердым и последовательным в вещах, в отношении которых у вашего ребенка нет выбора (например, принимая лекарства, посещая врача и т. д.). Однако, когда это возможно, позвольте им принять некоторые решения, например, какое лекарство принять в первую очередь, в каком кресле сесть при взятии крови, и какого цвета повязку использовать или какое место использовать для лечения. Также важно хвалить ребенка за то, что он делает правильный выбор в отношении своего здоровья.
Дети младшего школьного возраста (5-10 лет) развивают более сильное чувство контроля над своим окружением.
 Они могут лучше понимать свою болезнь, но эти причины могут быть не совсем логичными. Дети на этой стадии развития могут полагать, что причиной болезни стали плохие мысли, удары брата или сестры или несоблюдение правил дома. На этом этапе дети также начинают замечать, что могут казаться непохожими на своих сверстников. Вы можете помочь, убедившись, что ваш ребенок знает, что его первичный иммунодефицит не является его ошибкой и что он не сделал ничего, чтобы вызвать его. Также может быть полезно разрешить детям участвовать в управлении уходом за ними. Например, позволение ребенку общаться со своим врачом или помогать следить за графиком приема лекарств может иметь большое значение для развития у ребенка более сильного чувства контроля. Родители также могут помочь детям справиться с болезнью и лечением, побуждая их практиковаться на кукле или плюшевом мишке с набором игрушечного доктора. Предоставление ребенку возможности измерить кукле или медведю температуру или кровяное давление, послушать его дыхание или даже попрактиковаться в болезненных процедурах (таких как уколы, заборы крови, инфузии и т.
Они могут лучше понимать свою болезнь, но эти причины могут быть не совсем логичными. Дети на этой стадии развития могут полагать, что причиной болезни стали плохие мысли, удары брата или сестры или несоблюдение правил дома. На этом этапе дети также начинают замечать, что могут казаться непохожими на своих сверстников. Вы можете помочь, убедившись, что ваш ребенок знает, что его первичный иммунодефицит не является его ошибкой и что он не сделал ничего, чтобы вызвать его. Также может быть полезно разрешить детям участвовать в управлении уходом за ними. Например, позволение ребенку общаться со своим врачом или помогать следить за графиком приема лекарств может иметь большое значение для развития у ребенка более сильного чувства контроля. Родители также могут помочь детям справиться с болезнью и лечением, побуждая их практиковаться на кукле или плюшевом мишке с набором игрушечного доктора. Предоставление ребенку возможности измерить кукле или медведю температуру или кровяное давление, послушать его дыхание или даже попрактиковаться в болезненных процедурах (таких как уколы, заборы крови, инфузии и т. д.) может помочь уменьшить тревогу, которую может испытывать ребенок. Вы должны участвовать в этой игре, но важно, чтобы ребенок взял на себя инициативу.
д.) может помочь уменьшить тревогу, которую может испытывать ребенок. Вы должны участвовать в этой игре, но важно, чтобы ребенок взял на себя инициативу.Дети старшего школьного возраста (старше 11 лет) хотят быть более независимыми от родителей. Отношения с друзьями и социальная деятельность исключительно важны для детей этого возраста. Дети могут чувствовать себя разочарованными, злыми и обделенными, если они вынуждены пропускать занятия из-за болезни или ограничений. Дети этого возраста также могут начать бороться с нежеланием принимать лекарство, особенно если они чувствуют себя лучше. Они могут чувствовать, что им это больше не нужно. Хотя они лучше понимают свое первичное заболевание иммунодефицита и его лечение, не следует ожидать, что они будут реагировать так, как это делают взрослые. Вы можете помочь, объяснив своему ребенку, насколько важными могут быть лекарства в лечении первичного иммунодефицита, даже когда он начинает чувствовать себя лучше. С одобрения поставщика медицинских услуг вашего ребенка ваш ребенок должен участвовать в школе или других мероприятиях, когда это возможно.
 Обязательно вовлекайте вашего ребенка в обсуждения с его медицинской командой, когда это возможно. Это поможет детям чувствовать себя включенными и даст им большее чувство контроля над ситуацией. Всегда важно слушать своего ребенка, и может быть полезно поощрять его выражать эти эмоции через игру, искусство, рисование, музыку или чтение. (См. главу «Подростки, живущие с первичными иммунодефицитами».)
Обязательно вовлекайте вашего ребенка в обсуждения с его медицинской командой, когда это возможно. Это поможет детям чувствовать себя включенными и даст им большее чувство контроля над ситуацией. Всегда важно слушать своего ребенка, и может быть полезно поощрять его выражать эти эмоции через игру, искусство, рисование, музыку или чтение. (См. главу «Подростки, живущие с первичными иммунодефицитами».)Нормализация жизни вашего ребенка
Родители ребенка, живущего с первичным иммунодефицитом, часто сталкиваются со многими проблемами, трудностями и решениями, с которыми другим родителям никогда не придется сталкиваться. Это может быть ошеломляющим, однако есть способы поддержать вашего ребенка и помочь вашей семье справиться с ситуацией.
Медицинский
Объясните ребенку диагноз. Одна из самых важных вещей, которую родители могут сделать для детей с первичным иммунодефицитом, — предоставить точную информацию, соответствующую возрасту, и побудить детей задавать вопросы. Дети, которым не хватает информации о своем диагнозе, склонны придумывать информацию, которая часто является неточной и более пугающей, чем реальные обстоятельства.
Дети, которым не хватает информации о своем диагнозе, склонны придумывать информацию, которая часто является неточной и более пугающей, чем реальные обстоятельства.Также важно, чтобы дети знали, что диагноз поставлен не по их вине и не является наказанием. Убедитесь, что ваш ребенок знает, что вы готовы ответить на любые вопросы, которые могут у него возникнуть. Открытое и честное общение с ребенком помогает укрепить доверие и чувство безопасности, а также помогает ребенку лучше справляться со своими проблемами.
Получайте информацию об особых медицинских проблемах, затрагивающих вашего ребенка. К ним могут относиться:- Меры предосторожности против инфекций, включая совместный сон, посещение школы, ночевки, лагеря и авиаперелеты
- Использование антибиотиков, если они заболели или после известных контактов
- Вакцины для вашего ребенка и семьи
- Избегание (при необходимости) купания, садоводства, игр в листве и т. д.
- Меры предосторожности при занятиях спортом в школе при необходимости
- Питание
- Гигиена полости рта
- Медицинский бейдж
- Премедикация для стоматологических и медицинских процедур
- Генетическое консультирование родителей
- Вопросы страхования
Подготовьте ребенка к медицинским процедурам.
 Дети должны знать, чего им ожидать в жизни. Объясните в соответствии с возрастом, почему проводится процедура, кто будет ее делать, какое оборудование будет использоваться и будет ли она болезненной или неудобной. Это даст ребенку возможность задавать вопросы, укреплять доверие и справляться по-своему, вместо того, чтобы беспокоиться о неизвестном. Крайне важно предоставлять последовательную и точную информацию. Например, не говорите ребенку, что что-то не будет болезненным или неприятным, когда вы знаете, что это будет. Специалисты по детской жизни доступны во многих больницах и могут помочь подготовить детей к госпитализации, операции и различным медицинским процедурам.
Дети должны знать, чего им ожидать в жизни. Объясните в соответствии с возрастом, почему проводится процедура, кто будет ее делать, какое оборудование будет использоваться и будет ли она болезненной или неудобной. Это даст ребенку возможность задавать вопросы, укреплять доверие и справляться по-своему, вместо того, чтобы беспокоиться о неизвестном. Крайне важно предоставлять последовательную и точную информацию. Например, не говорите ребенку, что что-то не будет болезненным или неприятным, когда вы знаете, что это будет. Специалисты по детской жизни доступны во многих больницах и могут помочь подготовить детей к госпитализации, операции и различным медицинским процедурам.Эмоциональный
Помогите ребенку справиться с чувствами по поводу диагноза. Постарайтесь понять те многочисленные эмоции, которые дети испытывают в связи с их первичным иммунодефицитом. Вы можете помочь своему ребенку справиться с трудными эмоциями, открыто говоря о том, что все в семье могут испытывать нечто подобное. Предоставление рутинного и предсказуемого времени для встречи с вашим ребенком дает ему возможность поговорить и поделиться, а вам дает возможность убедить его, что его чувства нормальны и приемлемы. Вы можете задавать вопросы таким образом, чтобы ваш ребенок говорил, используя открытые вопросы. «Какие вопросы у вас есть?» сильно отличается от «У вас есть вопросы?» Вы также можете задавать вопросы о конкретном поведении: «В последнее время вы злитесь на вещи, которые обычно вас не беспокоят. Как вы думаете, почему? Наконец, предложите способы помочь ребенку избавиться от недовольных чувств. Некоторые примеры включают использование игры или искусства для выражения чувств.
Предоставление рутинного и предсказуемого времени для встречи с вашим ребенком дает ему возможность поговорить и поделиться, а вам дает возможность убедить его, что его чувства нормальны и приемлемы. Вы можете задавать вопросы таким образом, чтобы ваш ребенок говорил, используя открытые вопросы. «Какие вопросы у вас есть?» сильно отличается от «У вас есть вопросы?» Вы также можете задавать вопросы о конкретном поведении: «В последнее время вы злитесь на вещи, которые обычно вас не беспокоят. Как вы думаете, почему? Наконец, предложите способы помочь ребенку избавиться от недовольных чувств. Некоторые примеры включают использование игры или искусства для выражения чувств.Дайте ребенку выбор. Многие дети, живущие с первичными иммунодефицитами, склонны думать, что они мало контролируют свою жизнь. Детям нужны возможности делать выбор — иметь власть над любой частью своей жизни, которую они могут контролировать. Этого можно добиться, по возможности предлагая ребенку выбор (например, что бы он хотел на ужин, чем бы он хотел заняться в этот день).
 Когда это уместно, также может помочь участие ребенка в принятии небольших решений относительно его лечения (например, в какую руку сделать укол, в какой день недели или месяца проводить лечение, в какое место использовать для инфузии). , так далее.).
Когда это уместно, также может помочь участие ребенка в принятии небольших решений относительно его лечения (например, в какую руку сделать укол, в какой день недели или месяца проводить лечение, в какое место использовать для инфузии). , так далее.).Социальный телефон
Подготовьте своего ребенка к реакции окружающих. Дети с первичными иммунодефицитами часто не знают, как и что рассказать другим о своем заболевании и симптомах, особенно в тех случаях, когда внешне они выглядят здоровыми. Вы можете помочь, научив ребенка простому и краткому объяснению диагноза. Убедитесь, что вашему ребенку удобно объяснять, что необходимо для хорошего самочувствия. Это может помочь вам и вашему ребенку разыграть примеры того, как отвечать на вопросы, которые могут задать другие, и справляться с любым поддразниванием, которое может произойти. Не забудьте также включить в эти обсуждения братьев и сестер, так как они часто сталкиваются с похожими ситуациями со своими сверстниками.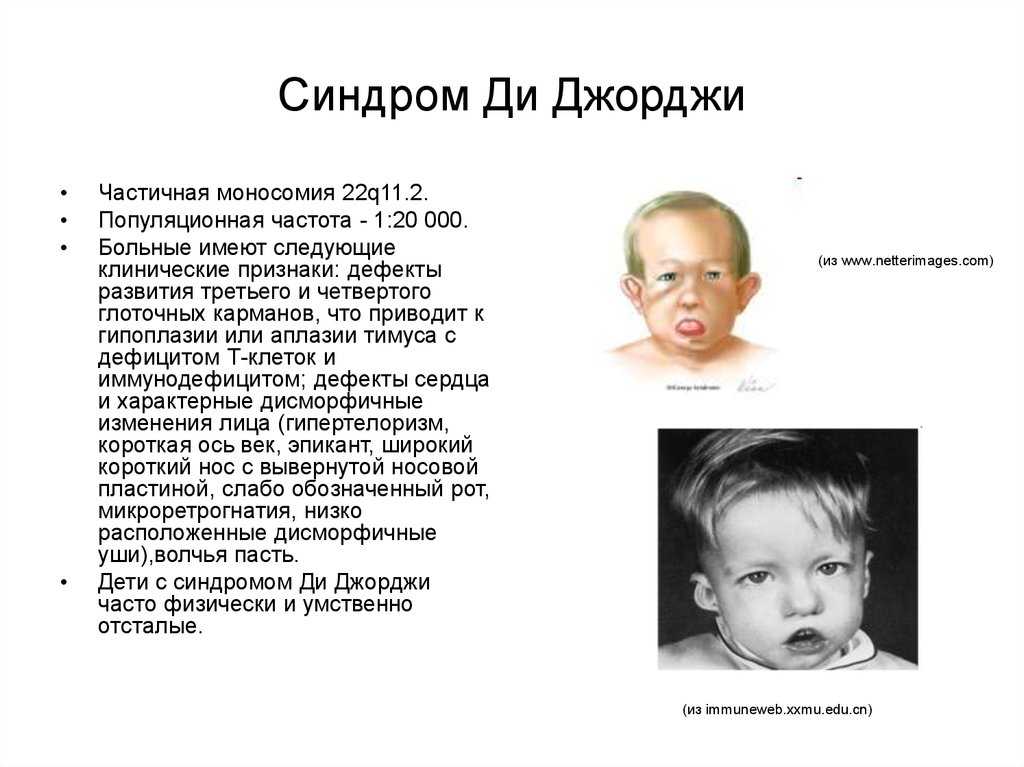
Ищите образцы для подражания. Многие дети с первичными иммунодефицитными состояниями чувствуют себя чужими и изолированными. Общение с другими людьми с таким же диагнозом часто может помочь им в этом отношении. Фонд иммунодефицита (IDF) предлагает детям и семьям множество способов общения в течение всего года, включая семейные уединенные выходные, встречи для обучения пациентов и национальную конференцию, проводимую раз в два года. Вы можете поделиться и задать вопросы в социальной сети IDF Friends, www.idffriends.org. Вы можете попросить IDF связать вас с обученным волонтером по поддержке равных, у которого есть опыт проживания с ребенком с первичным иммунодефицитом. Детям часто полезно контактировать с другими людьми, страдающими тем же заболеванием. IDF может связать вашего ребенка с другими детьми, живущими с первичным иммунодефицитом.
Свяжитесь со школой вашего ребенка. Жизнь с первичным иммунодефицитом может помешать ребенку учиться в школе. Для родителей важно встретиться с учителями, консультантами, медсестрами и администраторами, чтобы объяснить первичное иммунодефицитное заболевание их ребенка и потенциальное влияние на школу (например, частые пропуски занятий, утомляемость, ограничения активности).
 Вы должны рассказать о том, что следует сказать родителям и другим детям в классе о первичном иммунодефиците вашего ребенка. Следует разработать план, который поможет вашему ребенку не отставать от школьных занятий, когда он не может посещать школу. Хорошим ресурсом, который поможет вам координировать свои действия со школой вашего ребенка, является школьное руководство IDF, которое вы можете скачать здесь или заказать здесь.
Вы должны рассказать о том, что следует сказать родителям и другим детям в классе о первичном иммунодефиците вашего ребенка. Следует разработать план, который поможет вашему ребенку не отставать от школьных занятий, когда он не может посещать школу. Хорошим ресурсом, который поможет вам координировать свои действия со школой вашего ребенка, является школьное руководство IDF, которое вы можете скачать здесь или заказать здесь.Семейная жизнь
Ребенок с хроническим заболеванием влияет на всю семейную систему. Исследования показывают, что то, насколько хорошо ребенок с хроническим заболеванием справляется, зависит от того, насколько поддерживается вся семья. Семья, обладающая здоровыми навыками преодоления трудностей, с большей вероятностью будет следовать планам лечения и ухода и будет активно искать поддержки.Хронические заболевания могут по-разному повлиять на вашу семью. Вы можете испытывать повышенное беспокойство, стресс и проблемы со сном или аппетитом, печаль, гнев, чувство утраты и даже чувство облегчения.
 С этими противоречивыми эмоциями может быть трудно справиться, но они являются нормальной частью процесса исцеления для вас и вашей семьи. У родителей может быть меньше времени друг для друга и для общественной деятельности, которой они когда-то наслаждались. Планирование развлечений может быть затруднено из-за непредсказуемости болезни ребенка. Финансовые заботы также могут усилиться.
С этими противоречивыми эмоциями может быть трудно справиться, но они являются нормальной частью процесса исцеления для вас и вашей семьи. У родителей может быть меньше времени друг для друга и для общественной деятельности, которой они когда-то наслаждались. Планирование развлечений может быть затруднено из-за непредсказуемости болезни ребенка. Финансовые заботы также могут усилиться.Братья и сестры могут испытывать широкий спектр эмоций, когда их брат или сестра живут с первичным иммунодефицитом. Эти эмоции часто включают гнев, вину, смущение, печаль, одиночество, страх и замешательство. Братья и сестры также могут испытывать ревность, если им уделяется меньше внимания. Важно говорить с детьми об их чувствах, а не просто отмахиваться от них, думая, что они «справятся» сами.
Семьи могут извлечь пользу из стратегий, которые помогут им снять стресс, разделить обязанности, получить поддержку и исследовать эмоциональные переживания. Подходы включают:Помогите своему ребенку вести как можно более нормальную жизнь.
 Насколько это возможно, вы должны лечить своего ребенка с первичным иммунодефицитом так же, как и любого другого ребенка. В то же время вы должны принимать во внимание здоровье вашего ребенка и любые особые потребности, которые у него могут быть. Это может быть довольно уравновешивающим действием, но для родителей важно поощрять участие своего ребенка в мероприятиях, в которых участвуют другие дети того же возраста.
Насколько это возможно, вы должны лечить своего ребенка с первичным иммунодефицитом так же, как и любого другого ребенка. В то же время вы должны принимать во внимание здоровье вашего ребенка и любые особые потребности, которые у него могут быть. Это может быть довольно уравновешивающим действием, но для родителей важно поощрять участие своего ребенка в мероприятиях, в которых участвуют другие дети того же возраста.Поддерживать семейный распорядок. Вы должны, насколько это возможно, поддерживать регулярный семейный распорядок (например, время пробуждения, время приема пищи, время отхода ко сну, регулярные занятия, работа по дому, дисциплина и т. иммунодефицит. Дети обычно лучше справляются, когда их повседневные дела предсказуемы и последовательны. Конечно, это не всегда возможно, но нужно приложить все усилия, чтобы поддерживать регулярный распорядок и расписание для всех членов семьи.
Помогите другим своим детям справиться. Ребенок, живущий с первичным иммунодефицитом, требует большого родительского внимания.
 Неудивительно, что братья и сестры часто испытывают зависть, гнев и одиночество и беспокоятся о своих братьях и сестрах, а иногда и о своих родителях. Они также могут беспокоиться о том, что могут заболеть. Вы должны объяснить болезнь другим своим детям. Постарайтесь, чтобы они задавали вопросы и выражали свои опасения. Родители должны поддерживать открытые линии связи со всеми своими детьми. Часто детям помогает почувствовать себя важным членом семьи, если они каким-то образом могут принять участие в уходе за своим братом или сестрой. Один из способов помочь братьям и сестрам — сосредоточиться на веселых семейных мероприятиях, когда ваш ребенок с первичным иммунодефицитом здоров. Родителям может быть полезно проводить индивидуальное качественное время с каждым ребенком, давая каждому из них понять, насколько они любимы, ценны и ценны.
Неудивительно, что братья и сестры часто испытывают зависть, гнев и одиночество и беспокоятся о своих братьях и сестрах, а иногда и о своих родителях. Они также могут беспокоиться о том, что могут заболеть. Вы должны объяснить болезнь другим своим детям. Постарайтесь, чтобы они задавали вопросы и выражали свои опасения. Родители должны поддерживать открытые линии связи со всеми своими детьми. Часто детям помогает почувствовать себя важным членом семьи, если они каким-то образом могут принять участие в уходе за своим братом или сестрой. Один из способов помочь братьям и сестрам — сосредоточиться на веселых семейных мероприятиях, когда ваш ребенок с первичным иммунодефицитом здоров. Родителям может быть полезно проводить индивидуальное качественное время с каждым ребенком, давая каждому из них понять, насколько они любимы, ценны и ценны.Сделайте семейное веселье приоритетом. Жизнь с первичным иммунодефицитом ребенка может стать причиной повышенного стресса для всей семьи. Получить поддержку друг от друга может быть сложнее во время стресса, но это еще более важно.
 Проводите время вместе, не зацикливаясь на болезни, и сделайте своим приоритетом выделение времени для всей семьи. Не менее важно иметь специальное время наедине только для родителей и даже для свиданий один на один родитель-ребенок, как упоминалось ранее, когда каждый родитель проводит индивидуальное время с каждым ребенком.
Проводите время вместе, не зацикливаясь на болезни, и сделайте своим приоритетом выделение времени для всей семьи. Не менее важно иметь специальное время наедине только для родителей и даже для свиданий один на один родитель-ребенок, как упоминалось ранее, когда каждый родитель проводит индивидуальное время с каждым ребенком.Координация медицинского обслуживания вашего ребенка
Если у вашего ребенка диагностирован первичный иммунодефицит, вы становитесь частью медицинской бригады вашего ребенка и их главным защитником. Ваша роль в наблюдении за симптомами вашего ребенка, реакцией на лечение и в сообщении о ваших наблюдениях и опасениях имеет жизненно важное значение для оценки и лечения вашего ребенка медицинской бригадой. Во многих случаях в уходе за вашим ребенком будет задействовано более одного воспитателя; поэтому очень важно координировать общение и вести подробные и точные записи медицинского курса вашего ребенка. Многие родители считают, что дневник является бесценным инструментом для документирования событий, влияющих на медицинское обслуживание вашего ребенка. IDF eHealthRecord, онлайновая личная медицинская карта, разработанная для сообщества людей с первичным иммунодефицитом, является еще одним инструментом, помогающим записывать медицинскую информацию о вашем ребенке: www.idfehealthrecord.org.
IDF eHealthRecord, онлайновая личная медицинская карта, разработанная для сообщества людей с первичным иммунодефицитом, является еще одним инструментом, помогающим записывать медицинскую информацию о вашем ребенке: www.idfehealthrecord.org.
Рекомендуемая информация для записи:- Краткий анамнез, ведущий к диагнозу, написанный вами или лечащим врачом вашего ребенка
- Копии лабораторных исследований, подтверждающих диагноз
- Текущий список поставщиков услуг, обеспечивающих уход за вашим ребенком, с точными адресами и номерами телефонов
- Хронология важных событий с особым указанием видов лечения и терапии, изменений в терапии и последующих ответов на эту терапию, операций и/или госпитализаций
- Список текущих лекарств вашего ребенка
- Аллергия на лекарства
- Запись иммунизации
- Текущая страховая информация
- Записи с объяснением льгот могут храниться в журнале или отдельно, но их следует периодически проверять на точность
Возникающие проблемы со страховкой легче решить путем точного ведения записей, а журнал или eHealthRecord IDF будут полезны, если вашему ребенку понадобится обратиться к новому поставщику услуг, особенно в экстренной ситуации.
 Эта форма точного ведения записей сокращает длительные, часто повторяющиеся сеансы сбора истории новыми поставщиками, позволяя больше времени сосредоточиться на неотложной проблеме. Целесообразно, чтобы несколько человек в семье были осведомлены о медицинской рутине ребенка. Хорошо задокументированная медицинская карта, которую вы ведете, может быть чрезвычайно полезной в тех случаях, когда другие заботятся о вашем ребенке.
Эта форма точного ведения записей сокращает длительные, часто повторяющиеся сеансы сбора истории новыми поставщиками, позволяя больше времени сосредоточиться на неотложной проблеме. Целесообразно, чтобы несколько человек в семье были осведомлены о медицинской рутине ребенка. Хорошо задокументированная медицинская карта, которую вы ведете, может быть чрезвычайно полезной в тех случаях, когда другие заботятся о вашем ребенке.
В дополнение к тому, что при каждом посещении врача следует приносить журнал, дополнительные рекомендации при посещении медицинского работника включают:- Подготовьте вопросы: подготовьте список вопросов в письменном виде.
- Делайте заметки: задокументируйте посещение, написав подробности о посещении. По возможности возьмите с собой еще одного члена семьи или друга. Всегда разумно иметь более одного человека, знакомого с распорядком дня пациента.
- Планируйте заранее: будьте готовы к изменению планов или длительным визитам в офис.
 Иногда вы и ваш ребенок пойдете на обследование сразу после визита, или визит может быть продлен по другим причинам. В этом случае вам, возможно, придется принять меры для других ваших детей.
Иногда вы и ваш ребенок пойдете на обследование сразу после визита, или визит может быть продлен по другим причинам. В этом случае вам, возможно, придется принять меры для других ваших детей. - Общайтесь напрямую с ребенком: поощряйте медицинского работника к непосредственному общению с вашим ребенком, когда это возможно. Хотя ваш ребенок может быть маленьким, для него всегда уместно строить отношения со своими поставщиками медицинских услуг.
- Запросить письменные инструкции: Запросить письменные инструкции относительно лекарств и методов лечения. Это помогает избежать ошибок со стороны всех сторон, а также дает вам письменные инструкции, которые нужно разместить в вашем журнале или отсканировать и сохранить в eHealthRecord.
- Подготовьте дорожную сумку: Выделите специальную дорожную сумку только для этих визитов к врачу и включите в нее следующие предметы:
- Игрушки и/или занятия. Делиться игрушками в кабинете врача может быть неразумно, потому что вы не хотите идти домой с большим количеством микробов.
 Вы также можете подготовить соответствующие возрасту занятия, чтобы заинтересовать их
Вы также можете подготовить соответствующие возрасту занятия, чтобы заинтересовать их - Книги: возьмите с собой любимые книги или новую книгу, чтобы помочь вашему ребенку занять себя и успокоиться во время долгого ожидания
- Игровое устройство или смартфон: они также полезны для отвлечения внимания и избавления от скуки
- Блокнот: вы или другой член семьи можете делать заметки
- Список контактов: Включите список контактов с именами и номерами телефонов членов семьи, друзей и школьного персонала
- Закуски: принесите закуски на случай, если визит может быть продлен
Быть защитником вашего ребенка
Как родитель, вы лучший защитник вашего ребенка. Важно сообщать поставщикам услуг вашего ребенка о проблемах и вопросах, которые могут возникнуть у вас или у вашего ребенка. Использование журнала или электронной медицинской записи IDF поможет вам помнить, что обсуждать с врачом вашего ребенка во время различных посещений.
Как вы можете защищать интересы своего ребенка:- Задавайте вопросы о диагнозе, лечении и плане вашего ребенка. Если вы не понимаете, спросите еще раз.
- Спросите, что можно сделать для улучшения здоровья вашего ребенка, например, диета, физическая активность, сон и социальная активность.
- Поддерживайте постоянную связь со школой, так как ваш ребенок может пропустить школьные дни.
- Знайте свой страховой полис и сообщайте о любых изменениях вашему поставщику услуг.
- Если ваш ребенок получает терапию иммуноглобулинами (Ig), записывайте, как она проходит, и/или какие-либо побочные эффекты.
- Постройте позитивные отношения с воспитателями, учителями и терапевтами вашего ребенка. Знайте, кому звонить, когда.
- Спросите о ресурсах для получения дополнительной информации на местном, государственном и национальном уровне.
- Свяжитесь с IDF для получения дополнительных ресурсов: 800-296-4433.
Передача ответственности вашему ребенку
По мере того, как дети развиваются, они начинают формировать собственные мысли и мнения об уходе за ними. Опять же, когда это уместно, предложите ребенку выбор. Это поможет вашему ребенку обрести уверенность, поскольку он имеет некоторый контроль над принятием решений, и подготовит вашего ребенка к участию и, в конечном итоге, к тому, чтобы позаботиться о себе в подростковом и взрослом возрасте. Чем лучше подготовлен ребенок, тем легче будет переход.
Опять же, когда это уместно, предложите ребенку выбор. Это поможет вашему ребенку обрести уверенность, поскольку он имеет некоторый контроль над принятием решений, и подготовит вашего ребенка к участию и, в конечном итоге, к тому, чтобы позаботиться о себе в подростковом и взрослом возрасте. Чем лучше подготовлен ребенок, тем легче будет переход.Когда обращаться за помощью
Рождение ребенка с первичным иммунодефицитом заставляет всю семью справляться со многими изменениями и стрессорами. Это может вызвать эмоциональные и поведенческие проблемы у ребенка, родителей, братьев и сестер и расширенной сети семьи и друзей. Из-за этих проблем члены семьи могут с большей вероятностью испытывать трудности с адаптацией, когда они учатся адаптироваться.Важно поддерживать эмоциональные и поведенческие потребности ребенка. Также важно поддерживать потребности всей семьи. Консультационные услуги могут быть важной частью плана лечения вашего ребенка. Наиболее успешными семьями, как правило, являются те, которые работают вместе как одна команда, чтобы справиться с новыми обязанностями по борьбе с хроническим заболеванием.
 Они опираются на сильные стороны своей семьи, чтобы справиться с новым стрессом, и могут помочь семье стать ближе друг к другу.
Они опираются на сильные стороны своей семьи, чтобы справиться с новым стрессом, и могут помочь семье стать ближе друг к другу.Каждая ситуация уникальна, но есть сходство в том, как дети и семьи реагируют на стресс жизни с первичными иммунодефицитами. Трудности адаптации, обычно наблюдаемые у детей с хроническими заболеваниями и/или у их родителей, братьев и сестер, включают следующее:
- Нарушение настроения: чувство беспокойства или страха, грусти и депрессии, безнадежности, раздражения, гнева, незаинтересованности или отсутствия удовольствия в действиях, которые ранее представляли интерес, пустота, чувство вины и частое беспокойство
- Поведенческие трудности: перепады настроения, вспышки гнева, агрессивное поведение, отказ от оказания медицинской помощи, изменения в активности или уровне энергии, тревога разлуки или цепляние, регрессивное поведение, воспроизведение своей ситуации/травмы и отыгрывание, не слушая, борясь , или даже
- Школа: проблемы с учебой, изменение успеваемости в школе и трудности с концентрацией внимания
- Социальные проблемы: изоляция от сверстников, чувство оторванности от людей, отсутствие интереса к тому, что им раньше нравилось, и ссоры с друзьями
- Проблемы с самооценкой: ощущение себя другим, низкая уверенность в себе и негативные комментарии к себе о том, как они выглядят или чувствуют себя
- Семейные проблемы: повышенная напряженность в отношениях, различное восприятие проблем, обвинения, трудности в общении, ссоры с братьями и сестрами и игнорирование других членов семьи
- Проблемы родителей: трудности с управлением временем, финансовые проблемы, семейный стресс, чувство вины, самообвинение и/или обвинение других, горе и проблемы с дисциплиной
- Физические проблемы: изменения в питании, нарушения сна, боли в животе или головные боли, усталость и чрезмерная активность
Помните, что возможность обратиться за помощью к консультантам и другим специалистам по поддержке является признаком силы.
 За поддержкой можно обратиться в любое время. Не нужно ждать кризиса. На самом деле лучше договориться о поддержке раньше, чем позже. Кроме того, это нормально, что в одно время вы нуждаетесь в поддержке, а в другое нет. Адаптация — это постоянно меняющийся процесс.
За поддержкой можно обратиться в любое время. Не нужно ждать кризиса. На самом деле лучше договориться о поддержке раньше, чем позже. Кроме того, это нормально, что в одно время вы нуждаетесь в поддержке, а в другое нет. Адаптация — это постоянно меняющийся процесс.Удовлетворение ваших потребностей
Родители должны помнить о себе. Удовлетворение собственных потребностей позволит вам лучше заботиться о своем ребенке. Узнайте о диагнозе вашего ребенка. Наличие знаний позволяет родителям принимать обоснованные решения об уходе за своим ребенком и знать, какое поведение и симптомы являются нормальными, а какие нет. Это также помогает родителям ответить на вопросы, которые может задать их ребенок об их болезни.
Берегите себя. Многим родителям это может показаться сложной задачей. Тем не менее, родителям жизненно необходимо позаботиться о себе. В противном случае вы не сможете обеспечить хороший уход. Важно установить связь с другими родителями, которые знают, что значит иметь ребенка, живущего с первичным иммунодефицитом. Позвольте другим помочь, предоставив вам передышку, и обязательно выкроите время, чтобы заняться тем, что вам нравится. Найдите кого-нибудь, кто выслушает ваши опасения, и сделайте своим приоритетом регулярно проводить время с вашим партнером. Научитесь позитивно справляться со стрессом, правильно питаясь, занимаясь спортом, ведя дневник и проводя время со своими детьми.
Позвольте другим помочь, предоставив вам передышку, и обязательно выкроите время, чтобы заняться тем, что вам нравится. Найдите кого-нибудь, кто выслушает ваши опасения, и сделайте своим приоритетом регулярно проводить время с вашим партнером. Научитесь позитивно справляться со стрессом, правильно питаясь, занимаясь спортом, ведя дневник и проводя время со своими детьми.Надейся. Борьба с первичным иммунодефицитом может быть обескураживающей и пугающей. Невероятно важно оставаться позитивным и оптимистичным. Не игнорируйте и не зацикливайтесь на своих заботах или негативных чувствах. Вместо этого признайте и решите их в положительной манере. Если вы попытаетесь найти положительную сторону вещей, вы преподадите своему ребенку ценный урок, а также сохраните собственное душевное спокойствие.
Выдержки из Справочника пациентов и семей по первичным иммунодефицитным заболеваниям Фонда иммунодефицита, ПЯТОЕ ИЗДАНИЕ Copyright 2013 Фонд иммунодефицита, США. Эта страница содержит общую медицинскую информацию, которую нельзя безопасно применять к какому-либо отдельному случаю.
 Медицинские знания и практика могут быстро меняться. Поэтому эту страницу не следует использовать в качестве замены профессиональной медицинской консультации.
Медицинские знания и практика могут быстро меняться. Поэтому эту страницу не следует использовать в качестве замены профессиональной медицинской консультации.Тяжелый комбинированный иммунодефицит (для родителей)
Что такое тяжелый комбинированный иммунодефицит?
Тяжелый комбинированный иммунодефицит (ТКИД) — очень редкое генетическое заболевание, вызывающее опасные для жизни проблемы с иммунной системой. это типа первичный иммунодефицит .
Примерно 1 из 58 000 детей рождается с
SCID в США каждый год.Что происходит при тяжелом комбинированном иммунодефиците?
У развивающегося ребенка иммунная система зарождается в костном мозге. Стволовые клетки могут стать любым из трех различных типов клеток крови:
- эритроциты
- лейкоциты
- тромбоциты
Лейкоциты защищают организм от инфекций и чужеродных захватчиков. Существуют различные виды лейкоцитов, в том числе лимфоциты (lim-FOE-сайты).
 Лимфоциты бывают двух основных типов: В-клетки и Т-клетки. Эти клетки играют ключевую роль в борьбе с инфекциями:
Лимфоциты бывают двух основных типов: В-клетки и Т-клетки. Эти клетки играют ключевую роль в борьбе с инфекциями:- Т-клетки выявляют, атакуют и убивают «захватчиков».
- В-клетки вырабатывают антитела, которые «помнят» инфекцию и готовы к повторному заражению организма.
SCID (произносится как «скид») представляет собой «комбинированный» иммунодефицит, поскольку он поражает оба этих лейкоцита, борющихся с инфекцией.
При ТКИН в организме ребенка слишком мало лимфоцитов или лимфоциты не работают должным образом.
Поскольку иммунная система не работает должным образом, ей может быть трудно или невозможно бороться с микробами —
вирусы,
бактерии и
грибки, вызывающие инфекции.Что вызывает тяжелый комбинированный иммунодефицит?
Существуют различные виды тяжелого комбинированного иммунодефицита. Наиболее распространенный тип вызван проблемой в гене, обнаруженном на X.
хромосома и поражает только мужчин. Женщины могут быть носителями этого заболевания, но поскольку они также наследуют нормальную Х-хромосому, их иммунная система может бороться с инфекциями. У мужчин, однако, есть только одна Х-хромосома, поэтому, если ген ненормальный, появляется болезнь.
У мужчин, однако, есть только одна Х-хромосома, поэтому, если ген ненормальный, появляется болезнь.Другая форма ТКИД вызывается дефицитом
фермент, необходимый для развития лимфоцитов. Другие типы SCID вызваны множеством других генетических проблем.Каковы признаки и симптомы тяжелого комбинированного иммунодефицита?
Младенцы с ТКИН могут казаться здоровыми при рождении, но вскоре после этого могут начаться проблемы, такие как:
- задержка развития
- хроническая диарея
- частые, часто серьезные респираторные инфекции
- стоматит (разновидность дрожжевой инфекции во рту)
- другие бактериальные, вирусные или грибковые инфекции, которые могут быть серьезными и трудно поддающимися лечению, например:
- ушные инфекции (острый средний отит)
- инфекции пазух (синусит)
- кожная сыпь
- менингит
- пневмония
Как диагностируется тяжелый комбинированный иммунодефицит?
Врачи используют простой анализ крови для выявления у новорожденных многих состояний, которые могут вызвать проблемы со здоровьем, таких как серповидно-клеточная анемия и кистозный фиброз.
 Условия, на которые проводится скрининг, различаются в зависимости от штата, но теперь все они предлагают скрининг на тяжелый комбинированный иммунодефицит. Скрининг новорожденных на SCID делает возможной раннюю диагностику, а быстрое лечение приводит к лучшим результатам.
Условия, на которые проводится скрининг, различаются в зависимости от штата, но теперь все они предлагают скрининг на тяжелый комбинированный иммунодефицит. Скрининг новорожденных на SCID делает возможной раннюю диагностику, а быстрое лечение приводит к лучшим результатам.Новорожденных с подозрением на ТКИН обычно направляют к врачу, специализирующемуся на иммунодефиците. Врач назначит другие анализы крови и, возможно, генетическое тестирование.
Родители, у которых есть ребенок с SCID или семейный анамнез иммунодефицита, могут захотеть рассмотреть генетическое консультирование и ранний анализ крови. Ранняя диагностика может привести к быстрому лечению и лучшему результату. Также можно проверить ребенка из группы высокого риска на наличие заболевания до рождения, если генетическая предрасположенность
известна мутация, вызывающая SCID в семье.Детям, у которых в семейном анамнезе не известно заболевание или которые не проходят скрининг новорожденных, диагноз часто не ставится до 6-месячного возраста или старше.
Как лечить тяжелый комбинированный иммунодефицит?
SCID — неотложная педиатрическая помощь. Без лечения дети вряд ли доживут до своего первого дня рождения. Наиболее распространенным методом лечения является трансплантация стволовых клеток (также называемая трансплантацией костного мозга ). Это означает, что ребенок получает стволовые клетки от донора. Есть надежда, что эти новые клетки восстановят иммунную систему ребенка.
В наиболее успешных трансплантатах стволовых клеток используются клетки, пожертвованные братом или сестрой. Иногда стволовые клетки родителей подходят. Если ни один из членов семьи не является подходящим донором, врачи могут использовать стволовые клетки неродственного донора. Некоторым детям с SCID может потребоваться химиотерапия перед трансплантацией.
Ребенок с ТКИН, которому пересадили стволовые клетки в первые несколько месяцев жизни, прежде чем он заразится, скорее всего, выживет.
Генная терапия как метод лечения некоторых типов ТКИН показала многообещающие результаты в клинических испытаниях, но сопряжена с некоторыми рисками, поэтому пока не используется широко.
 Исследования по генной терапии SCID продолжаются.
Исследования по генной терапии SCID продолжаются.За детьми с ТКИД обычно ухаживает медицинская бригада из нескольких специалистов, таких как:
- детский иммунолог
- врач по пересадке костного мозга
- детский инфекционист
Поскольку дети с ТКИД подвержены риску опасных для жизни инфекций, им часто назначают лекарства для предотвращения инфекции. Некоторым может потребоваться регулярная инфузия для замены антител.
Что еще я должен знать?
Помимо лекарств и методов лечения, помогающих предотвратить инфекции, используются и другие меры предосторожности. Дети с ТКИД:
- помещены в изолятор для предотвращения распространения инфекции
- не должны получать живые вакцины. Введение вируса или бактерии ребенку с ТКИН, даже в ослабленной форме вакцины, может быть опасным. К ним относятся ротавирусная вакцина, вакцина против ветряной оспы (ветряной оспы), вакцина против кори, эпидемического паротита и краснухи (MMR), пероральная полиомиелитная вакцина, вакцина БЦЖ и FluMist.
 Любой, кто живет в одном доме с ребенком, также не должен получать живые вакцины.
Любой, кто живет в одном доме с ребенком, также не должен получать живые вакцины. - , нуждающиеся в переливании крови, должны получить кровь, специально обработанную для предотвращения осложнений, связанных с переливанием крови
- можно прекратить грудное вскармливание до тех пор, пока грудное молоко не будет проверено на наличие вируса, который может вызвать инфекцию
Как я могу помочь своему ребенку?
Пока ваш ребенок проходит обследование на ТКИН, помогите снизить риск заражения:
- ограничьте количество посетителей
- избегать общественных мест
- держать ребенка подальше от простуды или инфекции
- следить за тем, чтобы лица, осуществляющие уход, хорошо моют руки, прежде чем прикасаться к ребенку
Заглядывая вперед
Младенцам с ТКИН может потребоваться множество процедур и повторное пребывание в больнице. Это может быть стрессом для любой семьи. Но вы не одиноки. Команда по уходу всегда рядом с вами и вашим ребенком до, во время и после лечения.
 Группы поддержки, социальные работники и друзья семьи также могут протянуть руку помощи или услышать понимание.
Группы поддержки, социальные работники и друзья семьи также могут протянуть руку помощи или услышать понимание.Для получения дополнительной информации или онлайн-поддержки посетите:
- Фонд иммунодефицита
- SCID, Ангелы на всю жизнь
Клинические рекомендации: Первичные иммунодефициты
См. также
лихорадящий ребенок
Внебольничная пневмония
Плевральный выпот и эмпиема
Менингит и энцефалитКлючевые моменты
- Первичные иммунодефициты (ПИД) проявляются различными симптомами в зависимости от пораженной части иммунной системы
- Тщательное поэтапное обследование в консультации со специалистами позволяет поставить точный диагноз и быстро начать лечение
- Большинство детей младшего возраста с рецидивирующими легкими инфекциями не имеют ВЗОМТ
История вопроса
Первичные иммунодефициты:
- Представляют собой разнообразную группу генетически детерминированных дефектов которые могут возникать во всех частях иммунной системы
- Приводить к повышенному риску бактериальных, грибковых и/или вирусных инфекций
- При тяжелых ВЗОМТ ранняя диагностика может предотвратить инфекционные осложнения и обеспечить радикальное лечение.

ВЗОМТ следует подозревать у всех детей с:
- тяжелой инфекцией
- инфекцией необычными или условно-патогенными микроорганизмами
- рецидивирующей инфекцией — чаще, чем ожидается для этого возраста (например, у здоровых детей младшего возраста может быть 5-10 легких инфекций в год, часто больше если посещаете детский сад)
- рецидивирующая инфекция в том же месте также может быть вызвана анатомической аномалией (например, менингитом и анатомическими дефектами гематоэнцефалического барьера)
ВЗОМТ можно разделить на шесть основных типов:
Тип ФИД
Примеры
Клинические признаки
Дефицит антител
- Х-сцепленная агаммаглобулинемия (XLA)
- Общий вариабельный иммунодефицит (CVID)
- Дефицит специфических антител
- Замедленный рост
- Хроническая диарея и/или мальабсорбция
- Рецидивирующий/тяжелый синусит или средний отит
- Менингит
- Сепсис
Комбинированный иммунодефицит
- Тяжелый комбинированный иммунодефицит (ТКИД)
- Делеция 22q11 (синдром Ди Джорджи)
- Х-сцепленный гипер-IgM
- Синдром Вискотта-Олдрича
- Poor growth
- Absence of thymus
- Chronic diarrhoea
- Recurrent/severe sinusitis or otitis media
- Severe eczema or nappy rash
- Severe oral candidiasis
- Severe or chronic viral infections eg EBV
- DiGeorge syndrome: Congenital heart заболевания и/или характерные черты лица
- Эктодермальная дисплазия: отсутствие ногтей, тонкие волосы, снижение потоотделения
Дефицит фагоцитарных клеток
- Хроническая гранулематозная болезнь (ХГБ)
- Дефект адгезии лейкоцитов (LAD)
- Синдром Чедиака-Хигаси
- Циклическая нейтропения
- Рецидивирующие абсцессы кожи или глубоких органов
- Гингивит
- Остеомиелит
- Тяжелая или рецидивирующая пневмония
Дефицит комплемента
- Наследственный ангионевротический отек
- Специфический дефицит комплемента
- Менингит или сепсис, вызванный инкапсулированными бактериями ( Neisseria meningitidis, Streptococcus pneumoniae, Haemophilus influenzae типа B)
- Рецидивирующий ангионевротический отек
Иммунная дисрегуляция
- Аутоиммунный лимфопролиферативный синдром (АЛПС)
- Иммунодисрегуляционная полиэндокринопатия, энтеропатия, Х-сцепленный синдром (IPEX)
- Аутоиммунная полиэндокринопатия, кандидозно-эктодермальная дистрофия (APECED)
- Синдромы семейного гемофагоцитарного лимфогистиоцитоза (FHL)
- Эндокринные расстройства
- Хроническая диарея
- Лимфаденопатия
Аутовоспалительные заболевания
- Семейная средиземноморская лихорадка (FMF)
- Хронический рецидивирующий многоочаговый остеомиелит (CRMO)
- Воспалительные заболевания кишечника
- Другие аутовоспалительные заболевания
- Рецидивирующие лихорадки
- Воспалительный артрит или перитонит
- Сыпь
- Спленомегалия
Анамнез
Существует широкий спектр симптомов и признаков ВЗОМТ, включая:
- Замедление роста (особенно
медленный набор веса) - Персистирующая лимфопения (особенно число лимфоцитов
<1 x 10 9 /л у детей младше 1 года - Хроническая диарея
- Четыре или более инфекций среднего уха в течение одного года
- Две или более серьезные инфекции носовых пазух в течение одного года
- Рецидивирующие глубокие абсцессы кожи или органов
- Персистирующая молочница во рту, на коже или в других местах после 1 года
- Неадекватная реакция на антибиотики (два или более месяца антибиотиков с небольшим эффектом)
- Повторная госпитализация для внутривенного введения антибиотиков
- Инвазивная пневмококковая или менингококковая инфекция
- Рецидивирующие, тяжелые или длительные инфекции, вызванные распространенными патогенами, например аденовирусом
- Family history of immunodeficiency, previous sibling death (unexplained or due to infection), parental consanguinity
Examination
- Persistent lymphadenopathy
- Oral candidiasis
- Gingivitis
- Severe or chronic otitis media or sinusitis
- Skin abscesses
- Пальцевые палочки
- Тяжелая экзема или экземоподобные высыпания
- Спленомегалия
- Слабая мышечная масса, запасы жира или признаки дефицита питательных веществ
Ведение
Исследования
Исследования первой линии включают: тельца Howell Jolly)
После консультации со специалистом рассмотрите:
- Общие сывороточные иммуноглобулины G/A/M (подкласс IgG не следует измерять рутинно)
- Субпопуляции лимфоцитов – CD3/CD4/CD8/CD19/CD16/56
- При подозрении на SCID требуется оценка наивных Т-клеток (CD45RA/RO), поскольку количество CD4/CD8 может быть в пределах нормы
- ВИЧ антитела
- УЗИ органов брюшной полости для подтверждения наличия селезенки и исследований комплемента (например, CH50) у детей с инвазивной менингококковой или пневмококковой инфекцией
Дети старше 2 лет с инвазивной пневмококковой инфекцией (сепсис, менингит, осложненная пневмония или септический артрит) ) без явного предрасполагающего состояния, и все дети с рецидивирующим ИПЗ должны быть обследованы на иммунодефицит.

Любой ребенок с нормальными результатами исследований первой линии, но с высоким подозрением на ВЗОМТ должен быть направлен к детскому иммунологу для оценки и рассмотрения возможности проведения тестов второй линии
Детям с подозрением на ВЗОМТ не следует вводить живые вакцины (в том числе против ветряной оспы, MMR, ротавируса и вакцины БЦЖ)
Рассмотреть возможность консультации с местной педиатрической бригадой, когда
- Любой ребенок с тяжелой инфекцией или плохим ответом на терапию
- Любой ребенок с известным или подозреваемым первичным иммунодефицитом с лихорадкой
- Неясно, требуется ли обследование и последующее наблюдение при подозрении на ВЗОМТ
- Любой ребенок с подозрением на ТКИН должен быть немедленно обсужден с детским иммунологом
Рассмотреть вопрос о переводе, когда
нуждающихся в уходе выше уровня комфорта местной больницы
Для неотложной помощи и педиатрического или неонатального перевода в отделение интенсивной терапии см.


 Рекомендуется мониторирование побочных явлений
Рекомендуется мониторирование побочных явлений