Геморрагический цистит у детей: Цистит у детей — причины, симптомы и лечение детских болезней в «СМ-Клиника» для детей и подростков
Геморрагический цистит ⛑ симптомы, диагностика и лечение цистита с кровью
Пациенты, страдающие циститом, порой отмечают примесь крови в моче, геморрагии. Подобное явление характерно для острого или обострения хронического воспаления. Медицинские работники называют цистит с кровью «геморрагическим».
Такой процесс чаще встречается у женщин, страдающих хроническим воспалением мочевого пузыря. Возникновение примеси крови, как правило, отмечается в последней порции мочи и выглядит в виде прожилок, реже – красной взвеси (гематурия). Многих это пугает, вызывает беспокойство и заставляет обращаться к врачам1.
Гематурия при цистите указывает на выраженное поражение слизистой и служит показанием для консультации врача-уролога.
Прием Канефрон® Н в комплексной терапии помогает скорее снять (купировать) гематурию, независимо от причины цистита.
Причины, виды цистита с кровью
По частоте цистит с кровью составляет до 10% всех случаев воспаления мочевого пузыря. И указывает на грубое поражение капилляров слизистой его оболочки2.
И указывает на грубое поражение капилляров слизистой его оболочки2.
Причины тяжелого воспаления:
- Инфекции – бактериальная флора, грибки, вирусы герпеса.
- Экзогенные неинфекционные факторы. Как правило – мочекаменная болезнь, туберкулез почек или отдельные формы рака.
Соответственно, видов геморрагического цистита два: инфекционный и неинфекционный.
Типичная причина цистита с кровью – рецидивирующее хроническое воспаление мочевого пузыря. Чаще всего оно вызывается кишечной палочкой и стафилококками3.
Растительные флавоноиды, фенолкарбоновые кислоты и эфирные масла в составе Канефрон® Н оказывают противовоспалительное, спазмолитическое, диуретическое и антибактериальное действия при любых формах циститов.
Клинические проявления, симптомы
Характерно, что признаки цистита с кровью сочетаются с клиникой тяжелого воспаления мочевого пузыря:
- жжение и рези внизу живота;
- значительно учащенные, нестерпимые (императивные) позывы к мочеиспусканию;
- моча выделяется многократно, малыми порциями;
- кровь чаще отмечается в последней порции (пузырной).
Секс иногда может причинять боль или становится фактором, после которого появляются геморрагии.
Если игнорировать симптомы цистита с кровью, процесс прогрессирует. Инфекция поднимается по мочеточникам в почки. Моча с небольшой примесью розового превращается в насыщенно-красную, что указывает на выраженную кровопотерю. Иногда со струей выходят даже сгустки4.
Применение Канефрон® Н помогает унять воспаление и способствует восстановлению сосудов слизистой пузыря. Но сначала нужно установить причину геморрагий.
Диагностика заболевания
Диагностика основывается на анализах и обследованиях:
- микроскопия осадка мочи – эритроциты, лейкоциты, слизь;
- бакпосев для выявления возбудителя и уточнения его стойкости к препаратам;
- анализы крови на антитела к вирусам герпеса;
- кровь на свертываемость;
- УЗИ мочевого пузыря.
Для точной диагностики цистита с кровью может понадобиться цистоскопия – осмотр полости пузыря микрокамерой, заведенной через уретру. Так можно увидеть источник геморрагий, кровотечения5.
Так можно увидеть источник геморрагий, кровотечения5.
Женщинам может назначаться осмотр гинеколога для исключения болезней репродуктивных органов. Полезно будет показать и партнера урологу.
Важно: врач может рекомендовать лечение цистита с кровью после анализа внешне нормальной мочи. Это означает, что воспаление только начинается, примесь крови маленькая и видна лишь под микроскопом.
Противовоспалительное и антиоксидантное действия Канефрон® Н скорее приносят облегчение пациентам, если вводится в терапию сразу после постановки диагноза.
Лечение
При появлении цистита с кровью лечение назначают исходя из его причины, и обязательно в первые дни добавляют препараты, нормализующие свертываемость крови.
Канефрон® Н в схему лечения цистита с кровью вводится по рекомендациям врача. Экстракты трех лекарственных растений (травы золототысячника, корня любистка и листьев розмарина) оказывают спазмолитическое действие.
Но чаще сталкиваются с острым или хроническим поражением капилляров слизистой оболочки пузыря. Поэтому в состав комплексной терапии включают Канефрон® Н таблетки по 2 шт трижды в день, или Канефрон® Н капли – по 50, тоже 3 раза ежедневно.
Поэтому в состав комплексной терапии включают Канефрон® Н таблетки по 2 шт трижды в день, или Канефрон® Н капли – по 50, тоже 3 раза ежедневно.
Особо актуален фитопрепарат для профилактики инфекций6. Патентованная технология фитониринга гарантирует одинаковое содержание активных растительных компонентов в каждой таблетке и капле.
Профилактика
Меры профилактики зависят от вида и причины воспаления мочевого пузыря. Но поскольку почти всегда капилляры поражаются воспалением, профилактика цистита с кровью должна основываться на сохранении защитных ресурсов слизистой оболочки мочевого пузыря. При хроническом процессе нужно предотвращать рецидивы – одежда по сезону, закаливание, соблюдение правил гигиены.
Применение Канефрон® Н в формате профилактических курсов заметно снижает риск обострений, появления цистита геморрагического характера.
Курс приема – индивидуальный, типичный алгоритм: прием Канефрон® Н в составе комплексной терапии по 2 таблетки или по 50 капель три раза в день на протяжении двух недель7. Также Канефрон® Н возможно применять при риске хронического цистита: переохлаждении, ОРВИ и др.
Также Канефрон® Н возможно применять при риске хронического цистита: переохлаждении, ОРВИ и др.
1 Manikandan R, Kumar S, Lalgudi N. Dorairajan, Hemorrhagic cystitis: A challenge to the urologist. Indian J Urol 2010; 26 (2): 159-66. Basler J, Kim E. Hemorrhagic Cystitis. Medscape, 2016.
2 Лоран О.Б., Синякова Л.А., Незовибатько Я.И. «Геморрагический цистит у женщин: эпидемиология, этиология, патогенез, диагностика» Consilium Medicum, том. 19, N. 7, 2017, стр. 50-55.
3 Naber K, Scaeffer A, Heyns C et al. Urogenital Infections. 2010.
4 Talar-Williams C, Hijazi YM, Walther MM et al. Cyclophosphamide-induced cystitis and bladder cancer in patients with WegenerOs granulomatosis. Ann Intern Med 1996; 124: 477-84.
5 Epstein J, Reuter V, Amin M. Biopsy Interpretation of the Bladder. 2nd edition, 2011.
6 Локшин Константин Леонидович. «Как терапия урологических заболеваний влияет на микробиом: стандартные подходы в сравнении с альтернативными (реферат статьи)» Consilium Medicum, vol. 20, no. 7, 2018, pp. 69-72.
20, no. 7, 2018, pp. 69-72.
7 Ю.Г. Аляев, А.В. Амосов, В.А. Григорян, Г.Е. Крупинов, Е.А. Султанова, В.С. Саенко. Возможности применения Канефрона Н в урологии. // Врачебное сословие. — 2006. — № 8. — С. 25 — 32.
Геморрагический цистит у женщин: диагностика и лечение
Для цитирования:
Синякова Л.А., Лоран О.Б., Косова И.В., Колбасов Д.Н., Незовибатько Я.И. Геморрагический цистит у женщин:
диагностика и лечение. Экспериментальная и клиническая урология 2020;13(5):92-98, https://doi.org/10.29188/2222-8543-2020-13-5-92-98
ВВЕДЕНИЕ
Лечение инфекций мочевых путей (ИМП) зачастую является сложной задачей, что в большинстве случаев обусловлено трудностями диагностики причин развития ИМП и выявления факторов риска, приводящих к постоянному рецидивированию заболевания. При первом посещении врач не может ответить на вопрос: «Является ли данный эпизод инфекции неосложненной ИМП?» Ведь только обследовав пациентку, можно установить причину развития дизурии, болей над лоном, макрогематурии и т. д. и назначить терапию согласно принятым рекомендациям. Только такой подход позволит избежать бесконтрольного приема антимикробных препаратов, в том числе и фторхинолонов, развития анитбиотикорезистентности, перехода инфекции в хроническую форму, нарушения нормального биоценоза кишечника и влагалища.
д. и назначить терапию согласно принятым рекомендациям. Только такой подход позволит избежать бесконтрольного приема антимикробных препаратов, в том числе и фторхинолонов, развития анитбиотикорезистентности, перехода инфекции в хроническую форму, нарушения нормального биоценоза кишечника и влагалища.
Бактерии семейства Enterobacterales являются наиболее частым этиологическим агентом развития ИМП, однако в ряде случаев никакого бактериального агента выявить не удается, а основным клиническим признаком наравне с дизурией является макрогематурия [1, 2]. В настоящее время все большее внимание уделяется влиянию вирусных инфекций на развитие ИМП как у взрослых, так и у детей [3-9]. Явление вирусурии также достаточно активно обсуждается в литературе [3-12]. По данным различных авторов, вирусы группы герпес-вирусов, папилломавирусов, аденовирусов могут являться причиной развития стойкой дизурии [5, 13]. Следует отметить, что герпес-вирусы: вирус простого герпеса (ВПГ) 1 и 2 типов, цитомегаловирус (ЦМВ), вирус Эпштейна-Барр (ВЭБ) способны вызывать вторичную иммуносупрессию и усугублять течение бактериальной инфекции, приводя к развитию рецидивов [11, 12, 14]. Прием антимикробных препаратов при наличии вирусной составляющей еще больше усугубляет процесс за счет подавления нормальной флоры.
Прием антимикробных препаратов при наличии вирусной составляющей еще больше усугубляет процесс за счет подавления нормальной флоры.
Цель: изучить причины возникновения геморрагических циститов, разработать алгоритм обследования указанных пациенток, а также подобрать рациональную терапию.
МАТЕРИАЛЫ И МЕТОДЫ
В урологическое отделение ГБУЗ «ГКБ им. В.П. Демихова ДЗМ» за 2019 год была госпитализирована 61 пациентка с клинической картиной острого геморрагического цистита в возрасте от 18 до 89 лет (средний возраст составил 55,56±21,82 г.). Это составляет 59,2% от всех пациенток, госпитализированных в отделение по поводу воспалительных заболеваний нижних мочевых путей. Больным проводилось стандартное обследование: общий анализ мочи, посев мочи на флору и чувствительность к антибиотикам, ультразвуковое исследование почек и мочевого пузыря, цистоскопия по показаниям.
Учитывая высокую частоту наличия вирусных инфекций как этиологического фактора развития геморрагического цистита на базе кафедры урологии и хирургической андрологии ГБОУ ДПО РМАНПО Минздрава России был разработан алгоритм обследования указанной категории больных, дополнительно включающий метод полимеразной цепной реакции (ПЦР) первой порции мочи (соскоба из уретры) на наличие ВРГ 1 и 2 типов, ЦМВ, ВЭБ в период обострения, иммуноферментный анализ (ИФА) с определением иммуноглобулинов G и M к ВПГ 1 и 2 типов, ЦМВ и ВЭБ, посев отделяемого из влагалища на флору и чувствительность к антибиотикам с обязательным указанием количества лактобацилл.
По данному алгоритму на базе кафедры урологии и хирургической андрологии ГБОУ ДПО РМАНПО Минздрава России было обследовано 214 пациенток, из них 154 (72%) пациентки были в возрасте от 18 до 44 лет.
РЕЗУЛЬТАТЫ
При обследовании 61 пациентки в урологическом отделении ГБУЗ «ГКБ им. В.П. Демихова ДЗМ» выявлено, что передозировка антикоагулянтов у пациенток пожилого возраста, имеющих отягощенный кардиологический, неврологический анамнез (фибрилляция предсердий, хроническая ишемия головного мозга, перенесенное острое нарушение мозгового кровообращения и т.д.) как причина развития макрогематурии и дизурических явлений, имела место в 18% случаев (11 больных). Постлучевой цистит (лучевая терапия по поводу рака шейки матки в 2 случаях и рака влагалища у 1 пациентки) был у трех больных. Им выполнена трансуретральная резекция стенки мочевого пузыря и коагуляция кровоточащих сосудов). В двух случаях анамнестически имелась опухоль мочевого пузыря, однако гистологически рецидив опухоли не подтвержден. В остальных случаях пациентки заболели остро и в связи с выраженной дизурией и макрогематурией были госпитализированы в урологическое отделение.
В остальных случаях пациентки заболели остро и в связи с выраженной дизурией и макрогематурией были госпитализированы в урологическое отделение.
Рис. 1. Данные бактериологического анализа мочи
Fig. 1. The results of bacteriological analysis of urine
Отсутствие лейкоцитурии и бактериурии, наличие микро- или макрогематурии, стерильные посевы мочи, изменения, характерные для вирусного поражения стенки мочевого пузыря в виде множественных петехиальных кровоизлияний, выявленные нами при цистоскопии, позволили нам предположить именно вирусную этиологию заболевания (рис. 2).
Рис. 2. Цистоскопическая картина геморрагического цистита. Множественные петехиальные кровоизлияния
Fig. 2. Cystoscopic picture of hemorrhagic cystitis. Multiple petechial hemorrhages
Пациентки с геморрагическим циститом не нуждаются в госпитализации, однако наличие гематурии вызывает беспокойство и, как правило, они настаивают на госпитализации для исключения опухолевого процесса.
И таким образом доля геморрагических циститов предположительно вирусной этиологии, вирусных уретритов в структуре воспалительных заболеваний нижних мочевых путей увеличивается, что диктует необходимость создания потенциально нового алгоритма обследования этой категории больных и этиологически обоснованной терапии.
Подобный алгоритм был разработан на базе кафедры урологии и хирургической андрологии ГБОУ ДПО РМАНПО МЗ РФ (табл. 1).
Таблица 1. Алгоритм диагностики рецидивирующих (геморрагических) циститов
Table 1. Diagnostic algorithm for recurrent (hemorrhagic) urinary tract infections
ТЩАТЕЛЬНО СОБРАННЫЙ АНАМНЕЗ! С выявлением таких факторов риска, как раннее начало половой жизни, частая смена половых партнеров, наличие инвазивных манипуляций, сопутствующие хронические гинекологические заболевания, дисбиозы влагалища. Наличие вирусных инфекций (лабиального и генитального герпеса, ЦМВ, ВЭБ, вируса папилломы человека (ВПЧ) как высокого, так и низкого онкогенного риска) у пациентки и ее половых партнеров. |
| Влагалищный осмотр с проведением пробы O’Donnell |
| Общий анализ мочи |
| Посев мочи, посев отделяемого из влагалища на флору и чувствительность к антибиотикам с обязательным указанием количества лактобацилл!! |
| Обследование на наличие инфекций передающихся половым путем (ИППП), включая вирусные инфекции (ВПГ 1 и 2 типов, ЦМВ, ВЭБ, ВПЧ высокого онкогенного риска) ИФА на исследование противовирусных антител к указанным вирусам. |
| Ультразвуковое исследование почек, мочевого пузыря с определением остаточной мочи, органов малого таза с допплерографией |
| Цистоскопия с биопсией |
| Осмотр гинекологом |
Наличие хронической герпесвирусной латентной инфекции (ХГВИ) выявлено у 83 (37%) из 214 обследованных пациенток на кафедре урологии и хирургической андрологии, что подтверждено данными анамнеза, результатами ИФА с увеличением уровня иммуноглобулинов G в десятки и сотни раз. Уровень антител к ВПГ 1 и 2 типов у пациенток с геморрагическим циститом без лейкоцитурии и стерильным бактериологическим посевом мочи достоверно выше, чем у пациенток с геморрагическим циститом и выявленным возбудителем в 2,6 раз (р<0,05). Подобное увеличение показателей противовирусных антител свидетельствует не о носительстве, а о присутствии именно ХГВИ. Может иметь место повышение антител не только к ВПГ и 2 типов, но и к другим герпес-вирусам: к ЦМВ (клинический пример 1) и ВЭБ (клинический пример 2).
Уровень антител к ВПГ 1 и 2 типов у пациенток с геморрагическим циститом без лейкоцитурии и стерильным бактериологическим посевом мочи достоверно выше, чем у пациенток с геморрагическим циститом и выявленным возбудителем в 2,6 раз (р<0,05). Подобное увеличение показателей противовирусных антител свидетельствует не о носительстве, а о присутствии именно ХГВИ. Может иметь место повышение антител не только к ВПГ и 2 типов, но и к другим герпес-вирусам: к ЦМВ (клинический пример 1) и ВЭБ (клинический пример 2).
Сочетанная герпес-вирусная инфекция в виде микст-инфекции ВПГ 1 и 2 типа и ЦМВ выявлена в 66,3% случаев, в остальных – дополнительно выявлен ВЭБ.
Цистоскопия с биопсией слизистой мочевого пузыря выполнена 32 больным. Морфологическими особенностями вирусного геморрагического цистита являются койлоцитоз, выявленный у 29(90%) пациенток (рис. 3) и изменения клеток по типу «тутовых ягод» отмечены у 18(50,2%) пациенток (рис. 4).
Рис. 3. Фрагмент биоптата мочевого пузыря с признаками выраженного воспалительного инфильтрата, с преобладанием лимфоцитов (Л), признаки внутриклеточной инфекции: койлоцитоз (К), внутриядерные включения (обозначены стрелками). Окраска гематоксилин – эозин ув. 40х/0,65
Окраска гематоксилин – эозин ув. 40х/0,65
Fig. 3. A fragment of a bladder biopsy with signs of severe inflammatory infiltrate, with a predominance of lymphocytes (L), signs of intracellular infection : coylocytosis (K), intracellular inclusions (indicated by arrows). Color of hematoxylineosin UV. 40x/0.65
Рис. 4. Фрагмент биоптата мочевого пузыря с признаками выраженного воспалительного инфильтрата, наличие изменений клеток по типу «тутовых ягод». Окр. гематоксилин-эозин. Увеличение 10х10
Fig. 4. A fragment of a bladder biopsy with signs of severe inflammatory infiltrate, presence of cell changes of the «mulberry type»
Приведенные ниже клинические примеры показывают эффективность применения разработанного нами алгоритма.
Клинический пример 1. Пациентка Д., 33 лет. В течение 3 лет страдает рецидивирующим циститом, периодически с примесью крови. В межрецидивный период беспокоят жжение, боли, дискомфорт в уретре, выраженная астения, диспареуния. Следует отметить, что симптоматика усиливалась во время ОРВИ, что на наш взгляд, является одним из патогномоничных признаков вирусной этиологии цистита. Неоднократно получала курсы антимикробной терапии (левофлоксацин, фуразидин, супракс, фосфомицина трометамол) с частичным положительным эффектом. Бактериурии, лейкоцитурии не выявлено. Страдает лабиальным герпесом (рецидивы примерно 1-2 раза в год). По данным ИФА выявлено повышение уровня противовирусных антител к ЦМВ: IgG к ВПГ 1 и 2 типов 9,7 инд.поз., анти-ЦМВ IgG – 228.7 ед/мл (положительный – более 6 ед/мл), анти-ВЭБ IgG-EBNA – 15,5 ед/мл, анти-ВЭБ IgG-VCA – 21,2 ед/мл. Больной назначена длительная супрессивная противовирусная терапия с положительным эффектом. Через 6 месяцев уровень антител к ЦМВ снизился до 8,5 ед/мл.
Следует отметить, что симптоматика усиливалась во время ОРВИ, что на наш взгляд, является одним из патогномоничных признаков вирусной этиологии цистита. Неоднократно получала курсы антимикробной терапии (левофлоксацин, фуразидин, супракс, фосфомицина трометамол) с частичным положительным эффектом. Бактериурии, лейкоцитурии не выявлено. Страдает лабиальным герпесом (рецидивы примерно 1-2 раза в год). По данным ИФА выявлено повышение уровня противовирусных антител к ЦМВ: IgG к ВПГ 1 и 2 типов 9,7 инд.поз., анти-ЦМВ IgG – 228.7 ед/мл (положительный – более 6 ед/мл), анти-ВЭБ IgG-EBNA – 15,5 ед/мл, анти-ВЭБ IgG-VCA – 21,2 ед/мл. Больной назначена длительная супрессивная противовирусная терапия с положительным эффектом. Через 6 месяцев уровень антител к ЦМВ снизился до 8,5 ед/мл.
Клинический пример 2. Пациентка Б., 56 лет. Постменопауза. В течение 20 лет страдает генитальным герпесом. В последнее время обострения 2-3 раза в год. Геморрагический цистит в течение последних 2 лет, в межрецидивный период беспокоят дискомфорт и жжение при мочеиспускании. Лейкоцитурии, бактериурии нет, в соскобах из уретры, взятых вне обострения вирусного поражения не выявлено. Поэтому очень важно проводить обследование в острый период (выполнение ПЦР первой порции мочи и/или взятие соскобов из уретры). Цистоскопическая картина геморрагического цистита. Однако обнаружено выраженное повышение уровня противовирусных антител к ВПГ 1 и 2 типов, ЦМВ, ВЭБ: анти-ВПГ 1 типа IgG – 222 ед/мл, анти-ВПГ 2 типа IgG – 3 ед/мл (более 22 ед/мл – положительно), анти-ЦМВ IgG – 407,8 ед/мл (положительный – более 1 ед/мл), анти-ВЭБ IgG-EBNA – 196 ед/мл (более 20 ед/мл –положительно), анти-ВЭБ IgG-VCA – 505 ед/мл (более 20 ед/мл – положительно). Назначена длительная противовирусная терапия с положительным эффектом.
Лейкоцитурии, бактериурии нет, в соскобах из уретры, взятых вне обострения вирусного поражения не выявлено. Поэтому очень важно проводить обследование в острый период (выполнение ПЦР первой порции мочи и/или взятие соскобов из уретры). Цистоскопическая картина геморрагического цистита. Однако обнаружено выраженное повышение уровня противовирусных антител к ВПГ 1 и 2 типов, ЦМВ, ВЭБ: анти-ВПГ 1 типа IgG – 222 ед/мл, анти-ВПГ 2 типа IgG – 3 ед/мл (более 22 ед/мл – положительно), анти-ЦМВ IgG – 407,8 ед/мл (положительный – более 1 ед/мл), анти-ВЭБ IgG-EBNA – 196 ед/мл (более 20 ед/мл –положительно), анти-ВЭБ IgG-VCA – 505 ед/мл (более 20 ед/мл – положительно). Назначена длительная противовирусная терапия с положительным эффектом.
Клинический пример 3. Пациентка Х., 26 лет, госпитализирована в экстренном порядке в ГКБ им. С. П. Боткина с жалобами на примесь крови в моче со сгустками, учащенное и болезненное мочеиспускание, рези в конце мочеиспускания, жжение в области наружных половых органов.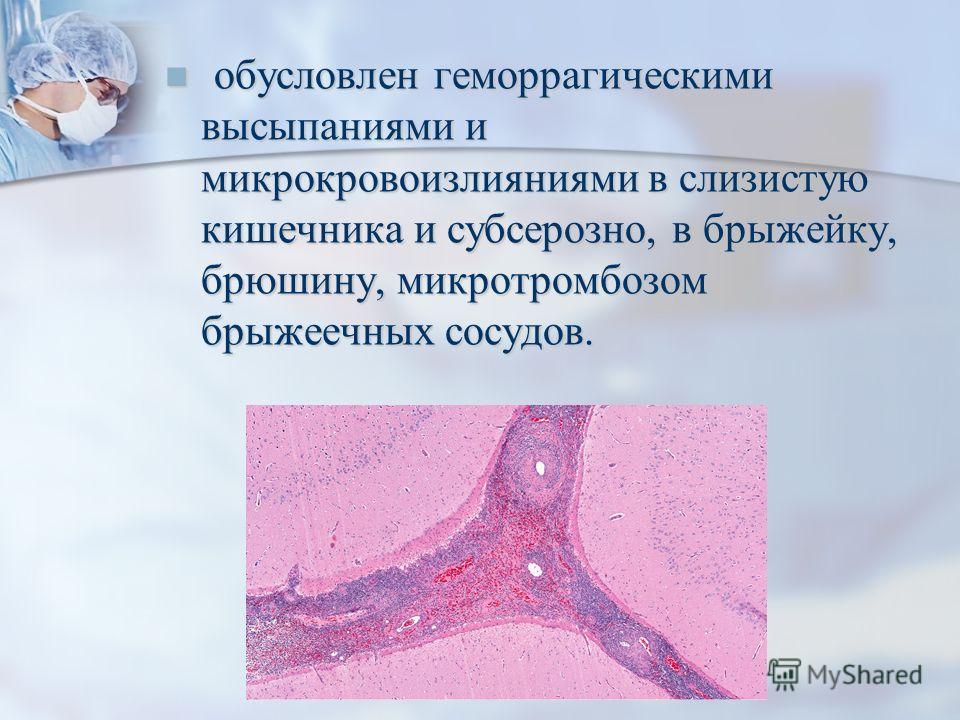 Вышеуказанные жалобы беспокоят в течение суток. За медицинской помощью не обращалась. Самостоятельно не лечилась.
Вышеуказанные жалобы беспокоят в течение суток. За медицинской помощью не обращалась. Самостоятельно не лечилась.
В анамнезе у пациентки рецидивирующий цистит в течение трех лет. Обострения возникали трижды за последние 6 месяцев. Лечение и обследование проходила амбулаторно у уролога. В общеклиническом анализе мочи определялись лейкоциты до 10 в поле зрения, эритроциты до 2 в поле зрения. Все бактериологические посевы мочи были стерильны. Проводились курсы антибактериальной терапии (Фосфомицином, Фторхинолонами, Нитрофуранами), противовоспалительная терапия (Диклофенак) с незначительным временным эффектом. При этом жжение в области уретры сохранялось. По данным гинекологического анамнеза: менструация с 13 лет, регулярные, обильные, болезненные. Беременности и гинекологические заболевания у пациентки отсутствуют. Половая жизнь с 18 лет. Контрацепция барьерная. Половой жизнью не живет последние 6 месяцев, в связи с диспареунией.
При обследовании в приемном отделении в общем анализе мочи эритроциты покрывают все поля зрения. По данным ультразвукового исследования (УЗИ) мочевыделительной системы конкрементов, объемных образований, нарушения уродинамики не выявлено. Мочевой пузырь с четким ровным контуром, без пристеночных образований. Остаточной мочи нет. Теней подозрительных на конкременты при обзорной урографии не выявлено. При поступлении в приемном отделении осмотрена гинекологом: данных за острую гинекологическую патологию на момент осмотра нет.
По данным ультразвукового исследования (УЗИ) мочевыделительной системы конкрементов, объемных образований, нарушения уродинамики не выявлено. Мочевой пузырь с четким ровным контуром, без пристеночных образований. Остаточной мочи нет. Теней подозрительных на конкременты при обзорной урографии не выявлено. При поступлении в приемном отделении осмотрена гинекологом: данных за острую гинекологическую патологию на момент осмотра нет.
Пациентка госпитализирована в урологическое отделение ГБУЗ ГКБ им. С.П. Боткина ДЗМ с предварительным диагнозом: острый геморрагический цистит. В отделении взята моча на бактериологический посев и цитологическое исследование с определением атипичных клеток. Назначена антибактериальная (Ципрофлоксацин), гемостатическая (Этамзилат), противовоспалительная (Диклофенак) терапия. На 3-е сутки госпитализации отмечалась положительная динамика в виде купирования гематурии и уменьшения дизурических явлений. Результат бактериалогического анализа мочи – рост микрофлоры не выявлен, во всех трех порциях мочи атипичные клетки не определяются.
В связи с сохраняющимся дискомфортом в области уретры пациентка осмотрена на гинекологическом кресле. При осмотре в области наружных половых губ определяются характерные для герпеса множественные везикулезные элементы полициклической фестончатой формы с прозрачным содержимым.
Подробный сбор анамнеза позволил выяснить, что лабиальный герпес пациентку беспокоит на протяжении трех лет, за последние 6 месяцев рецидивы герпеса участились. Лечилась самостоятельно Ацикловиром местно.
Пациентка выписана с заключительным клиническим диагнозом: Острый геморрагический цистит. Генитальный герпес. Даны рекомендации по дальнейшему обследованию. Амбулаторно выполнен урогенитальный мазок из трех локусов (уретра, цервикальный канал, влагалище). Качественный ПЦР анализ в режиме реального времени соскоба слизистой уретры выявил ВПГ 2 типа. Иммуноферментный анализ (ELISA) показал повышение титра антител (ВПГ 1 IgG – 144,3; ВПГ 2 IgG – 130,5). ПЦР мочи в режиме реального времени выявил ВПГ 1 и 2 типа (HSV 1,2 – 8,6×102).
Пациентка направлена в герпетический центр, где подтвержден ранее установленный диагноз: генитальный герпес. Назначена противовирусная терапия: Валацикловир в дозировке 500 мг 2 раза в сутки в течение 5 дней, затем поддерживающая терапия 500 мг 1 раз в день в течение 3 мес.
Через 2 недели в плановом порядке выполнена цистоскопия с щипковой биопсией. При осмотре наружных половых органов везикулярные высыпания имели остаточные следы. Цистоскопическая картина имела характерные особенности слизистой. В области устьев и мочепузырного треугольника определялись белесоватые бляшки, несколько похожие на изменения слизистой при лейкоплакии.
При морфологическом исследовании биоптатов стенки мочевого пузыря, взятых при щипковой биопсии, выявлено наличие койлоцитоза и изменения клеток по типу «тутовой ягоды» как патогномоничного признака герпесвирсной инфекции.
В дальнейшем при наблюдении в течение года пациентка не отмечала рецидивов герпесвирусной инфекции и циститов. Продолжительное отсутствие дизурии, диспареунии и жжения в области уретры улучшило качество жизни, позволило вернуться к половой жизни и родить здорового ребенка.
После дообследования и подтверждения вирусной природы заболевания всем пациенткам проводилась противовирусная терапия, которая при рецидиве заболевания продолжалась в режиме супрессивной от 3 до 6 месяцев. Если вирусная инфекция являлась ко-фактором развития воспалительных и дисбиотических заболеваний урогенитального тракта, то в таком случае при обострении заболевания терапия начиналась с симптоматического лечения – применения препарата, оказывающего местный анальгетический эффект и облегчающего симптомы дизурии, затем согласно рекомендациям по лечению острого цистита – применение фосфомицина трометамола или препаратов нитрофуранового ряда. При сочетании с воспалительными гинекологическими заболеваниями применялась местная антимикробная терапия. При известном бактериальном возбудителе, антимикробная терапия назначалась согласно посеву мочи. Применение указанного алгоритма диагностики и лечения рецидвивирующей инфекции нижних мочевых путей у женщин позволило установить вирусную природу заболевания, а также увеличить безрецидивный период от 6 до 12 месяцев, улучшить качество жизни пациенток, избавив их от симптомов уретрита, диспареунии, а самое главное, исключить опухоль мочевого пузыря, как причину макрогематурии, т. е. способствовало решению социальной и демографической проблемы.
е. способствовало решению социальной и демографической проблемы.
ОБСУЖДЕНИЕ
В клинической практике мы все чаще сталкиваемся с обращением больных по поводу неоднократных рецидивов цистита, у которых применение антибактериальных препаратов приводит к временному улучшению или не помогает совсем. В отличие от типичных для бактериального цистита предрасполагающих факторов, таких как половой акт, переохлаждение, у этой категории больных обострение чаще всего возникает на фоне стрессовых ситуаций, после смены климата, и часто сопровождается макрогематурией. Вирусными циститами и/или уретритами чаще всего страдают преимущественно женщины молодого возраста с различными сопутствующими воспалительными заболеваниями и имеющие проблемы с иммунитетом. Кроме того, симптомы уретрита присутствуют и в межрецидивный период. Неоднократные, часто необоснованные, курсы антибактериальной терапии способствуют развитию дисбиозов влагалища, дисбактериозов, что также усугубляет выраженность проблемы. Наличие диспареунии заставляет пациенток отказываться от половой жизни, что делает проблему не только медицинской, но и социальной, т.к. приводит к нарушению деторождения.
Наличие диспареунии заставляет пациенток отказываться от половой жизни, что делает проблему не только медицинской, но и социальной, т.к. приводит к нарушению деторождения.
На сегодняшний день данные о роли вирусов в развитии урологических заболеваний крайне разрознены, мозаичны и не систематизированы [5]. Присутствие койлоцитов при морфологическом исследовании, как проявление папилломавирусной инфекции, является наиболее достоверным признаком вирусного поражения стенки мочевого пузыря как по нашим данным, так и поданным литературы [3-5]. Что касается герпес-вирусных инфекций, то по данным российских исследователей ДНК ВПГ 1 типа выявлен в моче и биоптатах мочевого пузыря в 7,1% случаев у пациентов, страдающих хроническим циститом [15-16]. А. Ito и соавт. указывают на этиологическую роль ВПГ 2 типа в развитии негонококкового уретрита у мужчин без видимых герпетических высыпаний [17]. По данным литературы, бессимптомное течение генитального герпеса зарегистрировано в 20% случаев, а в 60% – атипичное [18, 19].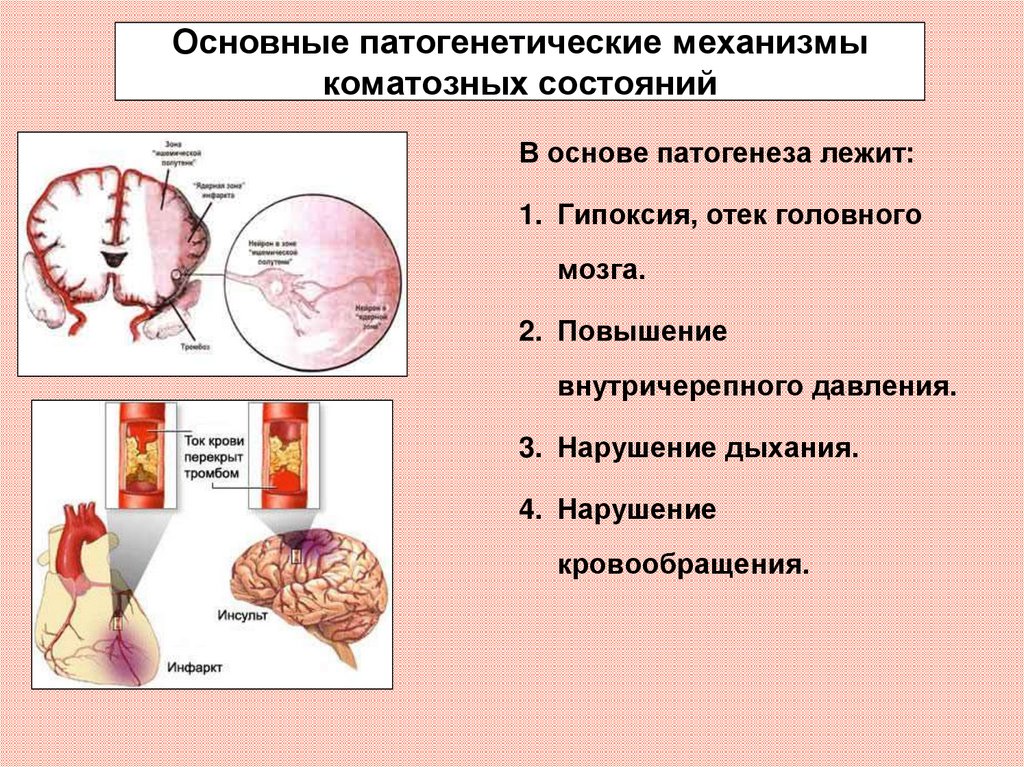 В нашем исследовании у трети больных выявлена латентная вирусная инфекция, в большинстве случаев имела место микст-инфекция (ВПГ 1 и 2 типов, ЦМВ, ВЭБ), в связи с чем применение традиционной антимикробной терапии является неэффективным методом лечения.
В нашем исследовании у трети больных выявлена латентная вирусная инфекция, в большинстве случаев имела место микст-инфекция (ВПГ 1 и 2 типов, ЦМВ, ВЭБ), в связи с чем применение традиционной антимикробной терапии является неэффективным методом лечения.
Следует отметить, что герпес-вирусные инфекции являются медико-социально проблемой и требуют комплексного подхода к лечению этой категории больных, так как герпетические инфекции влияют на репродуктивное здоровье как женщин, так и мужчин. В заключении ключевых экспертов по итогам междициплинарного научного заседания на тему: «Диагностика, лечение, профилактика вирус-ассоциированных заболеваний: пути решения» (Сочи, 9 сентября 2019 года) под председательством член-корр. РАН, д.м.н., проф., В.Е. Радзинского отмечено, что установлена роль вирусных инфекций (ВПЧ, ВПГ, ЦМВ) в «безвозвратных» репродуктивных потерях; риск вирусных заболеваний (ВПЧ, ВПГ, ЦМВ) выше у лиц с недостаточностью противоинфекционной защиты; вирусные инфекции (ВПЧ, ВПГ, ЦМВ) ускользают от врожденного иммунного ответа хозяина, в частности подавляя продукцию интерферона и. т.д.[20].
т.д.[20].
ВЫВОДЫ
Таким образом, цистит вирусной этиологии в настоящее время представляет собой реальность, что подтверждается данными литературы. С учетом частоты рецидивов и неэффективности традиционной терапии тщательное обследование больных должно включать в себя не только посев мочи и обследование на инфекции, передающиеся половым путем, но и применение методов, позволяющих исключить или подтвердить вирусную природу заболевания.
ЛИТЕРАТУРА
- Палагин И.С., Сухорукова М.В., Дехнич А.В., Эйдельштейн М.В., Перепанова Т.С., Козлов Р.С. и исследовательская группа «ДАРМИС-2018». Антибиотикорезистентность возбудителей внебольничных инфекций мочевых путей в России: результаты многоцентрового исследования «ДАРМИС2018». Клиническая и антимикробная терапия 2019;21(2):134-146. [Palagin I.S., Sukhorukova M.V., Dekhnich A.V., Edelstein M.V., Perepanova T.S., Kozlov R.S. and «DARMIS-2018» Study Group* Antimicrobial resistance of pathogens causing community-acquired urinary tract infections in Russia: results of multicenter study «DARMIS-2018».
 Klinicheskaya i antimikrobnaya terapiya = Clinical and Antimicrobial Therapy 2019;21(2):134-146. (In Russian)]. https://doi.org/10.36488/cmac.2019.2.134-146.
Klinicheskaya i antimikrobnaya terapiya = Clinical and Antimicrobial Therapy 2019;21(2):134-146. (In Russian)]. https://doi.org/10.36488/cmac.2019.2.134-146. - Перепанова Т.С., Козлов Р.С., Руднов В.А., Синякова Л.А. и соавт. Федеральные кинические рекомендации «Антимикробная терапия и профилактика инфекции почек, мочевыводящих путей и мужских половых органов». М:2020; с. 150. [Perepanova T.S., Kozlov R.S., Rudnov V.A., Sinyakova L.A. Federal clinical recommendations “Antimicrobial therapy and prevention of infections of the kidneys, urinary tract and male genital organs.” – M: 2020. P. 150. (In Russian)].
- Лоран О.Б., Синякова Л.А., Незовибатько Я.И. Геморрагический цистит у женщин: эпидемиология, этиология, патогенез, диагностика. Consillium Medicum 2017;19(7):50-55 [Loran O.B., Sinyakova L.A., Nezovibatko Ya.I. Hemorrhagic cystitis in women: epidemiology, etiology, pathogenesis, diagnosis. Consillium Medicum 2017;19(7):50-55. (In Russian)].
- Ибишев Х.С., Крахоткин Д.
 В., Васильев А.А., Крайний П.А. Рецидивирующая инфекция нижних мочевых путей вирусной этиологии. Вестник урологии 2017;5(1):26-31. [Ibishev Kh.S., Krahotkin D.V., Vasiliev A.A., Krayniy P.A. Recurrent infection of the lower urinary tract of viral etiology. Urology Herald = Vestnik urologii 2017;5(1):26-31. (In Russian)].
В., Васильев А.А., Крайний П.А. Рецидивирующая инфекция нижних мочевых путей вирусной этиологии. Вестник урологии 2017;5(1):26-31. [Ibishev Kh.S., Krahotkin D.V., Vasiliev A.A., Krayniy P.A. Recurrent infection of the lower urinary tract of viral etiology. Urology Herald = Vestnik urologii 2017;5(1):26-31. (In Russian)]. - Крахоткин Д.В., Иванов С.Н., Набока Ю.Л., Коган М.И., Гудима И.А., Ильяш А.В. и соавт. Вирусные патогены при урологических заболеваниях. Медицинский вестник юга России 2018;9(4):14-21. [Krahotkin D.V., Ivanov S.N., Naboka Yu.L., Kogan M.I., Gudima I.A., Ilyash A.V. et al. Viral pathogens in urological diseases. Medical Bulletin of the South of Russia = Meditsinskiy vestnik yuga Rossii 2018;9(4):14-21. (In Russian)].
- Молочков В.А., Семенова Т.Б., Киселев В.И., Молочков А.В. Генитальные вирусные инфекции. М.: «Издательство БИНОМ», 2009. 208 с. [Molochkov V.A., Semenova T.B., Kiselev V.I., Molochkov A.V. Genital viral infections. M.: “Publishing house BINOM” 2009.
 208 s. (In Russian)].
208 s. (In Russian)]. - Atilla E, Yalciner M, Atilla PA, Ates C, Bozdag SC, Yuksel MK, et al. Is cytomegalovirus a risk factor for haemorrhagic cystitis in allogeneic haematopoietic stem cell transplantation recipients? Antivir Ther 2018;23(8):647-653. https://doi.org/10.3851/IMP3252.
- Badawi H, Ahmed H, Aboul Fadl L, Helmi A, Fam N, Diab M, et. al. Herpes simplex virus type‐2 in Egyptian patients with bladder cancer or cystitis. APMIS 2010;118(1):37-44. https://doi.org/10.1111/j.1600-0463.2009.02556.x.
- Мелехина Е.В., Чугунова О.Л., Филиппов А.В. К вопросу о роли вирусов в формировании хронических инфекций органов мочевой системы. Российский медицинский журнал 2013;2:27-30. [Melekhina E.V., Chugunova O.L., Filippov A.V. On the role of viruses in the formation of chronic infections of the urinary tract system. Rossiyskiy meditsinskiy zhurnal=Russian Medical Journal 2013;2:27-30. (In Russian)].
- Gourinat AC, O’Connor O, Calvez E, Goarant C, Dupont-Rouzeyrol M.
 Detection of Zika virus in urine. Emerg Infect Dis 2015;21(1):84–86. https://doi.org/10.3201/eid2101.140894.
Detection of Zika virus in urine. Emerg Infect Dis 2015;21(1):84–86. https://doi.org/10.3201/eid2101.140894. - Исаков В.А., Архипова Е.И., Исаков Д.В. Герпесвирусные инфекции человека. Руководство для врачей. Спб:. СпецЛит, 2013. 2-е изд., перераб. и доп. 670 с. [Isakov V.A., Arkhipova E.I., Isakov D.V. Herpesvirus infection. A guide for physicians. SPb:. Spetslit, 2013. 2-e Izd., the reslave. 670 р. (In Russian)].
- Исаков В.А., Архипова Е.И., Исаков Д.В. Герпесвирусные инфекции человека. Руководство для врачей. Спб.: СпецЛит, 2006. 303 c. [Isakov V.A., Arkhipova E.I., Isakov D.V. Human Herpesvirus infections. A guidelines for physicians. St. Petersburg:Spec.lit,2006. 303 р. (In Russian)].
- Деревянко Т.И., Рыжков В.В. Вирусные инфекции: вирус папилломы человека и генитальный герпес 1 и 2 типов как причина хронического рецидивирующего цистита с выраженным дизурическим синдромом у женщин с гипоспадией и гипермобильностью уретры. Урология 2015;4:29-33. [Derevyanko T.
 I., Ryzhkov V.V. Viral infections: human papillomavirus and genital herpes types 1 and 2 as a cause of chronic recurrent cystitis with severe dysuric syndrome in women with hypospadias and hypermobility of the urethra. Urology= Urologiya 2015;4:29-33. (In Russian)].
I., Ryzhkov V.V. Viral infections: human papillomavirus and genital herpes types 1 and 2 as a cause of chronic recurrent cystitis with severe dysuric syndrome in women with hypospadias and hypermobility of the urethra. Urology= Urologiya 2015;4:29-33. (In Russian)]. - Кондратенко И.В. Блогов А.А. Первичные иммунодефициты. — М.: Изд МЕДПРАКТИКА-М, 2005. 232 с.[ Kondratenko V.I. Blogov A. Primary immunodeficiencies. M.: Publishing house of medical practice-M, 2005. P. 232. (In Russian)].
- Набока Ю.Л., Ильяш А.В., Крахоткин Д.В. Вирусо-бактериальные ассоциации, верифицированные в моче здоровых людей (пилотное исследование). Вестник урологии 2018;6(3):44-49. [Naboka Yu.L., Ilyash A.V., Krahotkin D.V. Viral-bacterial associations verified in the urine of healthy people (pilot study). Vestnik urologii = Bulletin of urology 2018;6(3):44-49. (In Russian)]. https://doi.org/10.21886/2308-6424-2018-6-3-44-49.
- Набока Ю.Л., Гудима И.А., Коган М.И., Ибишев Х.С., Черницкая М.
 Л. Микробный спектр мочи и биоптатов мочевого пузыря у женщин с хроническим рецидивирующим циститом. Урология 2013;4:16-18. [Naboka Y.L., Gudima I.A., Kogan M.I., Ibishev H.S., Chernitskaya M.L. Microbial spectrum of urine and bladder biopsies in women with chronic recurrent cystitis. Urologiya = Urology 2013;4:16-18. (In Russian)].
Л. Микробный спектр мочи и биоптатов мочевого пузыря у женщин с хроническим рецидивирующим циститом. Урология 2013;4:16-18. [Naboka Y.L., Gudima I.A., Kogan M.I., Ibishev H.S., Chernitskaya M.L. Microbial spectrum of urine and bladder biopsies in women with chronic recurrent cystitis. Urologiya = Urology 2013;4:16-18. (In Russian)]. - Ito S, Yasuda M, Kondo H, Yamada Y, Nakane K, Mizutani K, et al. Clinical courses of herpes simplex virus-induced urethritis in men. J Infect Chemother 2017;23(10):717-719. https://doi.org/10.1016/j.jiac.2017.03.017
- Ashley RL, Wald A. Genital Herpes: Review of the Epidemic and Potential use of type-specific serology. Clinical microbiology reviews, Jan.1999. P.1-8.
- РОДВК – «Федеральные клинические рекомендации по ведению больных опоясывающим герпесом»; Москва, 2015. [Federal clinical guidelines for the management of patients with herpes zoster”; Moscow, 2015. (In Russian)].
- Хрянин А.А. В поисках интерферона. Status Praesens (гинекология, акушерство, бесплодный брак) 2020;1:79-83.
 [Khryanin A. A. In search of the interferon. Status Praesens (gynecology, obstetrics, infertile marriage) 2020;1:79-83. (In Russian)].
[Khryanin A. A. In search of the interferon. Status Praesens (gynecology, obstetrics, infertile marriage) 2020;1:79-83. (In Russian)].
| Прикрепленный файл | Размер |
|---|---|
| Скачать статью | 2.49 Мб |
‹ Варианты оценки почечной функции после органосохраняющих операций у пациентов с почечно-клеточным раком
Вверх
Гольмиевая лазерная энуклеация предстательной железы – новый «золотой стандарт» хирургического лечения ДГПЖ в г. Москве ›
Ключевые слова:
рецидивирующая инфекция нижних мочевых путей; геморрагический цистит; вирус Эпштейна-Барр; цитомегаловирус; вирус папилломы человека высокого онкогенного риска; вирусы простого герпеса 1 и 2 типов
Отчет о передовом опыте Канадской ассоциации урологов: детский геморрагический цистит
1. Gorczynska E, Turkiewicz D, Rybka K, et al. Заболеваемость, клинический исход и лечение вирус-индуцированного геморрагического цистита у детей и подростков после аллогенной трансплантации гемопоэтических клеток. Трансплантация костного мозга Биол. 2005; 11: 797–804. doi: 10.1016/j.bbmt.2005.06.007. [PubMed] [CrossRef] [Google Scholar]
Трансплантация костного мозга Биол. 2005; 11: 797–804. doi: 10.1016/j.bbmt.2005.06.007. [PubMed] [CrossRef] [Google Scholar]
2. Droller MJ, Saral R, Santos G. Профилактика геморрагического цистита, вызванного циклофосфамидом. Урология. 1982;20:256–258. doi: 10.1016/0090-4295(82)90633-1. [PubMed] [CrossRef] [Google Scholar]
3. Артур Р.Р., Шах К.В., Бауст С.Дж. и соавт. Ассоциация ВК-вирурии с геморрагическим циститом у реципиентов трансплантатов костного мозга. N Engl J Med. 1986; 315: 230–4. doi: 10.1056/NEJM198607243150405. [PubMed] [CrossRef] [Google Scholar]
4. DHHS, NIH и NCI: общие терминологические критерии нежелательных явлений (CTCAE), версия 4.03. 2010. [По состоянию на 7 декабря 2018 г.]. п. 148. Доступно по адресу: https://www.eortc.be/services/doc/ctc/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf.
5. Giraud G, Bogdanovic G, Priftakis P, et al. Частота геморрагического цистита и ВК-вирурии у реципиентов аллогенных гемопоэтических стволовых клеток в зависимости от интенсивности режима кондиционирования. Трансплантация стволовых клеток. 2006; 91:401–4. [PubMed] [Google Scholar]
Трансплантация стволовых клеток. 2006; 91:401–4. [PubMed] [Google Scholar]
6. Декер Д.Б., Карам Дж.А., Уилкокс Д.Т. Детский геморрагический цистит. J Педиатр Урол. 2009; 5: 254–64. doi: 10.1016/j.jpurol.2009.02.199. [PubMed] [CrossRef] [Google Scholar]
7. Hudson RG, Cain MP. Рисперидон-ассоциированный геморрагический цистит. Дж Урол. 1998;160:159. doi: 10.1016/S0022-5347(01)63077-5. [PubMed] [CrossRef] [Google Scholar]
8. Cohen JM, Cuckow P, Davies EG. Телеангиэктазия стенки мочевого пузыря, вызывающая опасную для жизни гематурию при атаксиателангиэктазии: новое наблюдение. Акта Педиатр. 2008; 97: 667–9. doi: 10.1111/j.1651-2227.2008.00736.x. [PubMed] [CrossRef] [Google Scholar]
9. Christmann M, Heitkamp S, Lambrecht E, et al. Геморрагический цистит и полиомавирусная инфекция JC при атаксии телеангиэктазии. J Педиатр Урол. 2009 г.;5:324–6. doi: 10.1016/j.jpurol.2009.02.198. [PubMed] [CrossRef] [Google Scholar]
10. Çipe FE, Soygür T, Doĝu F, et al. Геморрагический цистит с поздним началом у реципиента гемопоэтических стволовых клеток: лечение внутрипузырной гиалуроновой кислотой. Педиатр трансплантат. 2010; 14:79–82. doi: 10.1111/j.1399-3046.2009.01169.x. [PubMed] [CrossRef] [Google Scholar]
Геморрагический цистит с поздним началом у реципиента гемопоэтических стволовых клеток: лечение внутрипузырной гиалуроновой кислотой. Педиатр трансплантат. 2010; 14:79–82. doi: 10.1111/j.1399-3046.2009.01169.x. [PubMed] [CrossRef] [Google Scholar]
11. Jiang Q, Huang H, Liu Q, et al. Непрерывная внутривенная инфузия MESNA может предотвратить геморрагический цистит при ТГСК и сохранить концентрацию MESNA в моче. Пересадка костного мозга. 2015;50:1490–2. doi: 10.1038/bmt.2015.197. [PubMed] [CrossRef] [Google Scholar]
12. Saito Y, Kumamoto T, Makino Y, et al. Ретроспективное исследование лечения и профилактики геморрагического цистита, индуцированного ифосфамидом, у детей, подростков и молодых взрослых (AYA) с солидными опухолями. Jpn J Clin Oncol. 2016; 46: 856–61. doi: 10.1093/jjco/hyw093. [PubMed] [CrossRef] [Google Scholar]
13. Yamamoto R, Kusumi E, Kami M, et al. Поздний геморрагический цистит после трансплантации гемопоэтических стволовых клеток сниженной интенсивности (RIST) Трансплантация костного мозга. 2003;32:1089–95. doi: 10.1038/sj.bmt.1704261. [PubMed] [CrossRef] [Google Scholar]
2003;32:1089–95. doi: 10.1038/sj.bmt.1704261. [PubMed] [CrossRef] [Google Scholar]
14. Bielorai B, Shulman LM, Rechavi G, et al. Реактивация ЦМВ индуцировала геморрагический цистит с поздним началом, ассоциированный с вирусом ВК, после трансплантации стволовых клеток периферической крови. Пересадка костного мозга. 2001; 28: 613–4. doi: 10.1038/sj.bmt.1703187. [PubMed] [CrossRef] [Google Scholar]
15. Comar M, D’Agaro P, Andolina M, et al. Геморрагический цистит у детей, перенесших трансплантацию костного мозга: предполагаемая роль обезьяньего вируса 40. Трансплантация. 2004; 78: 544–8. дои: 10.1097/01.ТП.0000136257.02830.29. [PubMed] [CrossRef] [Google Scholar]
16. Shah K. Fields Virology. 3-е изд. Филадельфия: Липинкотт-Рэйвен; 1996. Полиомавирусы. [Google Scholar]
17. Barrak Al, Al M, Fawaz Al, Al T, Al Shehri M, et al. Тяжелый геморрагический цистит, вызванный вирусом BK, у пациентов с нетрансплантационной онкологией: серия случаев. J Pediatr Infect Dis. 2014;9:183–187. doi: 10.3233/JPI-140435. [CrossRef] [Google Scholar]
2014;9:183–187. doi: 10.3233/JPI-140435. [CrossRef] [Google Scholar]
18. Богданович Г., Прифтакис П., Жиро Г. и соавт. Ассоциация между высокой вирусной нагрузкой ВК в образцах мочи пациентов с реакцией «трансплантат против хозяина» и развитием геморрагического цистита после трансплантации гемопоэтических стволовых клеток. Дж. Клин Микробиол. 2004;42:5394–6. doi: 10.1128/JCM.42.11.5394-5396.2004. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
19. Cesaro S, Tridello G, Pillon M, et al. Проспективное исследование прогностической ценности нагрузки ДНК вируса BK в плазме для геморрагического цистита у педиатрических пациентов после трансплантации стволовых клеток. J Pediatric Infect Dis Soc. 2015;4:134–42. doi: 10.1093/jpids/piu043. [PubMed] [CrossRef] [Google Scholar]
20. Bil-Lula I, Ussowicz M, Rybka B, et al. Гематурия вследствие аденовирусной инфекции у реципиентов трансплантата костного мозга. Пересадка Proc. 2010;42:3729–34. doi: 10.1016/j.transproceed. 2010.08.049. [PubMed] [CrossRef] [Google Scholar]
2010.08.049. [PubMed] [CrossRef] [Google Scholar]
21. Riachy E, Krauel L, Rich BS, et al. Факторы риска и предикторы степени тяжести и осложнений детского геморрагического цистита. Дж Урол. 2014; 191:186–92. doi: 10.1016/j.juro.2013.08.007. [PubMed] [CrossRef] [Google Scholar]
22. Anoop P, Shaw BE, Riley U, et al. Клинический профиль и исход уротелиотропного вирусного геморрагического цистита после трансплантации гемопоэтических стволовых клеток: 7-летний третичный центральный анализ. Гематология. 2011;16:213–20. дои: 10.1179/102453311X13025568941763. [PubMed] [CrossRef] [Google Scholar]
23. Johnston D, Schurtz E, Tourville E, et al. Факторы риска, связанные с тяжестью и исходами у детей с геморрагическим циститом. Дж Урол. 2016; 195:1312–7. doi: 10.1016/j.juro.2015.11.035. [PubMed] [CrossRef] [Google Scholar]
24. Cheuk DKL, Lee TL, Chiang AKS, et al. Факторы риска и лечение геморрагического цистита у детей, перенесших трансплантацию гемопоэтических стволовых клеток. Транспл Интерн. 2006; 20:73–81. doi: 10.1111/j.1432-2277.2006.00404.x. [PubMed] [CrossRef] [Академия Google]
Транспл Интерн. 2006; 20:73–81. doi: 10.1111/j.1432-2277.2006.00404.x. [PubMed] [CrossRef] [Академия Google]
25. Гандер Р., Асенсио М., Гильен Г. и др. Геморрагический цистит после трансплантации гемопоэтических стволовых клеток: задача детского уролога. J Педиатр Урол. 2018;14:366–73. doi: 10.1016/j.jpurol.2018.03.018. [PubMed] [CrossRef] [Google Scholar]
26. McCarville MB, Hoffer FA, Gingrich JR, et al. Визуализирующие признаки геморрагического цистита у онкобольных детского возраста. Педиатр Радиол. 2000;30:131–138. doi: 10.1007/s002470050031. [PubMed] [CrossRef] [Академия Google]
27. Hadjibabaie M, Alimoghaddam K, Shamshiri AR, et al. Постоянное промывание мочевого пузыря предотвращает геморрагический цистит после аллогенной трансплантации гемопоэтических клеток. Урол Онкол. 2008; 26:43–6. doi: 10.1016/j.urolonc.2006.12.015. [PubMed] [CrossRef] [Google Scholar]
28. Harkensee C, Vasdev N, Gennery AR, et al. Профилактика и лечение геморрагического цистита, ассоциированного с BK-вирусом, у детей после трансплантации гемопоэтических стволовых клеток — систематический обзор и основанные на фактических данных рекомендации по клиническому лечению. Бр Дж Гематол. 2008; 142: 717–31. doi: 10.1111/j.1365-2141.2008.07254.x. [PubMed] [CrossRef] [Академия Google]
Бр Дж Гематол. 2008; 142: 717–31. doi: 10.1111/j.1365-2141.2008.07254.x. [PubMed] [CrossRef] [Академия Google]
29. Махавар Б., Махавар В., Джоаджодиа А. и др. Отличный ответ солифенацина при геморрагическом цистите, вызванном химиотерапией, у ребенка с неходжкинской лимфомой. Южноазиатский J Рак. 2018;7:213. doi: 10.4103/sajc.sajc_145_18. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
30. Cesaro S, Hirsch HH, Faraci M, et al. Цидофовир при геморрагическом цистите, ассоциированном с вирусом BK: ретроспективное исследование. Клин Инфекция Дис. 2009; 49: 233–40. дои: 10.1086/599829. [PubMed] [CrossRef] [Академия Google]
31. Faraci M, Zuzzubbo D, Lanino E, et al. Цидофовир в низких дозах без пробенецида для лечения геморрагического цистита, вызванного вирусом BK, после трансплантации гемопоэтических стволовых клеток. Pediatr Infect Dis J. 2009; 28:55–7. doi: 10.1097/INF.0b013e3181812cb9. [PubMed] [CrossRef] [Google Scholar]
32. Foster JH, Cheng WS, Nguyen NY, et al. Внутрипузырный цидофовир при ВК геморрагическом цистите у детей после трансплантации гемопоэтических стволовых клеток. Педиатр трансплантат. 2018; 22 doi: 10.1111/petr.13141. [PubMed] [CrossRef] [Академия Google]
Внутрипузырный цидофовир при ВК геморрагическом цистите у детей после трансплантации гемопоэтических стволовых клеток. Педиатр трансплантат. 2018; 22 doi: 10.1111/petr.13141. [PubMed] [CrossRef] [Академия Google]
33. Wu KH, Weng T, Wu HP, et al. Эффективное лечение лефлуномидом тяжелого геморрагического цистита, ассоциированного с вирусом ВК, у детей после трансплантации гемопоэтических стволовых клеток: пилотное исследование. Pediatr Infect Dis J. 2014;33:1193–5. doi: 10.1097/INF.0000000000000407. [PubMed] [CrossRef] [Google Scholar]
34. Miyamura K, Hamaguchi M, Taji H, et al. Успешная терапия рибавирином тяжелого аденовирусного геморрагического цистита после аллогенной трансплантации костного мозга от близких доноров HLA, а не от отдаленных доноров. Пересадка костного мозга. 2000; 25: 545–8. doi: 10.1038/sj.bmt.1702195. [PubMed] [CrossRef] [Google Scholar]
35. Duthie G, Whyte L, Chandran H, et al. Введение полисульфата пентозана натрия и отказ от катетеризации уретры: улучшение результатов у детей с геморрагическим циститом после трансплантации стволовых клеток/химиотерапии. J Pediatr Surg. 2012;47:375–9. doi: 10.1016/j.jpedsurg.2011.11.037. [PubMed] [CrossRef] [Google Scholar]
J Pediatr Surg. 2012;47:375–9. doi: 10.1016/j.jpedsurg.2011.11.037. [PubMed] [CrossRef] [Google Scholar]
36. Ashcroft G, Dodsworth J, van Boxtel E, et al. Эстроген ускоряет заживление кожных ран, связанное с повышением уровня TGF-бета1. Нат Мед. 1997;3:1209–15. doi: 10.1038/nm1197-1209. [PubMed] [CrossRef] [Google Scholar]
37. Deshpande R, Khalili H, Pergolizzi R, et al. Эстрадиол подавляет индуцированную ЛПС продукцию цитокинов и активацию NFkB в мышиных макрофагах. Am J Reprod Immunol. 1997; 38:46–54. doi: 10.1111/j.1600-0897.1997.tb00275.x. [PubMed] [CrossRef] [Google Scholar]
38. Heath JA, Mishra S, Mitchell S, et al. Эстроген для лечения геморрагического цистита у детей и подростков, перенесших трансплантацию костного мозга. Пересадка костного мозга. 2006; 37: 523–6. doi: 10.1038/sj.bmt.1705280. [PubMed] [CrossRef] [Академия Google]
39. Mousavi SA, Moazed V, Mohebbi N, et al. Конъюгированный эстроген при позднем геморрагическом цистите, связанном с трансплантацией гемопоэтических стволовых клеток. Int J Hematol Stem Cell Res. 2017;11:13–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Int J Hematol Stem Cell Res. 2017;11:13–8. [Бесплатная статья PMC] [PubMed] [Google Scholar]
40. Furness PD, Palmer LS, Palmer JS, et al. Гипербарическая оксигенация при геморрагическом цистите у детей. Дж Урол. 1999; 161:1596–1597. doi: 10.1016/S0022-5347(05)68989-6. [PubMed] [CrossRef] [Google Scholar]
41. Cesaro S, Brugiolo A, Faraci M, et al. Заболеваемость и лечение геморрагического цистита у детей после трансплантации гемопоэтических стволовых клеток: опрос итальянской ассоциации детской гематологии, онкологии и группы трансплантации костного мозга. Пересадка костного мозга. 2003;32:925–31. doi: 10.1038/sj.bmt.1704252. [PubMed] [CrossRef] [Google Scholar]
42. Zama D, Masetti R, Vendemini F, et al. Клиническая эффективность раннего лечения гипербарической оксигенотерапией тяжелого позднего геморрагического цистита после трансплантации гемопоэтических стволовых клеток у детей. Педиатр трансплантат. 2013;17:86–91. doi: 10.1111/petr.12031. [PubMed] [CrossRef] [Google Scholar]
43. Savva-Bordalo J, Pinho Vaz C, Sousa M, et al. Клиническая эффективность гипербарической оксигенации при ВК-вирус-ассоциированном геморрагическом цистите после аллогенной трансплантации костного мозга. Пересадка костного мозга. 2012;47:1095–8. doi: 10.1038/bmt.2011.228. [PubMed] [CrossRef] [Google Scholar]
Savva-Bordalo J, Pinho Vaz C, Sousa M, et al. Клиническая эффективность гипербарической оксигенации при ВК-вирус-ассоциированном геморрагическом цистите после аллогенной трансплантации костного мозга. Пересадка костного мозга. 2012;47:1095–8. doi: 10.1038/bmt.2011.228. [PubMed] [CrossRef] [Google Scholar]
44. Al-Seraihi A, Ayas M. Гипербарический кислород не следует использовать при лечении геморрагического цистита у пациентов с анемией Фанкони. Детский рак крови. 2007; 49: 854–6. doi: 10.1002/pbc.20692. [PubMed] [CrossRef] [Google Scholar]
45. Trigg ME, O’Reilly J, Rumelhart S, et al. Инстилляции простагландина Е1 в мочевой пузырь для лечения тяжелого геморрагического цистита. Дж Урол. 1990; 143:92–4. дои: 10.1016/S0022-5347(17)39875-0. [PubMed] [CrossRef] [Google Scholar]
46. Focosi D, Kast RE. Гиалуронат и рисперидон при геморрагическом цистите. Пересадка костного мозга. 2007;39:57. doi: 10.1038/sj.bmt.1705546. [PubMed] [CrossRef] [Google Scholar]
47. Miodosky M, Abdul-Hai A, Tsirigotis P, et al. Лечение геморрагического цистита после трансплантации гемопоэтических стволовых клеток внутрипузырным введением гиалуроновой кислоты. Пересадка костного мозга. 2006; 38: 507–11. doi: 10.1038/sj.bmt.1705474. [PubMed] [CrossRef] [Академия Google]
Miodosky M, Abdul-Hai A, Tsirigotis P, et al. Лечение геморрагического цистита после трансплантации гемопоэтических стволовых клеток внутрипузырным введением гиалуроновой кислоты. Пересадка костного мозга. 2006; 38: 507–11. doi: 10.1038/sj.bmt.1705474. [PubMed] [CrossRef] [Академия Google]
48. Чунг С., Уокден М., Кирби Р. Лечение трудноизлечимой гематурии. БЖУ Интерн. 2000; 86: 951–9. doi: 10.1046/j.1464-410x.2000.00900.x. [PubMed] [CrossRef] [Google Scholar]
49. Правин Б., Санкаранараян А., Вайдьянатан С. Сравнительное исследование внутрипузырной инстилляции 15(s) 15 Me альфа и квасцов при лечении стойкой гематурии пузырного происхождения. Int J Clin Pharmacol Ther. 1992; 30:7–12. [PubMed] [Google Scholar]
50. Bogris SL, Johal NS, Hussein I, et al. Безопасно ли использовать алюминий при лечении геморрагического цистита у детей ?: обсуждение случая интоксикации алюминием и обзор литературы. J Pediatr Hematol Oncol. 2009 г.;31:285–8. doi: 10.1097/MPH.0b013e31819b591c. [PubMed] [CrossRef] [Google Scholar]
[PubMed] [CrossRef] [Google Scholar]
51. Tirindelli MC, Flammia G, Sergi F, et al. Фибриновый клей при рефрактерном геморрагическом цистите после неродственной трансплантации костного мозга, пуповинной крови и гаплоидентичных гемопоэтических стволовых клеток. Переливание. 2009;49:170–5. doi: 10.1111/j.1537-2995.2008.01934.x. [PubMed] [CrossRef] [Google Scholar]
52. Tirindelli MC, Flammia GP, Bove P, et al. Терапия фибриновым клеем тяжелого геморрагического цистита после аллогенной трансплантации гемопоэтических стволовых клеток. Трансплантация костного мозга Биол. 2014;20:1612–7. doi: 10.1016/j.bbmt.2014.06.018. [PubMed] [CrossRef] [Академия Google]
53. Джозеф С.М., Боули Д.М., Питчер Г.Дж. Формалиновое лечение рефрактерного геморрагического цистита. J Педиатр Урол. 2005; 1: 365–7. doi: 10.1016/j.jpurol.2005.02.005. [PubMed] [CrossRef] [Google Scholar]
54. Fu L, Chen W, Wang H, et al. Лечение формалином рефрактерного геморрагического цистита при системной красной волчанке. Педиатр Нефрол. 1998; 12: 788–9. doi: 10.1007/s004670050549. [PubMed] [CrossRef] [Google Scholar]
Педиатр Нефрол. 1998; 12: 788–9. doi: 10.1007/s004670050549. [PubMed] [CrossRef] [Google Scholar]
55. Lukasewycz SJ, Smith AR, Rambachan A, et al. Неизлечимый геморрагический цистит после трансплантации гемопоэтических стволовых клеток – играет ли роль раннее отведение мочи у детей? Дж Урол. 2012; 188: 242–6. doi: 10.1016/j.juro.2012.03.020. [PubMed] [CrossRef] [Академия Google]
56. Гарсия-Гамес А., Бермудес Бенсеррей П., Брио-Санагустин С. и др. Эмболизация пузырных артерий при геморрагическом цистите у детей. Cardiovasc Intervent Radiol. 2016;39:1066–9. doi: 10.1007/s00270-016-1300-y. [PubMed] [CrossRef] [Google Scholar]
57. Han Y, Wu D, Sun A, et al. Селективная эмболизация внутренних подвздошных артерий для лечения тяжелого геморрагического цистита после СКТ кроветворения. Пересадка костного мозга. 2008;41:881–6. doi: 10.1038/bmt.2008.4. [PubMed] [CrossRef] [Академия Google]
58. Ritch CR, Poon SA, Sulis ML, et al. Кожная везикостомия для паллиативного лечения геморрагического цистита и задержки мочевого сгустка. Урология. 2010;76:166–8. doi: 10.1016/юрология.2010.02.008. [PubMed] [CrossRef] [Google Scholar]
Урология. 2010;76:166–8. doi: 10.1016/юрология.2010.02.008. [PubMed] [CrossRef] [Google Scholar]
59. Sèbe P, Garderet L, Traxer O, et al. Субтотальная цистэктомия с илеоцистопластикой при тяжелом геморрагическом цистите после трансплантации костного мозга. Урология. 2001; 57:168. doi: 10.1016/S0090-4295(00)00882-7. [PubMed] [CrossRef] [Академия Google]
60. Дортикос Э., Павон В., Хайме Дж. К. и др. Успешное применение эпидермального фактора роста для лечения геморрагического цистита после трансплантации костного мозга. Пересадка костного мозга. 2003; 31: 615–6. doi: 10.1038/sj.bmt.1703877. [PubMed] [CrossRef] [Google Scholar]
61. Bhaskaran S, Abu-Arja RF, Abusin G, et al. Рекомбинантный фактор роста кератиноцитов человека: успешное лечение тяжелого, рефрактерного геморрагического цистита после аллогенной трансплантации гемопоэтических клеток. Пересадка костного мозга. 2014;49: 1550–1. doi: 10.1038/bmt.2014.205. [PubMed] [CrossRef] [Google Scholar]
62. Baygan A, Aronsson-Kurttila W, Moretti G, et al. Безопасность и побочные эффекты использования децидуальных стромальных клеток, полученных из плаценты, при реакции «трансплантат против хозяина» и геморрагическом цистите. Фронт Иммунол. 2017; 8:1–10. doi: 10.3389/fimmu.2017.00795. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
Baygan A, Aronsson-Kurttila W, Moretti G, et al. Безопасность и побочные эффекты использования децидуальных стромальных клеток, полученных из плаценты, при реакции «трансплантат против хозяина» и геморрагическом цистите. Фронт Иммунол. 2017; 8:1–10. doi: 10.3389/fimmu.2017.00795. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]
63. Apiwattanakul N, Hongeng S, Anurathapan U, et al. Вирусспецифический Т-клеточный ответ при геморрагическом цистите после трансплантации гаплоидентичных донорских стволовых клеток. Transpl Infect Dis. 2017;19: 1–7. doi: 10.1111/tid.12775. [PubMed] [CrossRef] [Google Scholar]
Описание случая с обзором литературы и рекомендуемым алгоритмом лечения
1. Введение
Геморрагический цистит (ГЦ) — опасное для жизни осложнение после трансплантации костного мозга и постхимиотерапевтического лечения . ГХ вызывается токсическим действием метаболитов химиотерапевтических средств и/или вирусной инфекцией мочевыводящих путей, атакующей поверхность уротелия [1, 4]. Заболеваемость ГХ колеблется в пределах 34-60% [1, 2]; молодые пациенты и лица, перенесшие аллогенную трансплантацию костного мозга, более склонны к развитию ГХ. Последняя возникает в течение от недели до 4 месяцев от начала лечения. Для профилактики и лечения ГК используется несколько методов, но, несмотря на соответствующие профилактические меры, это разрушительное осложнение неизбежно у одной трети или более половины пациентов. При возникновении ГК предпочтительнее консервативное лечение, но при тяжелом не поддающемся лечению кровотечении может потребоваться хирургическое вмешательство. Несмотря на тщательную профилактику и лечение, ГХ имеет высокую летальность — до 4% [2, 5]. Постоянный катетер, вызывающий перфорацию мочевого пузыря, является редким, опасным для жизни осложнением [10]. Пациенты с HC страдают обширным воспалительным поражением стенки мочевого пузыря, а из-за кровотечения у них наблюдается задержка сгустков, спазм мочевого пузыря и постоянное промывание мочевого пузыря, что повышает внутрипузырное давление и может подвергать их опасности перфорации стенки мочевого пузыря [1].
Заболеваемость ГХ колеблется в пределах 34-60% [1, 2]; молодые пациенты и лица, перенесшие аллогенную трансплантацию костного мозга, более склонны к развитию ГХ. Последняя возникает в течение от недели до 4 месяцев от начала лечения. Для профилактики и лечения ГК используется несколько методов, но, несмотря на соответствующие профилактические меры, это разрушительное осложнение неизбежно у одной трети или более половины пациентов. При возникновении ГК предпочтительнее консервативное лечение, но при тяжелом не поддающемся лечению кровотечении может потребоваться хирургическое вмешательство. Несмотря на тщательную профилактику и лечение, ГХ имеет высокую летальность — до 4% [2, 5]. Постоянный катетер, вызывающий перфорацию мочевого пузыря, является редким, опасным для жизни осложнением [10]. Пациенты с HC страдают обширным воспалительным поражением стенки мочевого пузыря, а из-за кровотечения у них наблюдается задержка сгустков, спазм мочевого пузыря и постоянное промывание мочевого пузыря, что повышает внутрипузырное давление и может подвергать их опасности перфорации стенки мочевого пузыря [1]. , 3].
, 3].
Из-за преобладания высокодозной химиотерапии и трансплантации костного мозга распространенность HC увеличилась, и поэтому врачи должны знать об этом опасном для жизни осложнении и способах его предотвращения и лечения. Здесь мы представляем редкий случай перфорации мочевого пузыря у 14-летнего пациента мужского пола с HC вместе с кратким обзором литературы, а также предлагаемой схемой лечения.
2. История болезни
14-летний мальчик поступил в онкологическое отделение для проведения высокодозной химиотерапии, включающей циклофосфамид, перед аллогенной трансплантацией костного мозга для лечения Т-клеточной лимфомы. Пациент также получил Месну для снижения риска токсичности циклофосфамида. Следует подчеркнуть, что месна, сероорганическое соединение, подвергается концентрации в мочевом пузыре, где накапливается метаболит уротоксического циклофосфамида акролеин, тем самым образуя конъюгат с акролеином и другими уротоксическими метаболитами, тем самым предотвращая их токсичность для мочевого пузыря. Через неделю после трансплантации у больного развилась макрогематурия, а еще через сутки — задержка мочи. Консервативное лечение с прерывистой катетеризацией и инфузией жидкости оказалось неэффективным. В анализах крови выявлено повышение уровня креатинина сыворотки до 160 ммоль/л. УЗИ показало гидроуретеронефроз с большим тромбом в мочевом пузыре. Затем мочевой пузырь промывали вручную, и после эвакуации сгустков вводили двухпросветный катетер для непрерывной ирригации. После этого в анализах крови отмечена нормализация уровня креатинина сыворотки и разрешение гидроуретеронефороза. На следующий день у больного появился дискомфорт в животе, в связи с чем ирригация была немедленно прекращена, выполнены КТ и цистография (рис. 1) и диагностирована внутрибрюшинная перфорация мочевого пузыря. Затем была проведена диагностическая лапаротомия, в ходе которой была обнаружена небольшая перфорация на куполе мочевого пузыря, которая в основном была закрыта, и 22 Fr. Установлен надлобковый дренаж Malecot.
Через неделю после трансплантации у больного развилась макрогематурия, а еще через сутки — задержка мочи. Консервативное лечение с прерывистой катетеризацией и инфузией жидкости оказалось неэффективным. В анализах крови выявлено повышение уровня креатинина сыворотки до 160 ммоль/л. УЗИ показало гидроуретеронефроз с большим тромбом в мочевом пузыре. Затем мочевой пузырь промывали вручную, и после эвакуации сгустков вводили двухпросветный катетер для непрерывной ирригации. После этого в анализах крови отмечена нормализация уровня креатинина сыворотки и разрешение гидроуретеронефороза. На следующий день у больного появился дискомфорт в животе, в связи с чем ирригация была немедленно прекращена, выполнены КТ и цистография (рис. 1) и диагностирована внутрибрюшинная перфорация мочевого пузыря. Затем была проведена диагностическая лапаротомия, в ходе которой была обнаружена небольшая перфорация на куполе мочевого пузыря, которая в основном была закрыта, и 22 Fr. Установлен надлобковый дренаж Malecot. В связи с продолжающимся кровотечением мочевой пузырь осторожно промывали и через 5 дней после операции начали с ежедневной инстилляции 50 мл 0,5 мг простагландина Е1 в мочевой пузырь в течение 60 минут 1 раз в сутки в течение 7 дней [2]. Во время этого лечения моча постепенно очищалась, и на 14-й день после операции надлобковый катетер был удален после обычной цистографии.
В связи с продолжающимся кровотечением мочевой пузырь осторожно промывали и через 5 дней после операции начали с ежедневной инстилляции 50 мл 0,5 мг простагландина Е1 в мочевой пузырь в течение 60 минут 1 раз в сутки в течение 7 дней [2]. Во время этого лечения моча постепенно очищалась, и на 14-й день после операции надлобковый катетер был удален после обычной цистографии.
Рис. 1.
Сгусток мочевого пузыря. КТ показывает большой сгусток мочевого пузыря (С), занимающий большую часть просвета мочевого пузыря. толстая неровная стенка мочевого пузыря (BW). свободная перивезикальная жидкость (F).
3. Обсуждение
Здесь мы сообщаем о 14-летнем пациенте после трансплантации костного мозга с HC. Токсичность циклофосфамида и вирусная инфекция являются доминирующими дифференциальными диагнозами. Циклофосфамид метаболизируется в печени до акролеина, который затем выводится с мочой [5, 6, 7]. Акролеин, концентрирующийся в мочевом пузыре, способен проникать через слой гликозаминогликанов и непосредственно токсичен для уротелия [3, 5, 6, 7]. Тот факт, что ГЦ развивается у больных, не получавших циклофосфамид, а также у больных, адекватно получавших месну, привел к открытию вирусной инфекции мочевыводящих путей цитомегаловирусом (ЦМВ) и ВК-вирусами у больных с иммуносупрессией [4, 5]. Акролеин и вирусная инфекция вызывают отек стенки мочевого пузыря, утолщение стенки мочевого пузыря с выпячиванием слизистой оболочки в просвет, снижение емкости мочевого пузыря и сильное кровотечение.
Акролеин, концентрирующийся в мочевом пузыре, способен проникать через слой гликозаминогликанов и непосредственно токсичен для уротелия [3, 5, 6, 7]. Тот факт, что ГЦ развивается у больных, не получавших циклофосфамид, а также у больных, адекватно получавших месну, привел к открытию вирусной инфекции мочевыводящих путей цитомегаловирусом (ЦМВ) и ВК-вирусами у больных с иммуносупрессией [4, 5]. Акролеин и вирусная инфекция вызывают отек стенки мочевого пузыря, утолщение стенки мочевого пузыря с выпячиванием слизистой оболочки в просвет, снижение емкости мочевого пузыря и сильное кровотечение.
Профилактика ГК имеет решающее значение, и профилактические меры включают: гидратацию и диурез, поддержание диуреза в 2-3 раза выше нормы, использование для снижения концентрации акролеина в мочевыводящих путях и месны (натрий 2-меркаптоэтансульфонат) [5, 6 , 7]. Эта последняя молекула детоксифицирует акролеин, образуя водорастворимое нетоксичное инертное вещество, которое выводится с мочой. Месну назначают в половинной или равной дозе циклофосфамида [5, 6]. Несмотря на тщательную профилактику, у 7-23% больных ГЦ развивается, вероятно, вследствие вирусной инфекции мочевыводящих путей [4, 6, 7]. Появление HC требует немедленной реакции мультидисциплинарной команды, включающей уролога, онколога, гематолога и рентгенолога. Здесь мы предлагаем нашу пересмотренную схему лечения опасного для жизни HC (рис. 2). Рекомендуемые действия при развитии ГК:
Месну назначают в половинной или равной дозе циклофосфамида [5, 6]. Несмотря на тщательную профилактику, у 7-23% больных ГЦ развивается, вероятно, вследствие вирусной инфекции мочевыводящих путей [4, 6, 7]. Появление HC требует немедленной реакции мультидисциплинарной команды, включающей уролога, онколога, гематолога и рентгенолога. Здесь мы предлагаем нашу пересмотренную схему лечения опасного для жизни HC (рис. 2). Рекомендуемые действия при развитии ГК:
Рис. 2.
Алгоритм лечения геморрагического цистита.
Пациентов следует обследовать с помощью серийных анализов крови и при необходимости вводить продукты крови. Функцию почек следует тщательно контролировать по уровню креатинина в сыворотке и УЗИ [8, 9]. Для достижения хорошего диуреза пациент должен быть избыточно гидратирован, а при сердечных заболеваниях его следует ограничить. В случае сильного кровотечения, сгустков в собирательной системе или задержке и обструкции мы рекомендуем цистоскопию эвакуации, так как стенка мочевого пузыря отечна и рыхлая. Сгустки крови должны быть удалены из мочевого пузыря, чтобы остановить порочный круг свертывания крови и обструкции. Поскольку стенка мочевого пузыря отечна и воспалена токсичным метаболитом, а также вирусной инфекцией, эвакуация сгустка при цистоскопии намного безопаснее и предотвратит разрыв мочевого пузыря, как это произошло во время невизуализируемой эвакуации в нашем случае. Изолированный разрыв мочевого пузыря, связанный с катетером, может произойти редко, даже в невоспаленном мочевом пузыре, из-за задержки мочи с повышенным давлением в мочевом пузыре [10]. Пациенты с HC могут быть более склонны к разрыву мочевого пузыря из-за обширного воспалительного процесса стенки мочевого пузыря, рецидивирующей задержки сгустка и спазма мочевого пузыря, которые сильно повышают внутрипузырное давление и напряжение стенки мочевого пузыря. Непрерывное орошение мочевого пузыря также может способствовать повышению гидростатического давления в полости мочевого пузыря. Врачи должны знать об этой уникальной ситуации.
Сгустки крови должны быть удалены из мочевого пузыря, чтобы остановить порочный круг свертывания крови и обструкции. Поскольку стенка мочевого пузыря отечна и воспалена токсичным метаболитом, а также вирусной инфекцией, эвакуация сгустка при цистоскопии намного безопаснее и предотвратит разрыв мочевого пузыря, как это произошло во время невизуализируемой эвакуации в нашем случае. Изолированный разрыв мочевого пузыря, связанный с катетером, может произойти редко, даже в невоспаленном мочевом пузыре, из-за задержки мочи с повышенным давлением в мочевом пузыре [10]. Пациенты с HC могут быть более склонны к разрыву мочевого пузыря из-за обширного воспалительного процесса стенки мочевого пузыря, рецидивирующей задержки сгустка и спазма мочевого пузыря, которые сильно повышают внутрипузырное давление и напряжение стенки мочевого пузыря. Непрерывное орошение мочевого пузыря также может способствовать повышению гидростатического давления в полости мочевого пузыря. Врачи должны знать об этой уникальной ситуации. Следует предусмотреть ежедневный физикальный осмотр, точный учет ирригационных жидкостей и антихолинергическую терапию для подавления свободных сокращений. Перфорацию мочевого пузыря следует учитывать при дифференциальной диагностике пациентов с ГХ, жалующихся на дискомфорт в животе или острую боль в животе. Мы не рекомендуем пытаться искать источник кровотечения или использовать коагуляцию в этой точке. Если гематурия сохраняется, несмотря на консервативное лечение, следует рассмотреть возможность внутрипузырного лечения. Для этого показания доступно несколько препаратов:
Следует предусмотреть ежедневный физикальный осмотр, точный учет ирригационных жидкостей и антихолинергическую терапию для подавления свободных сокращений. Перфорацию мочевого пузыря следует учитывать при дифференциальной диагностике пациентов с ГХ, жалующихся на дискомфорт в животе или острую боль в животе. Мы не рекомендуем пытаться искать источник кровотечения или использовать коагуляцию в этой точке. Если гематурия сохраняется, несмотря на консервативное лечение, следует рассмотреть возможность внутрипузырного лечения. Для этого показания доступно несколько препаратов:
Внутрипузырные простагландины: Ранее было описано несколько исследований с простагландинами E1, E2, F2 [11, 12, 13, 14]. Эти простагландины способствуют сокращению гладких мышц, спазму капилляров, усиливают локальный гемостаз, и некоторые предполагают, что с тем же механизмом использования при язвенной болезни желудка простагландины могут помочь восстановить слизистый слой мочевого пузыря. Системная абсорбция простагландинов может увеличить скорость клубочковой фильтрации и диурез. Побочными эффектами от применения простагландинов являются спазмы мочевого пузыря и дискомфорт пациента, которые легко купируются анальгетиками и спазмолитиками. Поскольку использование простагландинов связано с более чем 50% успеха, и поскольку это неразрушающий агент, мы используем его в качестве препарата первой линии для лечения HC [11, 12, 13, 14].
Системная абсорбция простагландинов может увеличить скорость клубочковой фильтрации и диурез. Побочными эффектами от применения простагландинов являются спазмы мочевого пузыря и дискомфорт пациента, которые легко купируются анальгетиками и спазмолитиками. Поскольку использование простагландинов связано с более чем 50% успеха, и поскольку это неразрушающий агент, мы используем его в качестве препарата первой линии для лечения HC [11, 12, 13, 14].
Если у пациента продолжается кровотечение, доступны несколько других препаратов для внутрипузырного введения, порядок их введения следует определять в соответствии с побочными эффектами и сопутствующими осложнениями. Эти препараты обычно вызывают разрушение тканей, что требует особых мер предосторожности, а иногда и анестезии.
10.31083/j.jmcm.2020.02.805.t0001
Таблица 1
PGF2 (карбопрост) 50 мл 0,8 мг% на 60 минут × 4-6 дней. |
| Аналог PGF2 (карбопрост трометамин) 0,1–1 мг % в 25–100 мл физиологического раствора в течение 60 минут × 7 дней. |
| PGE1 (алпростадил) 0,75 мг% в 55 мл физиологического раствора × 1/D 7 дней. |
| PGE2 (динопростон) 200 мл 0,75 мг% в течение 60 минут × 1/D 7 дней. |
Внутрипузырные квасцы: квасцы вводят в виде 1% раствора путем непрерывного орошения. Он вызывает осаждение белка в уротелии и на кровоточащей поверхности и, таким образом, способствует свертыванию крови и остановке кровотечения. Осаждение белка способствует свертыванию крови, но сгустки крови могут также вызывать обструкцию мочеточников и катетеров, что приводит к задержке мочи, инфекциям и острой почечной недостаточности, что требует инвазивного вмешательства. Использование квасцов не связано с болью и дискомфортом и не требует анестезии [15].
Нитрат серебра внутрипузырно: нитрат серебра вызывает коагуляцию и преципитацию уротелиальных белков. 150-200 мл 1% раствора азотнокислого серебра закапывают в мочевой пузырь через катетер и оставляют на 15 мин, после чего мочевой пузырь промывают физиологическим раствором. Использование нитрата серебра вызывает боль и дискомфорт и требует анестезии. Осадки также могут вызывать задержку мочи и обструкцию мочеточников [15].
Формалин внутрипузырный: контакт формалина с жизнеспособной тканью вызывает коагуляцию тканевых белков и закупорку капилляров. Поскольку формалин вызывает обширное повреждение тканей, перед его применением следует исключить пузырно-мочеточниковый рефлюкс, пациенту обязательна анестезия из-за сильной боли. Первоначально в мочевой пузырь закапывают 2-5% раствор формалина; в случае неудачи концентрация формалина может быть увеличена до 5-10%. Обширная коагуляция может вызвать отек стенки мочевого пузыря и рубцевание, приводящее к обструкции мочеточников и почечной недостаточности; изменения в уретеровезикальном соединении также могут вызывать развитие de novo рефлюкс. Использование формалина связано с уровнем смертности 2,2% при использовании 5% раствора, а также с уровнем смертности 5,7% при использовании 10% раствора формалина. Высокая смертность может быть связана с тяжестью кровотечения, необходимостью анестезии, а также инфекциями, связанными с катетером [16, 17, 18].
Использование формалина связано с уровнем смертности 2,2% при использовании 5% раствора, а также с уровнем смертности 5,7% при использовании 10% раствора формалина. Высокая смертность может быть связана с тяжестью кровотечения, необходимостью анестезии, а также инфекциями, связанными с катетером [16, 17, 18].
Гипербарический кислород: Сообщалось, что гипербарический кислород (HO), вводимый в барокамере, является эффективным средством лечения HC. Механизм, с помощью которого HO влияет на мочевыводящие пути, до конца не ясен, хотя гипотеза связывает его действие с неоангиогенезом более стабильных капилляров с меньшей тенденцией к разрыву и кровотечению. Подобно простагландинам, HO является неразрушающей обработкой и не вызывает повреждения нормальной ткани, возникающего при использовании квасцов, нитрата серебра и формалина. Однако лечение является дорогостоящим, количество циклов лечения невозможно предсказать для конкретного пациента, а транспортировка тяжелобольного пациента в центр с барокамерой затруднена с точки зрения логистики. Пневмоторакс, эмфизема легких, судорожный синдром, проблемы с внутренним ухом и носовыми пазухами являются одними из противопоказаний для лечения в барокамере [19]., 20, 21].
Пневмоторакс, эмфизема легких, судорожный синдром, проблемы с внутренним ухом и носовыми пазухами являются одними из противопоказаний для лечения в барокамере [19]., 20, 21].
3.1 Исследуемые альтернативные методы лечения
Эстрогены: Miller et al. , [22] вводили эстрогены 7 критически больным пациентам с HC и смогли остановить кровотечение у 6 пациентов. Эстрогены назначались перорально в дозе 2,5 мг два раза в день в течение 7 дней и были выбраны в связи с высоким риском состояния этой группы пациентов, которым не удавалось получить пользу ни от какого другого лечения, кроме пероральных препаратов. Эстрогены уменьшают разрыв капилляров и утечку крови. Эстрогены также способствуют свертыванию крови. Краткосрочное использование не связано с сердечно-сосудистыми побочными эффектами. Основным преимуществом эстрогенов является их пероральный путь введения. В медицинской литературе недостаточно данных об этом лечении при ГК.
3. 2 Инвазивные и хирургические процедуры при HC
2 Инвазивные и хирургические процедуры при HC
Обструкция мочеточника может потребовать инвазивного вмешательства и чрескожного дренирования. Описана экстренная частичная или тотальная цистэктомия при угрожающем жизни кровотечении. Необходимость хирургического вмешательства для остановки кровотечения связана с неблагоприятным прогнозом с летальностью 50% [23, 24, 25, 26, 27].
4. Выводы
ГХ является распространенным опасным для жизни осложнением трансплантации костного мозга и химиотерапии на основе циклофосфамида. Таким образом, лечение циклофосфамидом и трансплантация костного мозга требуют профилактической терапии, но врачи должны осознавать тот факт, что, несмотря на меры по предотвращению, ГХ может быть неизбежен. Развитие ГК требует немедленного реагирования и сотрудничества между медицинскими службами. Перфорация мочевого пузыря является редким, но опасным для жизни осложнением, пациенты с тяжелой формой ГЦ, особенно с рецидивирующей задержкой сгустка крови и неугнетенным сокращением мочевого пузыря, а также пациенты, находящиеся на постоянном орошении мочевого пузыря, должны находиться под пристальным наблюдением.

 Наличие эрозии шейки матки, ассоциированной с ВПЧ и/или дисплазия эпителия (CIN) II-III ст, ВПЧ(+).
Наличие эрозии шейки матки, ассоциированной с ВПЧ и/или дисплазия эпителия (CIN) II-III ст, ВПЧ(+).