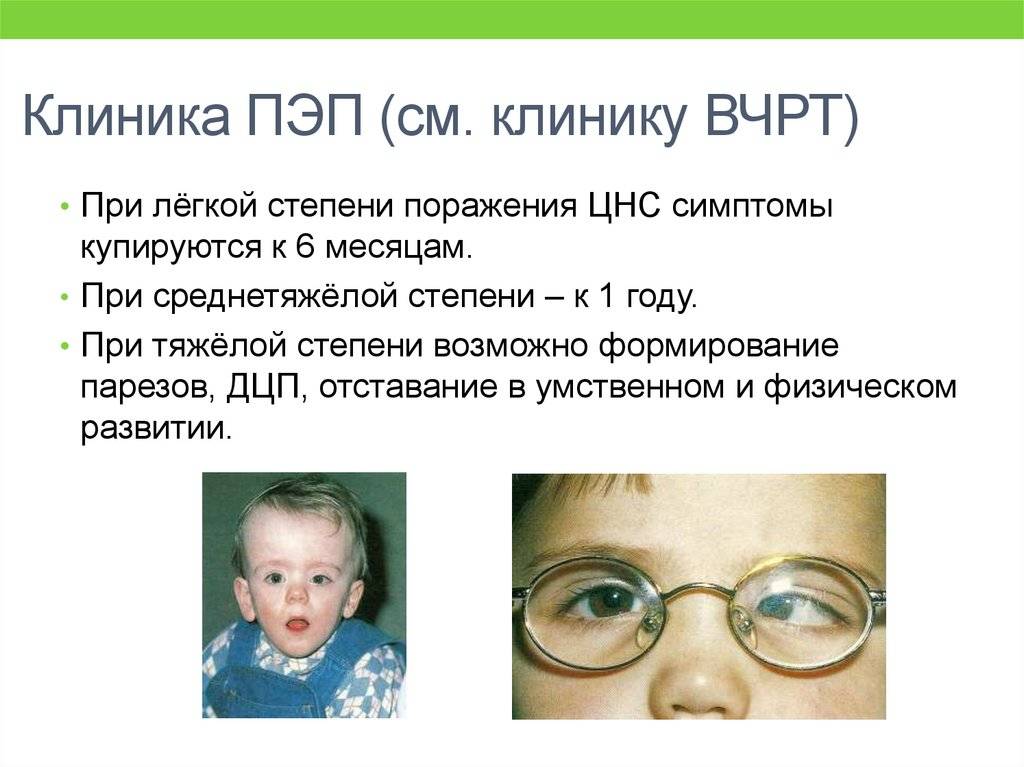
Энцефалопатия у новорожденных: Энцефалопатия новорожденных – причины, симптомы, диагностика и лечение
причины, симптомы, диагностика и лечение
Содержимое
- 1 Перинатальная энцефалопатия: симптомы, причины и лечение
- 1.1 Перинатальная энцефалопатия: симптомы и причины развития
- 1.1.1 Причины развития перинатальной энцефалопатии
- 1.1.2 Симптомы перинатальной энцефалопатии
- 1.1.3 Диагностика перинатальной энцефалопатии
- 1.2 Что такое перинатальная энцефалопатия?
- 1.3 Перинатальная энцефалопатия: причины, симптомы, диагностика и лечение
- 1.3.1 Какие причины могут вызвать перинатальную энцефалопатию?
- 1.4 Симптомы перинатальной энцефалопатии
- 1.5 Диагностика и лечение перинатальной энцефалопатии
- 1.6 Диагностика перинатальной энцефалопатии
- 1.7 Лечение перинатальной энцефалопатии
- 1.7.1 Медикаментозное лечение
- 1.7.2 Физиотерапия
- 1.7.3 Психологическая помощь
- 1.7.4 Оперативное лечение
- 1.8 Каковы прогнозы при перинатальной энцефалопатии организма?
- 1.
 9 Результаты научных исследований в области перинатальной энцефалопатии
9 Результаты научных исследований в области перинатальной энцефалопатии- 1.9.1 Причины возникновения перинатальной энцефалопатии
- 1.9.2 Симптомы перинатальной энцефалопатии
- 1.9.3 Диагностика перинатальной энцефалопатии
- 1.9.4 Лечение перинатальной энцефалопатии
- 1.10 Исследования перинатальной энцефалопатии
- 1.11 Профилактика перинатальной энцефалопатии
- 1.11.1 Регулярный прием врача
- 1.11.2 Правильное питание
- 1.11.3 Поддержание здорового образа жизни
- 1.11.4 Проведение родов планируемым путем
- 1.11.5 Вакцинация перед беременностью
- 1.12 Видео по теме:
- 1.13 Вопрос-ответ:
- 1.13.0.1 Что такое перинатальная энцефалопатия?
- 1.13.0.2 Какие могут быть причины перинатальной энцефалопатии?
- 1.13.0.3 Какие симптомы могут свидетельствовать о перинатальной энцефалопатии у ребенка?
- 1.13.0.4 Как проводится диагностика перинатальной энцефалопатии?
- 1.
 13.0.5 Можно ли лечить перинатальную энцефалопатию?
13.0.5 Можно ли лечить перинатальную энцефалопатию? - 1.13.0.6 Каковы последствия перинатальной энцефалопатии?
- 1.1 Перинатальная энцефалопатия: симптомы и причины развития
Узнайте, что такое перинатальная энцефалопатия, какие могут быть причины и последствия этого заболевания у новорожденных. Предлагаем полезные советы и рекомендации по диагностике и лечению перинатальной энцефалопатии.
Перинатальная энцефалопатия — это нарушение функций мозга, которое происходит у новорожденных в период околоплодного и раннего послеродового периода. Это состояние возникает в результате гипоксии (кислородного голодания), травмы головного мозга, нарушения кровообращения, инфекций и других факторов, повреждающих структуру мозга.
Симптомы перинатальной энцефалопатии могут проявляться сразу после рождения или через несколько дней. К таким симптомам относятся: задержка развития, нарушение моторной функции, проблемы с дыханием, судороги, нарушение координации движений и другие. Важно заметить, что симптомы могут проявляться как в легкой, так и в тяжелой форме.
Для диагностики перинатальной энцефалопатии используются несколько методов, таких как неврологический осмотр, ЭКГ, эхокардиография и КТ головного мозга. Правильно проведенная диагностика позволяет определить форму и тяжесть заболевания и подобрать необходимое лечение.
Лечение перинатальной энцефалопатии направлено в первую очередь на поддержание жизнедеятельности новорожденного и улучшение его состояния. Применяются различные методы, такие как гипербарическая оксигенация, реабилитационная терапия, лечение промежуточной зоны и другие. Важно помнить, что ранняя диагностика и лечение позволяют значительно уменьшить последствия перинатальной энцефалопатии и улучшить качество жизни ребенка в будущем.
Перинатальная энцефалопатия: симптомы и причины развития
Причины развития перинатальной энцефалопатии
Перинатальная энцефалопатия является нарушением мозговой деятельности, которая происходит в период внутриутробного развития, при родах или в первые дни жизни. Главной причиной ее развития являются кислородное голодание. Недостаток кислорода вызывает гипоксию мозга, что приводит к нарушениям его функционирования. Кислородное голодание может возникнуть из-за различных причин, таких как плацентарная недостаточность, тромбоз, дистресс плода, асфиксия при родах и другие факторы.
Главной причиной ее развития являются кислородное голодание. Недостаток кислорода вызывает гипоксию мозга, что приводит к нарушениям его функционирования. Кислородное голодание может возникнуть из-за различных причин, таких как плацентарная недостаточность, тромбоз, дистресс плода, асфиксия при родах и другие факторы.
Симптомы перинатальной энцефалопатии
Симптомы перинатальной энцефалопатии могут проявляться сразу после рождения ребенка или появляться на протяжении первых дней, недель или месяцев жизни. Основными признаками являются изменения поведения ребенка, нарушения координации движений, напряжение мышц, непроизвольные движения глаз, нарушение сна и бодрствования. Также могут наблюдаться нарушения мышечного тонуса, задержка в развитии двигательной координации, плохая ориентация в пространстве и другие нарушения нервной системы.
Диагностика перинатальной энцефалопатии
Диагностика перинатальной энцефалопатии проводится на основании клинических данных и результатов дополнительных методов исследования. Для оценки состояния нервной системы могут использоваться методы электроэнцефалографии, магнитно-резонансной томографии и допплерографии. Кроме этого, проводятся исследования гемодинамики, уровня кислорода в крови и другие методы. Важную роль играет анамнез матери и ребенка, сведения о родах и другая информация, помогающая определить причину развития заболевания.
Для оценки состояния нервной системы могут использоваться методы электроэнцефалографии, магнитно-резонансной томографии и допплерографии. Кроме этого, проводятся исследования гемодинамики, уровня кислорода в крови и другие методы. Важную роль играет анамнез матери и ребенка, сведения о родах и другая информация, помогающая определить причину развития заболевания.
Что такое перинатальная энцефалопатия?
Перинатальная энцефалопатия – это неврологическое заболевание, которое возникает у новорожденных в результате нарушения кровообращения во время беременности, родов и после рождения. Это состояние сопровождается нарушением функций мозга, которые могут проявляться разными способами, в зависимости от тяжести и формы энцефалопатии.
Часто перинатальная энцефалопатия развивается при преждевременном рождении, гипоксии (кислородном голодании) плода, асфиксии (отсутствии дыхания) во время родов, инфекционных заболеваниях беременной и других факторах, которые могут повлиять на здоровье ребенка еще в утробе матери.
Перинатальная энцефалопатия является одной из наиболее распространенных причин инвалидности и задержки развития у детей. Поэтому очень важно своевременно выявить, диагностировать и назначить лечение этого заболевания.
Перинатальная энцефалопатия: причины, симптомы, диагностика и лечение
Какие причины могут вызвать перинатальную энцефалопатию?
Перинатальная энцефалопатия является серьезным заболеванием, которое происходит из-за кислородного голодания мозга ребенка во время рождения. Причиной этого может быть множество факторов, включая:
- Длительный родовой процесс, который может вызвать сильный стресс и утомление для ребенка.
- Недоношенность, когда ребенок родился раньше срока и его организм еще не полностью сформирован.
- Повреждение головного мозга, которое может произойти во время родов или из-за других причин.
- Нарушения кровообращения у матери во время беременности, что может привести к нарушению питания плода.
Очень важно своевременно выявлять причины перинатальной энцефалопатии, чтобы назначить эффективное лечение и предотвратить дальнейшие осложнения. Для этого проводится комплексное обследование ребенка, включающее в себя нейрологический и психологический анализ, а также электроэнцефалограмму (ЭЭГ) и компьютерную томографию головного мозга.
Для этого проводится комплексное обследование ребенка, включающее в себя нейрологический и психологический анализ, а также электроэнцефалограмму (ЭЭГ) и компьютерную томографию головного мозга.
Симптомы перинатальной энцефалопатии
Перинатальная энцефалопатия – это заболевание нервной системы, которое возникает вследствие кислородного голодания плода или травмы при родах. Симптомы диагностируются по характеру нарушений в развитии моторики, сознания, ауто- и гетерорефлексии.
Одним из первых признаков наличия перинатальной энцефалопатии является общая слабость и вялость новорожденного. Ребенок апатичен, наблюдаются нарушения сна, его хрупкий организм действует медленно и нервно.
Определенные признаки возможно выявить через некоторое время после рождения, когда малыш начинает плавно развиваться. Это микроцефалия – уменьшение головного мозга, дизартрия – нарушение речи и дискинезия – нарушение координации движений.
Ругозность кожи, отеки на лице и конечностях – дополнительные симптомы возможного наличия энцефалопатии. Раздражительность, гиперактивность и подвижность, наряду с тремором, растяжимостью тона – еще одна характеристика состояния ребенка.
Раздражительность, гиперактивность и подвижность, наряду с тремором, растяжимостью тона – еще одна характеристика состояния ребенка.
Важно понимать, что некоторые из перечисленных проявлений могут быть обусловлены другими причинами или заболеваниями. Поэтому для точной диагностики необходима своевременная консультация специалиста и проведение соответствующего обследования.
Диагностика и лечение перинатальной энцефалопатии
Для диагностики перинатальной энцефалопатии необходима комплексная оценка симптомов и факторов риска у новорожденного. Ребенок может быть направлен на проведение электроэнцефалографии, магнитно-резонансной томографии или других обследований для определения степени поражения головного мозга.
При выявлении перинатальной энцефалопатии лечение ребенка проводится немедленно, начиная с реанимации и поддержания жизненных функций. Затем назначается курс лечения, включающий в себя физиотерапию, массаж, лекарственные препараты и кислородотерапию. Лечение должно быть индивидуальным и подобрано под каждый конкретный случай.
- Физиотерапия направлена на улучшение двигательных функций, повышение тонуса мышц и развитие координации движений.
- Массаж способствует ускорению метаболических процессов в тканях, повышает мышечный тонус и улучшает кровообращение.
- Лекарственные препараты могут назначаться для улучшения кровообращения в мозге, повышения тонуса мышц и развития психомоторных навыков.
- Кислородотерапия необходима при гипоксии, которая является одной из причин перинатальной энцефалопатии.
Важно начать лечение перинатальной энцефалопатии на ранних стадиях для уменьшения последствий поражения головного мозга и максимального восстановления функций у ребенка. Для этого необходимо своевременное обращение к врачу и правильный подход к диагностике и лечению.
Диагностика перинатальной энцефалопатии
Первичная диагностика: При первичной диагностике перинатальной энцефалопатии важно установить наличие факторов риска: патологии беременности, плохую переносимость родов, признаки поражения ЦНС. Дети, рожденные с массой тела менее 2500 грамм, или с аномалиями развития мозга, подвержены риску развития ПЭ. Выявить наличие ранних симптомов энцефалопатии у новорожденного можно проведя прослушивание скрытых отрезков сердцебиения, осмотр кожных покровов и тонкости мышечного тонуса.
Дети, рожденные с массой тела менее 2500 грамм, или с аномалиями развития мозга, подвержены риску развития ПЭ. Выявить наличие ранних симптомов энцефалопатии у новорожденного можно проведя прослушивание скрытых отрезков сердцебиения, осмотр кожных покровов и тонкости мышечного тонуса.
Дополнительные методы диагностики: Необходимо назначить дополнительные методы диагностики, чтобы определить степень нарушения функции ЦНС. К ним относятся нейрофизиологические исследования (ЭЭГ, ЭКГ), нейроимагинговые исследования (МРТ, КТ), лабораторный анализ крови и мочи на наличие метаболитов. Нейрофизиологическая диагностика помогает выявить нарушения в работе ЦНС, установить эпилептическую активность мозга. Нейроимагинговые исследования дают возможность оценить состояние мозговых структур и выявить патологические изменения. Лабораторный анализ крови и мочи позволяет исключить наличие инфекции или метаболических нарушений, которые могут привести к повреждению ЦНС.
Диагностика в динамике: Для оценки эффективности лечения рекомендуется проводить диагностику в динамике. С помощью ЭЭГ можно оценить эффективность терапии, проведенной для устранения эпилептических приступов. КТ и МРТ дают возможность установить динамику изменений мозговых структур. Лабораторный анализ крови и мочи в динамике помогает оценить эффективность лечения метаболических нарушений и выявить возможные осложнения.
С помощью ЭЭГ можно оценить эффективность терапии, проведенной для устранения эпилептических приступов. КТ и МРТ дают возможность установить динамику изменений мозговых структур. Лабораторный анализ крови и мочи в динамике помогает оценить эффективность лечения метаболических нарушений и выявить возможные осложнения.
Лечение перинатальной энцефалопатии
Медикаментозное лечение
Медикаментозное лечение используется для улучшения кровообращения и обменных процессов в мозге, а также для снижения возможных судорожных проявлений. В отдельных случаях могут быть назначены препараты, улучшающие метаболические процессы и стимулирующие работу нервной системы. Однако, выбор препаратов и их дозировка должны строго контролироваться врачом, так как неправильное лекарственное воздействие может ухудшить состояние ребенка.
Физиотерапия
Для лечения перинатальной энцефалопатии может применяться комплекс физиотерапевтических процедур, направленных на улучшение кровообращения и обменных процессов в мозге, а также на укрепление мышечного корсета и поддержание тонуса нервной системы. Также могут быть назначены массаж, гимнастика и другие методы физической терапии. Важно, чтобы физиотерапевтическое лечение проводилось под строгим контролем врача.
Также могут быть назначены массаж, гимнастика и другие методы физической терапии. Важно, чтобы физиотерапевтическое лечение проводилось под строгим контролем врача.
Психологическая помощь
Родители ребенка с перинатальной энцефалопатией могут испытывать негативные эмоции и стресс, поэтому важно обеспечить им психологическую поддержку и помощь. Психологи могут помочь снять стресс, дать советы по уходу за ребенком и общению с ним, а также помочь родителям справиться с возможными проблемами в воспитании ребенка.
Оперативное лечение
Оперативное лечение перинатальной энцефалопатии может быть назначено в отдельных случаях, например, при наличии гидроцефалии (скопления жидкости в мозге). Однако, решение о проведении операции принимается только врачом после тщательного обследования и выявления противопоказаний.
Каковы прогнозы при перинатальной энцефалопатии организма?
Перинатальная энцефалопатия является серьезным заболеванием, которое может оставить негативные последствия на всю жизнь. Однако, прогноз зависит от многих факторов.
Однако, прогноз зависит от многих факторов.
В первую очередь, важную роль играет степень поражения мозга, возраст ребенка на момент заболевания, а также эффективность проводимого лечения.
При легкой форме энцефалопатии прогноз чаще всего благоприятный. Дети склонны быстро восстанавливаться и у них нет последующих осложнений. Средние и тяжелые формы энцефалопатии могут оставить пациенту более серьезные осложнения, например, задержку умственного развития, поражение нервных функций и нарушения психомоторной активности.
В любом случае, родители и окружающие должны понимать, что чем раньше было обнаружено заболевание и проведено лечение, тем больше шансов на благоприятный прогноз. Однако, перинатальная энцефалопатия является заболеванием, требующим внимательного наблюдения и качественного лечения на протяжении всей жизни.
Результаты научных исследований в области перинатальной энцефалопатии
Причины возникновения перинатальной энцефалопатии
Недавние научные исследования показывают, что основными причинами развития перинатальной энцефалопатии являются гипоксия (кислородное голодание) и ишемия (нарушение кровообращения) мозга ребенка во время беременности, родов и раннего послеродового периода. Эти условия могут вызвать повреждение мозга и нарушение его нормального развития.
Эти условия могут вызвать повреждение мозга и нарушение его нормального развития.
Симптомы перинатальной энцефалопатии
Симптомы перинатальной энцефалопатии могут проявляться у новорожденных, грудных детей и детей дошкольного возраста. Научные исследования показывают, что дети с перинатальной энцефалопатией могут иметь различные симптомы, в зависимости от тяжести и формы заболевания. Однако, наиболее распространенными симптомами являются нарушения моторной функции, задержка развития речи и психического развития, а также повышенная раздражительность и агрессивность.
Диагностика перинатальной энцефалопатии
Для диагностики перинатальной энцефалопатии врачи используют различные методы, включая клинические обследования, неврологические тесты, нейроимиджинг (например, МРТ мозга), электроэнцефалографию (ЭЭГ) и другие методы исследования. Однако, не всегда возможно точно диагностировать перинатальную энцефалопатию в раннем возрасте. Поэтому важно регулярно наблюдать за развитием ребенка и обращаться к врачу при первых признаках возможных нарушений.
Лечение перинатальной энцефалопатии
Научные исследования показывают, что раннее начало медицинского лечения и реабилитационных мероприятий может значительно улучшить прогноз для детей с перинатальной энцефалопатией. Лечение может включать в себя медикаментозную терапию, физиотерапию, логопедические занятия и другие виды реабилитации. Эффективность лечения и прогноз для пациентов зависят от тяжести заболевания и правильности подбора лечебного курса в каждом конкретном случае.
Исследования перинатальной энцефалопатии
На текущий момент исследования перинатальной энцефалопатии показывают, что основная причина ее возникновения — нарушения плацентарной и материнской кровообращения.
Исследования также показывают, что диагностика перинатальной энцефалопатии может быть трудной, и только профессиональные медицинские специалисты, используя различные методы обследования могут достоверно установить ее наличие.
Результаты исследований также свидетельствуют о том, что раннее лечение и реабилитация младенцев с перинатальной энцефалопатией могут улучшить их прогноз, и снизить риск возникновения психических, физических и сенсорных нарушений в будущем.
- Обнаружение перинатальной энцефалопатии в раннем возрасте может помочь в проведении своевременной реабилитации и лечения.
- Некоторые исследования демонстрируют, что лечение младенцев с перинатальной энцефалопатией, используя методы, такие как гипотермия или физиотерапия, могут улучшить их моторные способности и функции сердечно-сосудистой системы.
- Новые исследования также показывают, что некоторые лекарственные препараты, такие как ноотропы, могут помочь улучшить когнитивные функции и поведение у детей с перинатальной энцефалопатией.
В целом, исследования перинатальной энцефалопатии всегда продолжаются, и находки будут использоваться для улучшения диагностики и лечения этого состояния в будущем.
Профилактика перинатальной энцефалопатии
Регулярный прием врача
Регулярный прием врача во время беременности может помочь снизить риск развития перинатальной энцефалопатии. Врачи будут следить за состоянием и здоровьем беременной женщины, а также за развитием плода, что может помочь выявить проблемы в ранних стадиях и предотвратить их дальнейшее развитие.
Правильное питание
Употребление питания, богатого витаминами и минералами, может помочь предотвратить перинатальную энцефалопатию. Беременные женщины должны употреблять достаточное количество фолата, железа, кальция, белка и других важных питательных веществ. Необходимо также избегать употребления алкоголя и никотина, которые могут оказать негативное влияние на развитие плода.
Поддержание здорового образа жизни
Избегание стресса и поддержание здорового образа жизни также могут помочь предотвратить перинатальную энцефалопатию. Женщины должны избегать переутомления, физического и эмоционального стресса и поддерживать правильный режим дня. Также необходимо заниматься умеренной физической активностью и следить за весом.
Проведение родов планируемым путем
Проведение родов планируемым путем может помочь снизить риск развития перинатальной энцефалопатии. Если возникают проблемы при беременности, необходимо обсудить возможные риски и побочные эффекты с врачом, чтобы определить наиболее безопасный способ родов для матери и ребенка.
Вакцинация перед беременностью
Вакцинация перед беременностью может помочь предотвратить возникновение инфекций, которые могут привести к перинатальной энцефалопатии. Беременные женщины должны обсудить вакцины с врачом и получить рекомендации по их употреблению до и во время беременности.
Видео по теме:
Вопрос-ответ:
Что такое перинатальная энцефалопатия?
Перинатальная энцефалопатия — это ущерб мозга, который возникает во время родов или непосредственно после рождения ребенка.
Какие могут быть причины перинатальной энцефалопатии?
Причины могут быть разными: кислородное голодание во время родов, инфекции, наследственные и метаболические заболевания, травмы во время рождения и др.
Какие симптомы могут свидетельствовать о перинатальной энцефалопатии у ребенка?
Симптомы могут включать в себя: нарушения сна, общительности, развития, конвульсии, мышечную гипотонию, задержку психомоторного развития и др.
Как проводится диагностика перинатальной энцефалопатии?
Диагностика может включать в себя: неврологический осмотр, электроэнцефалограмму (ЭЭГ), магнитно-резонансную томографию (МРТ), анализы на гормоны и др.
Можно ли лечить перинатальную энцефалопатию?
Да, предпринимаются меры для лечения перинатальной энцефалопатии. Лечение может включать в себя: кислородотерапию, лекарства для поддержания сердечной деятельности, физиотерапию, операции и др.
Каковы последствия перинатальной энцефалопатии?
Последствия могут быть разными, от легких задержек развития до нарушения координации движений и умственной отсталости.
Редкое метаболическое заболевание — некетотическая глициновая энцефалопатия у новорожденного ребенка | Габитова Н.
 Х., Черезова И.Н., Валеева Н.Р.
Х., Черезова И.Н., Валеева Н.Р.
Введение
Наследственные болезни обмена веществ — обширная группа заболеваний, которые возникают и развиваются вследствие различных мутаций в геноме человека. Для наследственных болезней обмена характерно острое начало с необратимыми повреждениями нервной системы и высокой летальностью в первый год жизни, что определяет значимую роль данной патологии в структуре детской инвалидизации и смертности. Дебютировать заболевание может в любом возрасте, раннее начало свидетельствует о тяжелой форме патологии.
Глициновая энцефалопатия (ГЭп), или некетотическая гиперглицинемия, — редкое наследственное заболевание с частотой встречаемости в мире 1 на 100 тыс. человек [1]. Болезнь наследуется по аутосомно-рецессивному механизму и чаще всего проявляется в неонатальном периоде. Распространенность данного заболевания среди новорожденных детей во всем мире составляет около 1 случая на 76 тыс. [2]. Более высокая частота болезни встречается в Финляндии и провинции Британская Колумбия в Канаде: 1:55 тыс. и 1:63 тыс. новорожденных соответственно [3]. Высокий уровень ГЭп регистрируется в арабских семьях и в Израиле [4]. Глицин метаболизируется в митохондриях мультиферментным комплексом расщепления (glycine cleavage sistem — GCS) до конечных продуктов — аммиака и двуокиси углерода. Данное вещество одновременно является аминокислотой и нейротрансмиттером, передающим электрохимические импульсы от одной нервной клетки к другой. Являясь тормозным нейротрансмиттером, глицин ингибирует деятельность ствола головного и спинного мозга, но может выступать модулятором возбуждения через N-метил-D-аспартатные (NMDA) (глутаматэргические) рецепторы в коре головного мозга. Ферментный комплекс расщепления глицина состоит из четырех белков (Р, Т, Н, L), синтез которых кодируется тремя различными генами и хромосомами. Белок P — пиридоксальфосфатзависимая глициндекарбоксилаза кодируется геном GLDS (локус 9p24.1) и отвечает за первый этап переработки глицина. Белок T — аминометилтрансфераза кодируется геном АМТ (локус 3p21.
и 1:63 тыс. новорожденных соответственно [3]. Высокий уровень ГЭп регистрируется в арабских семьях и в Израиле [4]. Глицин метаболизируется в митохондриях мультиферментным комплексом расщепления (glycine cleavage sistem — GCS) до конечных продуктов — аммиака и двуокиси углерода. Данное вещество одновременно является аминокислотой и нейротрансмиттером, передающим электрохимические импульсы от одной нервной клетки к другой. Являясь тормозным нейротрансмиттером, глицин ингибирует деятельность ствола головного и спинного мозга, но может выступать модулятором возбуждения через N-метил-D-аспартатные (NMDA) (глутаматэргические) рецепторы в коре головного мозга. Ферментный комплекс расщепления глицина состоит из четырех белков (Р, Т, Н, L), синтез которых кодируется тремя различными генами и хромосомами. Белок P — пиридоксальфосфатзависимая глициндекарбоксилаза кодируется геном GLDS (локус 9p24.1) и отвечает за первый этап переработки глицина. Белок T — аминометилтрансфераза кодируется геном АМТ (локус 3p21. 31) и отвечает за второй этап метаболизма глицина, при котором происходит перенос метильной группы с молекулы глицина на тетрагидрофолат и образование метоксиметилтетрагидрофолиевой кислоты. Белок H, кодируемый геном GCSH (локус 16q23.2), — переносчик водорода, содержит липоевую кислоту и образует субстрат для взаимодействия со всеми ферментами, отвечающими за переработку аминокислоты. Белок L — липоамид дегидрогеназа, кодируемый геном DLD, не изменяется при данном заболевании [1, 2]. Фермент, расщепляющий глицин, экспрессируется в печени, головном мозге и плаценте, в небольших количествах в лимфобластах, трансформированных вирусом Эпштейна — Барр. Нарушение любого звена метаболизма глицина сопровождается избыточным его накоплением во всех жидкостях и тканях организма, включая головной мозг. Дефект метаболизма аминокислот в первую очередь затрагивает начальный этап метаболического пути [5]. Глициновая энцефалопатия связана с нарушением строения белков P, T или H в результате генетических мутаций и является опасным для жизни метаболическим заболеванием [6–8].
31) и отвечает за второй этап метаболизма глицина, при котором происходит перенос метильной группы с молекулы глицина на тетрагидрофолат и образование метоксиметилтетрагидрофолиевой кислоты. Белок H, кодируемый геном GCSH (локус 16q23.2), — переносчик водорода, содержит липоевую кислоту и образует субстрат для взаимодействия со всеми ферментами, отвечающими за переработку аминокислоты. Белок L — липоамид дегидрогеназа, кодируемый геном DLD, не изменяется при данном заболевании [1, 2]. Фермент, расщепляющий глицин, экспрессируется в печени, головном мозге и плаценте, в небольших количествах в лимфобластах, трансформированных вирусом Эпштейна — Барр. Нарушение любого звена метаболизма глицина сопровождается избыточным его накоплением во всех жидкостях и тканях организма, включая головной мозг. Дефект метаболизма аминокислот в первую очередь затрагивает начальный этап метаболического пути [5]. Глициновая энцефалопатия связана с нарушением строения белков P, T или H в результате генетических мутаций и является опасным для жизни метаболическим заболеванием [6–8]. В 86% всех случаев заболевание связано с дефицитом белка Р и мутациями в гене GLDS, около 20% — вызваны мутациями в гене АМТ. С белком Н (ген GCSH) связывают менее 1% случаев болезни; 5% людей с ГЭп не имеют никаких мутаций в любом из этих трех генов. Одни мутации генов снижают активность системы расщепления глицина и вызывают ослабленную форму заболевания, другие — полностью устраняют ее активность и приводят к тяжелой энцефалопатии [2, 7].
В 86% всех случаев заболевание связано с дефицитом белка Р и мутациями в гене GLDS, около 20% — вызваны мутациями в гене АМТ. С белком Н (ген GCSH) связывают менее 1% случаев болезни; 5% людей с ГЭп не имеют никаких мутаций в любом из этих трех генов. Одни мутации генов снижают активность системы расщепления глицина и вызывают ослабленную форму заболевания, другие — полностью устраняют ее активность и приводят к тяжелой энцефалопатии [2, 7].
Избыточное накопление глицина в головном мозге повышает активность рецепторов NMDA и способствует избыточному поступлению кальция в клетки. Это приводит к активации большого количества внутриклеточных ферментов и взрывообразному увеличению интенсивности обмена веществ, разрыву ДНК и гибели нейронов [7, 8].
Заболевание разделяют на неонатальную, инфантильную и атипичную формы. В зависимости от клинического исхода выделяют тяжелые и ослабленные (аттенуированные) формы ГЭп. Симптомы неонатальной формы ГЭп проявляются в первые часы и дни жизни, в 85% случаев имеют тяжелое течение. Характерны прогрессирующая вялость, переходящая в глубокую кому, выраженная гипотония, миоклонические судороги, приводящие к апноэ. При отсутствии респираторной поддержки апноэ может закончиться летальным исходом. Судороги являются постоянным признаком заболевания, варьируют по силе и частоте, могут иметь характер неукротимой икоты. Энцефалопатия при ГЭп сопровождается развитием глубокой умственной отсталости. Облегченная неонатальная форма развивается в возрасте от 2 нед. до 3 мес., протекает значительно легче, встречается у 15% детей с ГЭп. Пациенты имеют различную степень умственной отсталости и судорог, гиперактивность, хорею. Эпизоды летаргии, судорог и атаксии провоцируются инфекционными агентами [5]. Инфантильная форма манифестирует у детей до 2 лет и дебютирует гипотонией, с последующей задержкой психомоторного развития, эпизоды летаргии не характерны. Интеллект при инфантильной форме страдает меньше, чем при неонатальной. Тяжелое течение данной формы сопровождается бульбарными нарушениями, спастическими параличами, которые формируют деформации скелета, патологическую установку нижних конечностей и вынужденное положение в постели к шестимесячному возрасту.
Характерны прогрессирующая вялость, переходящая в глубокую кому, выраженная гипотония, миоклонические судороги, приводящие к апноэ. При отсутствии респираторной поддержки апноэ может закончиться летальным исходом. Судороги являются постоянным признаком заболевания, варьируют по силе и частоте, могут иметь характер неукротимой икоты. Энцефалопатия при ГЭп сопровождается развитием глубокой умственной отсталости. Облегченная неонатальная форма развивается в возрасте от 2 нед. до 3 мес., протекает значительно легче, встречается у 15% детей с ГЭп. Пациенты имеют различную степень умственной отсталости и судорог, гиперактивность, хорею. Эпизоды летаргии, судорог и атаксии провоцируются инфекционными агентами [5]. Инфантильная форма манифестирует у детей до 2 лет и дебютирует гипотонией, с последующей задержкой психомоторного развития, эпизоды летаргии не характерны. Интеллект при инфантильной форме страдает меньше, чем при неонатальной. Тяжелое течение данной формы сопровождается бульбарными нарушениями, спастическими параличами, которые формируют деформации скелета, патологическую установку нижних конечностей и вынужденное положение в постели к шестимесячному возрасту. Эпилептические припадки резистентны к противосудорожной терапии, пациенты отстают в психомоторном и физическом развитии. Атипичная, или вариантная, форма заболевания встречается редко. Для данной формы характерны спастический парапарез, атрофия зрительного нерва, поражение сердечно-сосудистой системы с развитием легочной гипертензии, сохранность интеллектуальной функции [5, 7, 11–13].
Эпилептические припадки резистентны к противосудорожной терапии, пациенты отстают в психомоторном и физическом развитии. Атипичная, или вариантная, форма заболевания встречается редко. Для данной формы характерны спастический парапарез, атрофия зрительного нерва, поражение сердечно-сосудистой системы с развитием легочной гипертензии, сохранность интеллектуальной функции [5, 7, 11–13].
Диагностика ГЭп основана на определении уровня глицина в плазме крови и цереброспинальной жидкости (ЦСЖ), а также на определении соотношения глицина в ЦСЖ к таковому в плазме крови, повышение соотношения выше 0,06 подтверждает диагноз (норма менее 0,02) [13, 14]. На электроэнцефалограмме (ЭЭГ) регистрируют паттерн «вспышка — угнетение», который со временем трансформируется в мультифокальные спайки или гипсаритмию. Магнитно-резонансная томография (МРТ) головного мозга выявляет агенезию мозолистого тела, аномальное формирование извилин, задержку миелинизации и корково-подкорковую атрофию [3, 14–18]. Для подтверждения диагноза проводится молекулярно-генетическое тестирование генов GLDS и АМТ [2]. Разработаны тесты для неинвазивной ферментативной диагностики ГЭп, основанные на измерении выдыхаемого 13СО2 после введения стабильного изотопа [1-13C] глицина, и мультиплексная амплификация зонда MLPA для обнаружения больших делеций в GLDC [19].
Для подтверждения диагноза проводится молекулярно-генетическое тестирование генов GLDS и АМТ [2]. Разработаны тесты для неинвазивной ферментативной диагностики ГЭп, основанные на измерении выдыхаемого 13СО2 после введения стабильного изотопа [1-13C] глицина, и мультиплексная амплификация зонда MLPA для обнаружения больших делеций в GLDC [19].
На сегодня отсутствует стандарт лечения тяжелой ГЭп. Основная задача терапии состоит в снижении концентрации глицина бензоатом натрия и блокировании рецепторов NMDA декстрометорфаном, кетамином или фелбаматом для уменьшения судорог. Наиболее часто при лечении пациентов используется комбинированная терапия бензоатом натрия и антагонистами NMDA [12, 22]. Бензоат натрия снижает концентрацию глицина в плазме, но не препятствует развитию неврологических осложнений. Эффективность лечения бензоатом натрия определяется формой заболевания и используемой дозой. Высокие дозы бензоата натрия используются при лечении тяжелых форм болезни, могут привести к таким осложнениям, как гастрит, гастроэзофагеальный рефлюкс, дисфункция почечных канальцев, дефицит карнитина. Самые распространенные антагонисты NMDA — декстрометорфан и кетамин. Комбинация бензоата натрия и антагонистов NMDA обладает положительным эффектом в неонатальном периоде, но при тяжелой форме заболевания отмечается отсутствие прогресса психомоторного развития и положительной динамики течения эпилепсии. Назначение противосудорожных препаратов необходимо в качестве симптоматической терапии для улучшения качества жизни. У детей с классическим вариантом ГЭп часто требуется назначение комбинации противоэпилептических препаратов. В неонатальном периоде положительный эффект лечения эпилептических приступов отмечен у фенобарбитала, леветирацетама и бензодиазепинов [22]. Состояние больных с тяжелой формой и фармакорезистентной эпилепсией может облегчить кетогенная диета с ограничением белка и повышенным потреблением жиров. Кетогенная диета вызывает снижение концентрации глицина за счет использования его в глюконеогенезе [22, 23]. Приводим описание течения данного редкого заболевания у ребенка.
Самые распространенные антагонисты NMDA — декстрометорфан и кетамин. Комбинация бензоата натрия и антагонистов NMDA обладает положительным эффектом в неонатальном периоде, но при тяжелой форме заболевания отмечается отсутствие прогресса психомоторного развития и положительной динамики течения эпилепсии. Назначение противосудорожных препаратов необходимо в качестве симптоматической терапии для улучшения качества жизни. У детей с классическим вариантом ГЭп часто требуется назначение комбинации противоэпилептических препаратов. В неонатальном периоде положительный эффект лечения эпилептических приступов отмечен у фенобарбитала, леветирацетама и бензодиазепинов [22]. Состояние больных с тяжелой формой и фармакорезистентной эпилепсией может облегчить кетогенная диета с ограничением белка и повышенным потреблением жиров. Кетогенная диета вызывает снижение концентрации глицина за счет использования его в глюконеогенезе [22, 23]. Приводим описание течения данного редкого заболевания у ребенка.
Kлиническое наблюдение
Ребенок рожден от неродственного брака, 1-й беременности, протекавшей с осложнениями (угроза прерывания на ранних сроках, анемия, кольпит, артериальная гипертензия в I триместре, отеки беременных в III триместре). Роды, индуцированные на сроке 41+4 нед., осложненные длительным безводным периодом, быстрые по 2-му периоду. Оценка по шкале Апгар — 6/6/7 баллов. При осмотре ребенка в родильном зале: состояние средней тяжести за счет перенесенной гипоксии, мышечный тонус диффузно снижен, рефлексы новорожденного с истощением, дыхание затруднено, родовая опухоль в теменно-затылочной области. После проведения реанимационных мероприятий и стабилизации состояния был переведен в отделение новорожденных. Состояние ухудшилось на 2-е сутки жизни. Появились оперкулярные судороги в покое и при повороте головы вправо с остановкой взгляда, горизонтальным нистагмом в течение 3–5 с (6 серий за 30 мин). Прогрессировала диффузная мышечная гипотония, отмечалось пронаторное положение обеих рук с ограничением активных движений в правом плечевом суставе, левая рука свисала, движения в кисти и локте были сохранены. Рефлексы новорожденного (поисковый, Бабкина, хватания) не вызывались. В течение последующих 2 дней отмечено нарастание синдрома угнетения со снижением уровня сознания. На 3-й день жизни появились приступы апноэ до 4 раз в течение 1 ч с падением сатурации O2 до 84%, в связи с чем ребенок был переведен на искусственную вентиляцию легких (ИВЛ). Общий анализ крови, лабораторное исследование кислотно-основного состояния крови и рентгенологическое исследование органов грудной клетки изменений не выявили. На нейросонограмме определялись признаки внутричерепной гипертензии, умеренно выраженные перивентрикулярные уплотнения и образование со стенками овальной формы с четкими ровными контурами 1,3 мм, прилегающее к переднему рогу справа. Участки очаговой ишемии, ослабление пульсации сосудов, неоднородные субэпендимальные кровоизлияния размером 4,8 мм. Для дальнейшего лечения и обследования ребенок был переведен в отделение реанимации ГАУЗ «ДРКБ МЗ РТ» (Казань) с предварительным диагнозом: «Перинатальное повреждение ЦНС гипоксически-ишемического генеза, с вовлечением ствола головного мозга в форме синдрома угнетения, судорожного синдрома, внутрижелудочковые кровоизлияния справа? Синдром дыхательных расстройств II смешанного генеза».
Рефлексы новорожденного (поисковый, Бабкина, хватания) не вызывались. В течение последующих 2 дней отмечено нарастание синдрома угнетения со снижением уровня сознания. На 3-й день жизни появились приступы апноэ до 4 раз в течение 1 ч с падением сатурации O2 до 84%, в связи с чем ребенок был переведен на искусственную вентиляцию легких (ИВЛ). Общий анализ крови, лабораторное исследование кислотно-основного состояния крови и рентгенологическое исследование органов грудной клетки изменений не выявили. На нейросонограмме определялись признаки внутричерепной гипертензии, умеренно выраженные перивентрикулярные уплотнения и образование со стенками овальной формы с четкими ровными контурами 1,3 мм, прилегающее к переднему рогу справа. Участки очаговой ишемии, ослабление пульсации сосудов, неоднородные субэпендимальные кровоизлияния размером 4,8 мм. Для дальнейшего лечения и обследования ребенок был переведен в отделение реанимации ГАУЗ «ДРКБ МЗ РТ» (Казань) с предварительным диагнозом: «Перинатальное повреждение ЦНС гипоксически-ишемического генеза, с вовлечением ствола головного мозга в форме синдрома угнетения, судорожного синдрома, внутрижелудочковые кровоизлияния справа? Синдром дыхательных расстройств II смешанного генеза». При поступлении в ГАУЗ «ДРКБ МЗ РТ» (Казань) состояние оценивалось как крайне тяжелое. Ребенок угнетен, вялый. Спонтанная двигательная активность снижена, мышечный тонус значительно снижен, рефлексы резко угнетены, сухожильные рефлексы S≥D, зрачки D=S, фотореакция сомнительная. Грудная клетка правильной формы, с умеренным западением грудины, втяжением межреберий. Дыхание аппаратное, самостоятельное отсутствует. Тоны сердца ритмичные, приглушены с тенденцией к брадикардии, частота сердечных сокращений 116 в 1 мин. Паренхиматозные органы не увеличены. С учетом клонико-тонических судорог с рождения, сопорозного сознания при отсутствии менингеальных знаков, асимметрии сухожильных рефлексов ребенку была проведена люмбальная пункция с обследованием ликвора на внутриутробные инфекции. Назначена антиконвульсантная терапия препаратом вальпроевой кислоты. Бактериологическое исследование крови и ликвора, мазок из зева патогенной микрофлоры не обнаружили, результаты ПЦР-диагностики на врожденные ТОRСН-инфекции были отрицательными, прокальцитонин, биохимические показатели ликвора, показатели гормонального профиля щитовидной железы, кортизола были в пределах возрастных референсных значений.
При поступлении в ГАУЗ «ДРКБ МЗ РТ» (Казань) состояние оценивалось как крайне тяжелое. Ребенок угнетен, вялый. Спонтанная двигательная активность снижена, мышечный тонус значительно снижен, рефлексы резко угнетены, сухожильные рефлексы S≥D, зрачки D=S, фотореакция сомнительная. Грудная клетка правильной формы, с умеренным западением грудины, втяжением межреберий. Дыхание аппаратное, самостоятельное отсутствует. Тоны сердца ритмичные, приглушены с тенденцией к брадикардии, частота сердечных сокращений 116 в 1 мин. Паренхиматозные органы не увеличены. С учетом клонико-тонических судорог с рождения, сопорозного сознания при отсутствии менингеальных знаков, асимметрии сухожильных рефлексов ребенку была проведена люмбальная пункция с обследованием ликвора на внутриутробные инфекции. Назначена антиконвульсантная терапия препаратом вальпроевой кислоты. Бактериологическое исследование крови и ликвора, мазок из зева патогенной микрофлоры не обнаружили, результаты ПЦР-диагностики на врожденные ТОRСН-инфекции были отрицательными, прокальцитонин, биохимические показатели ликвора, показатели гормонального профиля щитовидной железы, кортизола были в пределах возрастных референсных значений.
Через 14 дней появилось самостоятельное дыхание, ребенок был снят с аппарата ИВЛ. Несмотря на противосудорожную терапию препаратом вальпроевой кислоты с постепенным увеличением дозы с 20 до 30 мг/кг/сут, у ребенка сохранялся судорожный синдром в виде зажмуривания глаз, оперкулярных движений языка, клонических подергиваний рук и туловища, клонусов стоп, пареза взора. Наблюдались глазодвигательные нарушения в виде сходящегося/расходящегося косоглазия. Мышечный тонус оставался значительно сниженным, рефлексы новорожденного были угнетены. Получал кормление через зонд адаптированной молочной смесью. Отсутствие эффекта от антиконвульсантной терапии позволило заподозрить эпилепсию генетического генеза. Вальпроевая кислота была заменена на фенобарбитал. В литературе имеются данные об усилении судорожного синдрома, связанного с приемом вальпроатов, в результате транзиторного (вторичного) снижения активности ферментов GCS в печени. Подобные изменения могут встречаться при пропионовой, метилмалоновой, изовалериановой ацидемиях [7, 15, 21]. Для исключения данных состояний были проведены исследования органических кислот в моче, вальпроевой кислоты в крови и моче. Уровень вальпроевой кислоты в крови составил 18 мкг/мл (норма 50–100 мкг/мл), в моче не обнаружена. С целью диагностики наследственных болезней обмена была проведена тандемная масс-спектрометрия, выявлено повышение уровня глицина в плазме крови до 1213 мкМ/л при норме 1060 мкМ/л. Содержание глицина в СМЖ составило 31,579 мкМ/л (норма <20 мкМ/л), а соотношение ликвор/плазма равнялось 0,186 при норме менее 0,06. Динамика показателей нейросонографии характеризовалась умеренным повышением гидрофильности тканей, слабой выраженностью рисунка извилин и борозд, субвентрикулярными уплотнениями с обеих сторон, наличием многокамерных псевдокист справа и слева. Контуры мозжечка визуализировались хорошо. Пульсация сосудов была в норме. Структура вещества мозга неоднородная крупнозернистая. По результатам ЭЭГ определялась мультифокальная эпилептиформная активность на фоне значительного замедления фоновой активности с полиморфными комплексами «острая — медленная волна», «пик — волна» с периодами ЭЭГ-паттерна «вспышка — подавление».
Для исключения данных состояний были проведены исследования органических кислот в моче, вальпроевой кислоты в крови и моче. Уровень вальпроевой кислоты в крови составил 18 мкг/мл (норма 50–100 мкг/мл), в моче не обнаружена. С целью диагностики наследственных болезней обмена была проведена тандемная масс-спектрометрия, выявлено повышение уровня глицина в плазме крови до 1213 мкМ/л при норме 1060 мкМ/л. Содержание глицина в СМЖ составило 31,579 мкМ/л (норма <20 мкМ/л), а соотношение ликвор/плазма равнялось 0,186 при норме менее 0,06. Динамика показателей нейросонографии характеризовалась умеренным повышением гидрофильности тканей, слабой выраженностью рисунка извилин и борозд, субвентрикулярными уплотнениями с обеих сторон, наличием многокамерных псевдокист справа и слева. Контуры мозжечка визуализировались хорошо. Пульсация сосудов была в норме. Структура вещества мозга неоднородная крупнозернистая. По результатам ЭЭГ определялась мультифокальная эпилептиформная активность на фоне значительного замедления фоновой активности с полиморфными комплексами «острая — медленная волна», «пик — волна» с периодами ЭЭГ-паттерна «вспышка — подавление». МРТ головного мозга выявила незавершенную миелинизацию, выраженное уменьшение объема больших полушарий, кистозные изменения, углубление и обеднение рисунка корковых борозд. Мозолистое тело истончено, растянуто. В возрасте 19 дней ребенок перенес пневмонию, осложнившуюся ателектазом верхней доли справа. В течение последующих 4 мес. наблюдения и лечения состояние пациента оставалось тяжелым за счет грубого неврологического дефицита, постоянной респираторной поддержки после перенесенной пневмонии. Сохранялось сомнительное сознание, пассивное положение тела, минимальные движения в конечностях; зрачки равные, фотореакция сохранена. В ответ на тактильное раздражение — вялое шевеление, спонтанное открывание глаз. Сохранялись эпизоды судорог в виде подергиваний мимических мышц и конечностей клонического характера на фоне сочетанного лечения антиконвульсантными препаратами (фенобарбитал + леветирацетам). Ребенок получал адаптированную молочную смесь через зонд, питание усваивал недостаточно.
МРТ головного мозга выявила незавершенную миелинизацию, выраженное уменьшение объема больших полушарий, кистозные изменения, углубление и обеднение рисунка корковых борозд. Мозолистое тело истончено, растянуто. В возрасте 19 дней ребенок перенес пневмонию, осложнившуюся ателектазом верхней доли справа. В течение последующих 4 мес. наблюдения и лечения состояние пациента оставалось тяжелым за счет грубого неврологического дефицита, постоянной респираторной поддержки после перенесенной пневмонии. Сохранялось сомнительное сознание, пассивное положение тела, минимальные движения в конечностях; зрачки равные, фотореакция сохранена. В ответ на тактильное раздражение — вялое шевеление, спонтанное открывание глаз. Сохранялись эпизоды судорог в виде подергиваний мимических мышц и конечностей клонического характера на фоне сочетанного лечения антиконвульсантными препаратами (фенобарбитал + леветирацетам). Ребенок получал адаптированную молочную смесь через зонд, питание усваивал недостаточно.
Клиническое течение заболевания, результаты лабораторных и инструментальных исследований дали основание выставить диагноз: «ГЭп, неонатальная тяжелая форма. Симптоматическая эпилепсия. Грубая задержка психомоторного развития». При отсутствии положительной динамики проводимой терапии ребенок был переведен на паллиативное лечение.
Симптоматическая эпилепсия. Грубая задержка психомоторного развития». При отсутствии положительной динамики проводимой терапии ребенок был переведен на паллиативное лечение.
Обсуждение
Неонатальные формы некетотической энцефалопатии проявляются характерной прогрессирующей вялостью, миоклоническими судорогами и апноэ с первых часов и дней после рождения [5, 7] с последующим формированием грубой задержки психомоторного развития. В представленном нами случае наблюдались все компоненты данного заболевания. Появление судорожного синдрома в раннем неонатальном периоде может наблюдаться при нарушении обмена ряда органических кислот [7, 15, 21], при инфекционном или травматическом повреждении мозга. Однако проведенные дополнительные исследования крови и мочи, исследование ликвора, данные нейросонографии отвергли инфекционную природу судорожного синдрома и позволили предположить их генетическую природу у данного больного. Выявленные изменения на ЭЭГ и МРТ головного мозга в нашем случае согласуются с данными литературы и позволяют прогнозировать тяжелую ГЭп у новорожденных с чувствительностью 60–70% [11, 22]. Патология мозолистого тела и клинические проявления — наиболее частые характерные признаки тяжелой ГЭп [17]. Согласно данным литературы, в качестве предикторов тяжелой ГЭп выделяют [6]: появление симптомов в первую неделю заболевания, высокие концентрации глицина в ЦСЖ, пороки развития головного мозга на МРТ и повышенный глициновый индекс, что наблюдалось в нашем случае. Мультикистозная трансформация мозга с последующим развитием гидроцефалии, выявленная у нашего больного, согласуется с данным литературы, характеризующими тяжелую ГЭп [7, 17]. У пациентов с классической формой заболевания часто встречаются фармакорезистентные формы эпилепсии, которые требуют назначения трех и даже четырех противоэпилептических препаратов. Ввиду гетерогенности эпилептических припадков при ГЭп в неонатальном периоде положительный эффект отмечается при лечении фенобарбиталом и леветирацетамом [22]. Однако полного купирования судорожного синдрома при лечении данными препаратами у нашего пациента достигнуто не было.
Патология мозолистого тела и клинические проявления — наиболее частые характерные признаки тяжелой ГЭп [17]. Согласно данным литературы, в качестве предикторов тяжелой ГЭп выделяют [6]: появление симптомов в первую неделю заболевания, высокие концентрации глицина в ЦСЖ, пороки развития головного мозга на МРТ и повышенный глициновый индекс, что наблюдалось в нашем случае. Мультикистозная трансформация мозга с последующим развитием гидроцефалии, выявленная у нашего больного, согласуется с данным литературы, характеризующими тяжелую ГЭп [7, 17]. У пациентов с классической формой заболевания часто встречаются фармакорезистентные формы эпилепсии, которые требуют назначения трех и даже четырех противоэпилептических препаратов. Ввиду гетерогенности эпилептических припадков при ГЭп в неонатальном периоде положительный эффект отмечается при лечении фенобарбиталом и леветирацетамом [22]. Однако полного купирования судорожного синдрома при лечении данными препаратами у нашего пациента достигнуто не было. Молекулярно-генетическое исследование в данном случае не выявило вероятных патогенных нуклеотидных вариантов генов, ассоциированных с развитием наследственных болезней обмена веществ. Спектр мутаций может иметь обширную внутригенную молекулярную гетерогенность в классической ГЭп, включая 78 новых мутаций в гене GLDC и 18 новых мутаций в AMT. Из-за ограничений метода массового параллельного секвенирования покрытие ряда генов при анализе не всегда является полным, поэтому некоторые мутации могут быть не выявлены. Имеются данные литературы об отсутствии идентификации мутаций GLDC стандартным методом секвенирования экзонов ввиду их значительного количества. Примерно у 4% пациентов с недостаточной активностью фермента GCS мутации в GLDC или AMT не выявляются [5, 18].
Молекулярно-генетическое исследование в данном случае не выявило вероятных патогенных нуклеотидных вариантов генов, ассоциированных с развитием наследственных болезней обмена веществ. Спектр мутаций может иметь обширную внутригенную молекулярную гетерогенность в классической ГЭп, включая 78 новых мутаций в гене GLDC и 18 новых мутаций в AMT. Из-за ограничений метода массового параллельного секвенирования покрытие ряда генов при анализе не всегда является полным, поэтому некоторые мутации могут быть не выявлены. Имеются данные литературы об отсутствии идентификации мутаций GLDC стандартным методом секвенирования экзонов ввиду их значительного количества. Примерно у 4% пациентов с недостаточной активностью фермента GCS мутации в GLDC или AMT не выявляются [5, 18].
Заключение
Глициновая энцефалопатия — тяжелое заболевание, связанное с накоплением аминокислоты во всех клетках организма, включая головной мозг. Нарушение метаболизма глицина приводит к необратимым изменениям в головном мозге. Диагностика заболевания затруднена в связи с его редкой встречаемостью, клиническими проявлениями, сходными с таковыми у инфекционных заболеваний, эпилепсии, детского церебрального паралича. Для точной и своевременной диагностики требутся проведение тандемной масс-спектрометрии и полное экзомное секвенирование.
Диагностика заболевания затруднена в связи с его редкой встречаемостью, клиническими проявлениями, сходными с таковыми у инфекционных заболеваний, эпилепсии, детского церебрального паралича. Для точной и своевременной диагностики требутся проведение тандемной масс-спектрометрии и полное экзомное секвенирование.
Гипоксически-ишемическая энцефалопатия (ГИЭ) | Блаженство
Дом
О вашем ребенке
Медицинские условия
Гипоксически-ишемическая энцефалопатия (ГИЭ)
Узнайте о гипоксически-ишемической энцефалопатии (ГИЭ), признаках и лечении.
Гипоксически-ишемическая энцефалопатия (ГИЭ) может быть диагностирована, если мозг вашего ребенка не получает достаточного количества кислорода и/или кровотока во время рождения. Вы можете услышать, что это называется «асфиксия», «асфиксия при рождении» или «перинатальная асфиксия». Низкий уровень кислорода и/или притока крови к мозгу ребенка чаще всего возникает до или во время родов, но также может произойти вскоре после рождения.
ГИЭ поражает головной мозг, но последствия низкого содержания кислорода или кровотока могут также вызвать проблемы с легкими, печенью, сердцем, кишечником и почками.
При диагностике ГИЭ классифицируют как легкую, среднюю или тяжелую. Если ГИЭ оценивается как умеренная или тяжелая, это может привести к длительной инвалидности, а в некоторых случаях, к сожалению, к смерти. У нас есть дополнительная информация о принятии решений по оказанию неотложной помощи, паллиативной помощи и тяжелой утрате, а также ссылки на некоторые дополнительные источники поддержки ниже на этой странице.
Если у вашего ребенка диагностировали ГИЭ, у вас, вероятно, возникнет множество вопросов о том, чем это вызвано, какое лечение потребуется вашему ребенку и как это состояние может повлиять на него в долгосрочной перспективе. Поговорите с персоналом, ухаживающим за вашим ребенком, если у вас есть вопросы или вам нужно что-то еще раз объяснить. Они будут рады помочь.
Что вызывает ГИЭ?
Не всегда возможно узнать, что вызывает ГИЭ. Это может быть вызвано осложнениями во время родов, такими как следующие:
- Слишком раннее отделение плаценты от стенки матки (отслойка плаценты).
- Разрыв матки (разрыв матки).
- Необычно продолжительные роды (затяжные роды).
- Плечи вашего ребенка застревают за лобковой костью во время родов (плечевая дистоция).
Если вы не уверены, что могло вызвать ГИЭ, поговорите с командой, ухаживающей за вашим ребенком, для получения дополнительной информации.
Каковы признаки ГИЭ?
ГИЭ обычно диагностируется в первые несколько дней после рождения. Врач поставит диагноз на основании определенных признаков, которые различаются в зависимости от степени тяжести заболевания.
Врач поставит диагноз на основании определенных признаков, которые различаются в зависимости от степени тяжести заболевания.
Врачи будут искать у вашего ребенка некоторые из следующих признаков:
- Повышенная бдительность — ребенок может казаться слишком бодрствующим, даже если он мало спит.
- Раздражительны – могут перестать любить шум, прикосновения и свет.
- Чрезмерная сонливость.
- Быть гибким или жестким.
- Необычные движения или судороги.
- Задержки дыхания (апноэ).
- Пониженный уровень осознания или реакции.
При постановке диагноза ГИЭ классифицируют как легкую, среднюю или тяжелую. Степень ГИЭ определит лечение, рекомендованное вашему ребенку.
Какие анализы могут быть сделаны моему ребенку?
Если медицинские работники вашего ребенка обеспокоены или диагностируют ГИЭ у вашего ребенка, они могут назначить дополнительные анализы.
Они могут включать (но не ограничиваться) следующее:
- Мониторинг церебральной функции (CFM) – CFM использует датчики для записи мозговой активности.
 Он используется для демонстрации раннего воздействия ГИЭ на мозг вашего ребенка, а также может использоваться для принятия решения о том, нуждается ли ваш ребенок в терапевтической гипотермии (охлаждении).
Он используется для демонстрации раннего воздействия ГИЭ на мозг вашего ребенка, а также может использоваться для принятия решения о том, нуждается ли ваш ребенок в терапевтической гипотермии (охлаждении). - Ультразвуковое сканирование головы (УЗИ черепа) — Ультразвуковое сканирование головы используется для просмотра изображений головного мозга вашего ребенка. Его можно использовать для выявления таких проблем, как кровотечение, инсульт или опухоль.
- МРТ — МРТ использует магнетизм для создания очень подробной картины областей мозга вашего ребенка. Он используется, чтобы увидеть, был ли нанесен какой-либо ущерб мозгу вашего ребенка. Обычно это выполняется после обработки охлаждением (см. ниже).
Большинство детей с легкой ГИЭ быстро выздоравливают. Если у вашего ребенка ГИЭ легкой степени тяжести, врачи будут внимательно наблюдать за ним, чтобы убедиться, что его состояние стабильно и ему не требуется дальнейшее лечение.
Если у вашего ребенка ГИЭ средней или тяжелой степени, существует риск смерти или длительного повреждения головного мозга.
Чтобы снизить этот риск, дети с ГИЭ средней или тяжелой степени, как правило, получают лечение, называемое терапевтической гипотермией или охлаждением, которое необходимо начинать в течение первых 6 часов после рождения. Специальный охлаждающий матрас используется для снижения температуры тела ребенка до 33-34 градусов по Цельсию в течение 72 часов. Матрас наполнен жидкостью, которую можно охлаждать или нагревать в зависимости от потребностей вашего ребенка.
Температуру вашего ребенка будут тщательно контролировать, чтобы убедиться, что она остается на нужном уровне, и охлаждение обычно продолжается в течение 72 часов, прежде чем снова согреть. Ваш ребенок будет согрет в течение 12 часов. Во время периода охлаждения команда также будет внимательно следить за частотой сердечных сокращений и артериальным давлением вашего ребенка, выполнять анализы крови и использовать CFM. Они также будут следить за лекарствами вашего ребенка и при необходимости дадут обезболивающее.
Они также будут следить за лекарствами вашего ребенка и при необходимости дадут обезболивающее.
Некоторые родители обеспокоены тем, что они не смогут держать ребенка на руках или прикасаться к нему кожей во время процедуры охлаждения. Возможно, вы сможете держать ребенка или прикасаться к нему во время охлаждения, но это зависит от того, насколько плохо себя чувствует ваш ребенок и какое оборудование к нему прикреплено. Поговорите с врачом или медсестрой вашего ребенка, если у вас есть какие-либо вопросы или опасения.
В это время вы также можете помочь своему ребенку, сцеживая грудное молоко, разговаривая и читая ему.
Исследования показывают, что охлаждение может принести пользу некоторым детям с ГИЭ средней или тяжелой степени, рожденным после 36 недель, и снизить риск долговременной инвалидности. Мы понимаем, что знание того, что вашему ребенку предстоит такое лечение, может быть пугающим.
Вы можете задать следующие вопросы команде, ухаживающей за вашим ребенком:
- Что включает в себя охлаждение?
- Каковы преимущества охлаждения?
- Существуют ли риски охлаждения и насколько они вероятны?
- Какой уход потребуется моему ребенку после лечения?
- Что может случиться, если мой ребенок не получит лечение?
- Как лечение повлияет на дальнейшее развитие моего ребенка?
Если у вас есть какие-либо опасения или вопросы, всегда важно поговорить с командой, присматривающей за вашим ребенком. Они здесь, чтобы помочь.
Они здесь, чтобы помочь.
Каковы долгосрочные последствия ГИЭ?
В то время как некоторые дети с ГИЭ полностью выздоравливают и не имеют долгосрочных проблем, у других могут возникнуть трудности, требующие помощи и поддержки со стороны медицинских работников, таких как физиотерапевты или логопеды.
Если вашему ребенку была проведена процедура охлаждения, вы встретитесь с лечащим врачом, чтобы обсудить результаты МРТ вашего ребенка. Они также расскажут вам о поведении и прогрессе вашего ребенка. Это будет использовано для составления плана дальнейшей оценки и последующих действий. Количество встреч с вашим ребенком будет зависеть от его потребностей.
Все дети, перенесшие ГИЭ, нуждаются в тщательном наблюдении за их развитием, особенно в течение первых 2 лет жизни.
Когда вашему ребенку будет от 18 месяцев до 2 лет, медицинский работник будет наблюдать за прогрессом вашего ребенка в следующих областях его развития:
- Моторика (способность вашего ребенка передвигаться, удерживать и хватать предметы) .

- Сенсорная (зрение, осязание, вкус, обоняние и слух вашего ребенка).
- Language (способность вашего ребенка общаться и понимать язык).
- Познание (как ваш ребенок учится думать и рассуждать).
Это обследование может помочь лучше понять, как развивается ваш ребенок, и ответить на любые вопросы, которые могут у вас возникнуть.
У некоторых детей развивается церебральный паралич — физическое состояние, влияющее на движения, осанку и координацию. У некоторых детей могут развиться проблемы со зрением и слухом, трудности в обучении или поведении. У некоторых детей развивается эпилепсия — состояние, которое поражает мозг и вызывает судороги.
Осознание того, что у вашего ребенка могут быть длительные проблемы в результате ГИЭ, поначалу может пугать и подавлять, но поддержка доступна. Внизу этой страницы мы перечислили некоторые организации и источники поддержки, которые могут помочь.
К сожалению, некоторые младенцы умирают от ГИЭ. У нас есть дополнительная информация о принятии решений по оказанию неотложной помощи, паллиативной помощи и тяжелой утрате, а также ссылки на некоторые дополнительные источники поддержки ниже на этой странице.
Где я могу получить дополнительную помощь и поддержку?
Нахождение ребенка в отделении интенсивной терапии или специального ухода может быть стрессовым опытом. Болезненный ребенок может заставить вас чувствовать, что вы не контролируете ситуацию. Некоторые родители испытывают горе или утрату, когда теряют надежды и планы, которые у них были, или отказываются от них. Рождение ребенка с ГИЭ всегда неожиданно.
То, как вы себя чувствуете и переживаете то, что с вами произошло, может отличаться от того, как другие люди сталкиваются с такими проблемами. Такое чувство очень распространено.
Если вы не уверены в какой-либо части диагноза, лечения или ухода за вашим ребенком, персонал отделения поможет вам всем, чем сможет. Можно спросить еще раз, если вам нужно повторить или уточнить информацию. Команда поймет и захочет поддержать вас.
Можно спросить еще раз, если вам нужно повторить или уточнить информацию. Команда поймет и захочет поддержать вас.
Мы включили несколько ссылок на благотворительные организации и организации, которые могут оказать дополнительную поддержку. Веб-сайты социальных сетей, такие как Facebook, также могут предоставлять информацию о местных группах поддержки и благотворительных организациях, где вы можете поговорить с другими родителями, у которых есть ребенок с ГИЭ. Ваше подразделение также может предоставить вам эту информацию. Если вам нужно с кем-то поговорить, вы также можете связаться с нами по адресу [email protected] или договориться о видеозвонке с одним из наших волонтеров.
- Благотворительный фонд Peeps HIE — оказывает поддержку родителям, пострадавшим от HIE, и повышает осведомленность.
- Hope for HIE — Работает над улучшением качества жизни детей и семей, пострадавших от HIE, с помощью полезных ресурсов и поддержки.
- Ассоциация родовых травм.
 Оказывает поддержку женщинам, пережившим травматические роды.
Оказывает поддержку женщинам, пережившим травматические роды. - The Rainbow Trust — Оказывает эмоциональную и практическую поддержку семьям, у которых есть ребенок с опасным для жизни или неизлечимым заболеванием.
- Sands — благотворительная организация, которая поддерживает всех, кого затронула смерть ребенка.
- Scope — Благотворительная организация, которая поддерживает инвалидов и их семьи посредством практической информации и поддержки, особенно во время постановки диагноза.
- «Вместе на короткую жизнь» — благотворительная организация для детей с опасными и неизлечимыми состояниями.
- Действия по борьбе с эпилепсией – Предоставляет советы и поддержку всем, кто страдает эпилепсией.
Сопутствующее содержимое
Ищете что-то еще в этом разделе?
Гипоксически-ишемическая энцефалопатия (ГИЭ) » Неврологическая сеть новорожденных Флориды
Условия
- Гипоксический (hi – poksick) = недостаток кислорода
- Ишемический (Isskeymick) = недостаточный кровоток
- Энцефалопатия (Encef-a- lop-athee) = черепно-мозговая травма/дисфункция
- Гипотермия (Гипотермия) = охлаждение
- Преэклампсия = Состояние во время беременности, характеризующееся высоким кровяным давлением.

- Церебральный паралич = Состояние, характеризующееся нарушением мышечной координации и/или другими нарушениями.
- Томография = Техника, используемая для отображения поперечного сечения тела человека с помощью рентгеновских лучей или ультразвука.
Что такое гипоксически-ишемическая энцефалопатия?
- Под гипоксией понимается снижение снабжения кислородом органов, включая головной мозг.
- Ишемия относится к недостаточному кровоснабжению органов.
- Энцефалопатия — термин, используемый для описания любой формы общей дисфункции головного мозга.
- Гипоксически-ишемическая энцефалопатия (или ГИЭ) — это неспецифический термин для обозначения дисфункции головного мозга, вызванной недостатком притока крови и кислорода к мозгу.
- Иногда ГИЭ также называют родовой асфиксией, но этот термин относится только к очень строгим критериям новорожденных с черепно-мозговой травмой.

Как и когда возникает ГИЭ?
Существует множество проблем во время беременности, родов, родов и после родов, которые могут вызвать ГИЭ. Однако во многих случаях причина ГИЭ неизвестна.
Возможные проблемы во время беременности:
Преэклампсия, диабет матери с сосудистыми заболеваниями, врожденные инфекции плода, злоупотребление наркотиками и алкоголем, тяжелая анемия плода, пороки сердца, пороки развития легких, проблемы с кровотоком в плаценте.
Проблемы во время родов:
Аварии пуповины, разрыв плаценты или матки, чрезмерное кровотечение из плаценты, неправильное положение плода, затяжные поздние периоды родов, очень низкое кровяное давление у матери (вызванное лекарствами, кровотечением, анестезией)
Проблемы после доставки:
Тяжелая недоношенность, тяжелое заболевание легких или сердца, серьезные инфекции (особенно менингит или сепсис), травма головного мозга или черепа, врожденные пороки развития головного мозга, очень низкое кровяное давление у ребенка.
Насколько распространена ГИЭ?
Что касается доношенных детей, ГИЭ встречается примерно у 3-20 на 1000 живорождений. У недоношенных детей ГИЭ встречается у 60% живорожденных.
Какие возможны долгосрочные проблемы у детей с ГИЭ?
Инвалидность младенцев с ГИЭ проявляется по мере их роста в зависимости от тяжести ГИЭ. В то время как младенцы с легкой ГИЭ практически не проявляют долговременной инвалидности, младенец, который страдал ГИЭ от умеренной до тяжелой степени, может умереть в период новорожденности или иметь заболевания, включая церебральный паралич, умственную отсталость, трудности с кормлением, трудности в обучении, нарушения зрения или слуха и припадки.
Как диагностируется ГИЭ?
Диагноз ГИЭ ставится после рождения ребенка и наблюдения в течение нескольких дней. Клинические, лабораторные и радиологические инструменты помогают в диагностике ГИЭ. Иногда есть признаки того, что младенец был в бедственном положении до рождения.
Некоторые из маркеров, которые помогают в постановке диагноза ГИЭ, включают:
До рождения:
- Измерения движений плода и/или вариабельности сердечного ритма до рождения.
- Наличие мекония (первый стул ребенка) в амниотической жидкости. Это плохой предиктор повышенного риска ГИЭ, но может указывать на то, что плод находился в дистрессе до рождения.
Клиническая оценка:
- Шкала APGAR (баллы, присваиваемые младенцам после рождения как мера благополучия младенца)
- Оценка по шкале Апгар, остающаяся низкой в течение более 10 минут, может коррелировать с тяжестью ГИЭ.
- Для постановки диагноза ГИЭ необходимы отклонения от нормы при неврологическом обследовании. Некоторые из аномальных результатов физического осмотра:
- Изменения психического состояния (снижение бдительности)
- Повышение или снижение мышечного тонуса
- Судороги
- Аномальные зрачки
- Изменения рефлексов
- Изменения дыхания и частоты сердечных сокращений
902 85
- Экзамен повторяется 2-3 раза в день в течение первых нескольких дней жизни, чтобы помочь врачу определить, улучшается или ухудшается состояние младенца.

- ЭЭГ: электроды помещаются на кожу головы младенца для оценки электрической активности мозга. Обнаружение ЭЭГ может помочь определить судорожную активность, а также может коррелировать с исходом у младенца. Данные ЭЭГ считывает детский невролог.
Лабораторная оценка:
Анализы крови могут выявить наличие повреждений других органов, вызванных ГИЭ. Это связано с тем, что снижение кровотока и кислорода может повлиять на все органы, а не только на мозг. Почки, печень, сердце и легкие являются наиболее распространенными органами, поражаемыми при ГИЭ. Образцы пуповинной крови могут показать повышенное накопление кислоты. Это может быть признаком того, что ребенок был в бедственном положении до рождения.
Радиологическая оценка:
Визуализация головного мозга с использованием УЗИ, КТ (компьютерной томографии) и МРТ (магнитно-резонансной томографии) может использоваться для оценки основного порока развития головного мозга и поиска признаков повреждения головного мозга. В настоящее время МРТ является наиболее чувствительным способом поиска повреждений головного мозга, но младенец может быть слишком болен для транспортировки на МРТ или может не переносить длительное время сканирования (примерно 45 минут).
В настоящее время МРТ является наиболее чувствительным способом поиска повреждений головного мозга, но младенец может быть слишком болен для транспортировки на МРТ или может не переносить длительное время сканирования (примерно 45 минут).
Существуют ли разные стадии или степени ГИЭ?
ГИЭ может быть классифицирована как легкая, умеренная или тяжелая на основании неврологического обследования младенца. Эта система классификации называется классификацией Сарната и может быть полезна для прогнозирования долгосрочного неврологического риска.
Как лечить ГИЭ?
К сожалению, окончательного лечения детей с ГИЭ не существует. Большинство методов лечения направлены на поддержку пораженных органов младенца, в том числе:
- Поддержка сердца и артериального давления
- Поддержание функции почек и печени
- Механическая вентиляция легких может потребоваться, если младенец не может полностью дышать самостоятельно Было доказано, что гипотермия головного мозга или всего тела (охлаждение температуры тела младенца примерно до 33,5 градусов по Цельсию или 92 градуса по Фаренгейту) в течение 3 дней снижает риск долгосрочных нарушений развития нервной системы.
 См. раздел ниже о гипотермии.
См. раздел ниже о гипотермии.Гипотермия или охлаждение мозга для лечения ГИЭ:
Единственная специфическая для головного мозга терапия ГИЭ, которая, как было доказано, снижает риск долгосрочных нарушений развития нервной системы, — это гипотермия головного мозга или всего тела (охлаждение температуры тела младенца на 3–4 градуса примерно до 33,5 градусов по Цельсию или 92 градусов по Фаренгейту).
Какие младенцы подлежат охлаждению?
- Младенцы с ГИЭ средней и тяжелой степени, не легкие случаи
- У младенца не может быть другой причины мозговой дисфункции, такой как порок развития головного мозга или кровоизлияние в мозг.
- Только младенцы в возрасте до 6 часов. Лабораторные исследования показывают, что после 6 часов жизни охлаждение при ГИЭ не приносит пользы.
Где проводится охлаждение мозга?
Охлаждение проводится только в специализированных опытных третичных отделениях интенсивной терапии новорожденных (это высший уровень медицинской помощи младенцам).

Как осуществляется охлаждение?
- Младенцы охлаждаются либо с помощью охлаждающего одеяла, которое жестко регулирует температуру тела младенца, либо с помощью охлаждающего колпачка, который надевается непосредственно на голову младенца.
- Было показано, что оба метода охлаждения эффективны при лечении младенцев с ГИЭ. Используемый метод зависит от больницы, в которой лечится младенец. Смотрите фотографии охлаждающего одеяла и охлаждающей шапки ниже.
- Охлаждение происходит в течение 72 часов или 3 дней. По истечении этого времени температура тела ребенка медленно повышается до нормального температурного значения.
Помогает ли охлаждение всем детям с ГИЭ?
К сожалению, охлаждение помогает примерно 1 из 8 детей с ГИЭ средней и тяжелой степени. В настоящее время, когда врач начинает процесс охлаждения, невозможно узнать, какие дети получат пользу от охлаждения, а какие нет. В настоящее время в этой области продолжаются дальнейшие исследования.

Безопасно ли охлаждение?
На сегодняшний день опубликованы клинические испытания с участием более 550 младенцев для оценки преимуществ охлаждения при ГИЭ. Эти испытания продемонстрировали, что охлаждение для защиты головного мозга у младенцев с ГИЭ средней и тяжелой степени является как полезным, так и безопасным. Однако в этих испытаниях были отмечены некоторые потенциальные побочные эффекты охлаждения: изменения кожи, которые со временем исчезли, более широкое использование лекарств от артериального давления и небольшое снижение способности крови к свертыванию.
Каков прогноз (исход) для младенцев с ГИЭ?
Исход для младенцев с ГИЭ обычно определяется тяжестью или классификацией ГИЭ; легкой, средней или тяжелой степени. Другие показатели, такие как результаты МРТ и ЭЭГ, также могут помочь в прогнозировании исхода.
Прогноз на основании клинической классификации следующий:
- Легкая форма ГИЭ: Менее 5% этих младенцев будут иметь серьезную инвалидность.

- Умеренный ГИЭ: От 25% до 75% этих младенцев будут иметь серьезные недостатки или могут умереть в раннем возрасте.
- Тяжелая ГИЭ: 75% или более таких младенцев будут иметь серьезную инвалидность или могут умереть в раннем возрасте.
Как родители могут помочь своему ребенку с ГИЭ, когда он вернется домой?
Одним из наиболее важных аспектов ухода за младенцем с ГИЭ является беседа с лечащим врачом вашего ребенка и понимание потребностей вашего ребенка после выписки из больницы. Следующее может помочь родителям при подготовке к выписке домой:
- Узнайте о плане кормления вашего младенца: тип смеси или грудного молока, количество, необходимое вашему ребенку для роста, как часто происходит кормление, ест ли ваш ребенок полностью через рот или у него есть зонд для кормления?
- Вашему ребенку нужно специальное сиденье? Во время выписки ребенку может понадобиться специальное автокресло.

- Какие лекарства нужны вашему ребенку? Количество или доза, время приема лекарств, способ их приема и причины их применения.
- Какие последующие приемы у вашего ребенка? Ниже приведены некоторые общие приемы, необходимые для младенцев с ГИЭ: педиатр, детский невролог, если у вашего ребенка судороги, занятия и/или физиотерапия, оценка слуха и зрения.
- Младенцы с ГИЭ подвержены более высокому риску развития двигательных проблем, таких как церебральный паралич. Ранняя реабилитация с детским трудотерапевтом и физиотерапевтом рекомендуется, чтобы помочь вашему ребенку полностью раскрыть свой потенциал.
- Терапевт может обучить семью домашних упражнений и терапии младенца, которые еще больше улучшат его развитие.
Какие исследования проводятся для лечения или профилактики ГИЭ?
В области ГИЭ проводится большое количество исследований. Многочисленные исследования оценивают использование различных лекарств, которые могут защитить мозг младенца до рождения и после ГИЭ.


 9 Результаты научных исследований в области перинатальной энцефалопатии
9 Результаты научных исследований в области перинатальной энцефалопатии