Беременность и миастения: Миастения и беременность — справочник болезней — ЗдоровьеИнфо
Миастения и беременность
10.04.2023
Миастения — аутоиммунное нервно-мышечное заболевание, проявляющееся повышенной утомляемостью скелетных мышц. Причиной заболевания являются аутоантитела, блокирующие связывание ацетилхолина с никотиновым рецептором на мышечной структуре, тем самым препятствуя передаче импульсов от нервного окончания к мышце, что приводит к невозможности мышечного сокращения. Чаще всего поражаются мышцы, приводящие в движение глазные яблоки, что проявляется появлением двоения в глазах и опущением век, а также жевательные мышцы и мускулатура глотки, что приводит к нарушениям пережевывания и глотания пищи и затруднениям речи.
Заболевание может поражать мышцы конечностей и туловища вплоть до самых тяжелых форм, при которых поражается дыхательная мускулатура, что приводит к проблемам с дыханием. Миастения встречается у обоих полов в любом возрасте, хотя у женщин чаще всего в возрасте от 20 до 30 лет, а у мужчин чаще после 50 лет. Учитывая, что она возникает у женщин в репродуктивном возрасте, особое внимание следует уделить планированию и наблюдению за беременностью и родами, а также перинатальному уходу за ребенком.
Учитывая, что она возникает у женщин в репродуктивном возрасте, особое внимание следует уделить планированию и наблюдению за беременностью и родами, а также перинатальному уходу за ребенком.
Течение миастении во время беременности непредсказуемо, и предыдущие исследования показали, что беременность сама по себе не оказывает прямого влияния на течение заболевания. Однако из-за изменения анатомических взаимосвязей часто возникают проблемы с дыханием, а из-за иммунологических изменений и более частых инфекций симптомы заболевания могут обостряться.
С другой стороны, у некоторых беременных симптомы заболевания уменьшаются. В некоторых исследованиях показано, что обострения заболевания чаще всего возникают в первые два года от появления симптомов, а реже всего через семь лет от появления симптомов заболевания, в связи с чем целесообразно консультировать пациенток, когда наступает наилучший период планировать беременность.
Лечение миастении во время беременности
Лечение заболевания при беременности существенно не отличается от лечения в других случаях, при этом избегают препаратов, оказывающих тератогенное действие на плод. Основой лечения является индивидуальный подход и титрование ингибиторов ацетилхолинэстеразы (пиридостигмин) до достижения оптимального контроля над симптомами заболевания. При более слабом ответе на ингибиторы ацетилхолинэстеразы применяют кортикостероиды, которые требуют особой осторожности в связи с большей частотой инфекций, а также усиленного акушерского наблюдения за внутриутробным развитием плода.
При состояниях миастенического криза, когда наблюдается резкое ухудшение симптомов заболевания и дыхательная недостаточность, проводят процедуру плазмафереза, что очень сложно и требует постоянного наблюдения за больной. Также возможно введение иммуноглобулинов.
Так как болезнь поражает скелетную мускулатуру, а матка состоит из гладкой мускулатуры, на само течение родов мышечная слабость, в первую очередь, не влияет. Однако во втором периоде родов, требующем сокращения мышц таза и брюшной стенки, беременная может истощиться, и возникнет необходимость в оперативном завершении родов. Из-за вышеизложенного роды у беременной с миастенией требуют особой осторожности, включающей повышенное наблюдение со стороны акушеров, неврологов и анестезиологов.
Однако во втором периоде родов, требующем сокращения мышц таза и брюшной стенки, беременная может истощиться, и возникнет необходимость в оперативном завершении родов. Из-за вышеизложенного роды у беременной с миастенией требуют особой осторожности, включающей повышенное наблюдение со стороны акушеров, неврологов и анестезиологов.
Пероральную терапию заменяют непрерывной внутривенной инфузией. Благодаря оптимальному подбору медикаментозной терапии и прогрессу в перинатальной помощи кесарево сечение проводят только в исключительных случаях. Одним из наиболее частых акушерских осложнений является преждевременное излитие околоплодных вод, в то время как другие осложнения, такие как преждевременные роды, низкая масса тела при рождении и врожденные аномалии, столь же распространены, как и в общей популяции. Исключением является расстройство, называемое множественным артрогрипозом, которое проявляется тугоподвижностью суставов конечностей из-за снижения мышечной активности в утробе матери.
Вследствие перехода аутоантител через плаценту из крови беременной с миастенией в кровь ребенка возникает так называемая врожденная форма миастении, которая встречается примерно у 10-20 процентов детей. Симптомы могут варьироваться от легких форм, проявляющихся снижением мышечного тонуса новорожденного, до тяжелых форм, характеризующихся проблемами дыхания и сосания. Поэтому беременность и роды беременной с миастенией следует планировать в центрах с развитой службой неонатологии, с оптимизацией медикаментозной терапии с учетом побочных эффектов и возможного неблагоприятного влияния препаратов на развитие плода.
Данная статья носит информационный характер.
Записаться на прием
Опубликовано в Беременность и ведение беременности Премиум Клиник
Страница статьи : Неврологический журнал
Щербакова Наталья Ивановна, Хрущева Н. А., Огурцова Н.Н., Шабалина А.А., Костырева М.В.
А., Огурцова Н.Н., Шабалина А.А., Костырева М.В.
DOI:
Полный текст:
- Аннотация
- Об авторах
- Список литературы
Аннотация
Проблема деторождения у больных миастенией чрезвычайно актуальна, поскольку наиболее часто заболевание поражает женщин репродуктивного возраста. До сих пор не уточнены прогностические критерии обострения миастении в период беременности и не определены предикторы развития транзиторной неонатальной миастении (ТНМ). В статье приведён анализ данных литературы с первых описаний беременности у пациенток с миастенией и ТНМ до настоящего времени. Показана эволюция от представлений о роли высокого титра антител к ацетилхолиновым рецепторам (АТ к АХР) в развитии обострений миастении у матери и ТНМ у её новорождённого как определяющей (в первые годы изучения) до современного понимания «клинической бесполезности» титра АТ. Обсуждается значение АТ к эмбриональным γ-субъединицам АХР плода в возникновении артрогрипоза и ТНМ. Подчёркивается важность подготовки больной миастенией к беременности. Проведённые наблюдения свидетельствуют, что в зависимости от степени подготовленности и качества ремиссии до беременности у одной и той же женщины миастения либо имеет благоприятное течение с рождением здорового ребёнка, либо протекает с тяжёлым обострением (вплоть до криза после родов) и развитием ТНМ у новорождённого. Кроме того, на основании данных литературы и собственного опыта показано неоспоримое значение тимэктомии (ТЭ) в профилактике обострений миастении и ТНМ. Наше наблюдение случаев ТНМ демонстрирует решающую роль прозериновой пробы в дифференциальной диагностике синдрома «вялого ребёнка». Впервые в России приводится исследование соотношения титров АТ к эмбриональным и зрелым формам АХР в пуповинной крови; а также впервые в мире представлен уникальный случай рождения здорового ребёнка у двух больных с ранним началом аутоиммунной миастении — в 16 лет у отца и в 8 лет у матери. Отца отличали тяжёлое рефрактерное течение заболевания со склонностью к предкризовым состояниям, титром АТ к АХР 20,8 нмоль/л и множество врождённых стигм дизэмбриогенеза.
Подчёркивается важность подготовки больной миастенией к беременности. Проведённые наблюдения свидетельствуют, что в зависимости от степени подготовленности и качества ремиссии до беременности у одной и той же женщины миастения либо имеет благоприятное течение с рождением здорового ребёнка, либо протекает с тяжёлым обострением (вплоть до криза после родов) и развитием ТНМ у новорождённого. Кроме того, на основании данных литературы и собственного опыта показано неоспоримое значение тимэктомии (ТЭ) в профилактике обострений миастении и ТНМ. Наше наблюдение случаев ТНМ демонстрирует решающую роль прозериновой пробы в дифференциальной диагностике синдрома «вялого ребёнка». Впервые в России приводится исследование соотношения титров АТ к эмбриональным и зрелым формам АХР в пуповинной крови; а также впервые в мире представлен уникальный случай рождения здорового ребёнка у двух больных с ранним началом аутоиммунной миастении — в 16 лет у отца и в 8 лет у матери. Отца отличали тяжёлое рефрактерное течение заболевания со склонностью к предкризовым состояниям, титром АТ к АХР 20,8 нмоль/л и множество врождённых стигм дизэмбриогенеза. У матери течение миастении являлось более мягким, она была тщательно подготовлена к беременности (ТЭ, курс глюкокортикоидов) и на момент её наступления находилась в стабильном состоянии более 10 лет. Титр АТ к АХР был относительно низким (9,0 нмоль/л), однако в пуповинной крови из общего пула АТ 92% составляли АТ к эмбриональным АХР. Из примера следует, что именно состояние матери на момент наступления беременности определяет течение миастении и риски ТНМ. Этот случай позволяет рассматривать генетические факторы как второстепенные и ещё раз подчёркивает аутоиммунную природу миастении.
У матери течение миастении являлось более мягким, она была тщательно подготовлена к беременности (ТЭ, курс глюкокортикоидов) и на момент её наступления находилась в стабильном состоянии более 10 лет. Титр АТ к АХР был относительно низким (9,0 нмоль/л), однако в пуповинной крови из общего пула АТ 92% составляли АТ к эмбриональным АХР. Из примера следует, что именно состояние матери на момент наступления беременности определяет течение миастении и риски ТНМ. Этот случай позволяет рассматривать генетические факторы как второстепенные и ещё раз подчёркивает аутоиммунную природу миастении.
Ключ. слова
миастения, беременность, транзиторная неонатальная миастения, артрогрипоз, синдром «вялого ребёнка», послеродовой миастенический криз, тимэктомия, антитела к ацетилхолиновым рецепторам (АХР), антитела к эмбриональным γ-субъединицам АХР, антитела к зрелым ε-субъединицам АХР, антитела к MuSK, α-фетопротеин (АФП), прозериновая проба
Для цитирования:
For citation:
Обратные ссылки
- Обратные ссылки не определены
Контент доступен под лицензией Creative Commons Attribution 3. 0 License.
0 License.
ISSN: (Print)
ISSN: (Online)
Лечение миастении во время беременности
1. Gilhus NE. Миастения гравис. N Engl J Med. 2016; 375:2570–81. [PubMed] [Google Scholar]
2. Carr AS, Cardwell CR, McCarron PO, McConville J. Систематический обзор популяционных эпидемиологических исследований миастении гравис. БМК Нейрол. 2010;10:46. [Бесплатная статья PMC] [PubMed] [Google Scholar]
3. Ферреро С., Эспозито Ф., Биамонти М., Бентивольо Г., Рагни Н. Миастения во время беременности. Эксперт преподобный Нейротер. 2008;8:979–88. [PubMed] [Google Scholar]
4. Ferrero S, Pretta S, Nicoletti A, Petrera P, Ragni N. Myasthenia gravis: вопросы ведения во время беременности. Eur J Obstet Gynecol Reprod Biol. 2005; 121:129–38. [PubMed] [Google Scholar]
5. Da Silva FC, do Cima LC, de Sa RA. Миастения и беременность. В: Минагар А, редактор. Неврологические расстройства и беременность. Берлингтон, Массачусетс: Elsevier; 2011. С. 55–68. [Google Scholar]
С. 55–68. [Google Scholar]
6. Chaudhry SA, Vignarajah B, Koren G. Миастения во время беременности. Кан Фам Врач. 2012; 58:1346–9. [Бесплатная статья PMC] [PubMed] [Google Scholar]
7. Berlit S, Tuschy B, Spaich S, Sütterlin M, Schaffelder R. Myasthenia gravis во время беременности: история болезни. Деловой представитель Акушер-гинеколог. 2012;2012:736024. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Batocchi AP, Majolini L, Evoli A, Lino MM, Minisci C, Tonali P, et al. Течение и лечение миастении при беременности. Неврология. 1999; 52: 447–52. [PubMed] [Google Scholar]
9. Hoff JM, Daltveit AK, Gilhus NE. Миастения при беременности и родах: выявление факторов риска, оптимизация лечения. Евр Дж Нейрол. 2007; 14:38–43. [PubMed] [Академия Google]
10. Хофф Дж.М., Далтвейт А.К., Гилхус Н.Е. Миастения гравис: последствия для беременности, родов и новорожденного. Неврология. 2003;61:1362–6. [PubMed] [Google Scholar]
11. Wolfe GI, Kaminski HJ, Aban IB, Minisman G, Kuo HC, Marx A, et al. Рандомизированное исследование тимэктомии при миастении. N Engl J Med. 2016; 375: 511–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Рандомизированное исследование тимэктомии при миастении. N Engl J Med. 2016; 375: 511–22. [Бесплатная статья PMC] [PubMed] [Google Scholar]
12. Джелмис Дж., Состарко М., Майер Д., Иванишевич М. Миастения при беременности: отчет о 69 случаях. Eur J Obstet Gynecol Reprod Biol. 2002; 104:21–5. [PubMed] [Академия Google]
13. Доминович-Ковачевич А., Илич Т., Вукоевич З. Миастения и беременность – история болезни. Curr Top Neurol Psychiatr Relat Discip. 2010;18:40–3. [Google Scholar]
14. Гур С., Диав-Цитрин О., Шехтман С., Арнон Дж., Орной А. Исход беременности после воздействия кортикостероидов в первом триместре: проспективное контролируемое исследование. Репрод Токсикол. 2004; 18:93–101. [PubMed] [Google Scholar]
15. Park-Wyllie L, Mazzotta P, Pastuszak A, Moretti ME, Beique L, Hunnisett L, et al. Врожденные дефекты после воздействия кортикостероидов на мать: проспективное когортное исследование и метаанализ эпидемиологических исследований. Тератология. 2000; 62: 385–9.2. [PubMed] [Google Scholar]
2000; 62: 385–9.2. [PubMed] [Google Scholar]
16. Gaudier FL, Santiago-Delpin E, Rivera J, Gonzales Z. Беременность после пересадки почки. Хирургический гинекологический акушер. 1988; 167: 533–43. [PubMed] [Google Scholar]
17. Armenti VT, Radomski JS, Moritz MJ, Gaughan WJ, Philips LZ, McGrory CH, et al. Отчет национального регистра трансплантационной беременности (NTPR): Исходы беременности после трансплантации. Клин транспл. 2002: 121–30. [PubMed] [Google Scholar]
18. Goldstein LH, Dolinsky G, Greenberg R, Schaefer C, Cohen-Kerem R, Diav-Citrin O, et al. Исход беременности у женщин, подвергшихся воздействию азатиоприна во время беременности. Врожденные дефекты Res A Clin Mol Teratol. 2007;79: 696–701. [PubMed] [Google Scholar]
19. Sander DB, Wolfe GI, Benatar M, Evli A, Gilhus NE, Illa I, et al. Международные согласованные рекомендации по лечению миастении. Неврология. 2016; 87: 419–25. [Бесплатная статья PMC] [PubMed] [Google Scholar]
20. Radomski JS, Ahlswede BA, Jarrell BE, Mannion J, Cater J, Moritz MJ, et al. Исходы 500 беременностей у 335 женщин, перенесших трансплантацию почек, печени и сердца. Пересадка Proc. 1995; 27:1089–90. [PubMed] [Академия Google]
Исходы 500 беременностей у 335 женщин, перенесших трансплантацию почек, печени и сердца. Пересадка Proc. 1995; 27:1089–90. [PubMed] [Академия Google]
21. Бермас Б.Л., Хилл Дж.А. Влияние иммунодепрессантов на беременность. Ревмирующий артрит. 1995; 38: 1722–32. [PubMed] [Google Scholar]
22. Бар Оз Б., Хэкман Р., Эйнарсон Т., Корен Г. Исход беременности после терапии циклоспорином во время беременности: метаанализ. Трансплантация. 2001;71:1051–5. [PubMed] [Google Scholar]
23. Экспертная группа EBPG по трансплантации почек. Европейские рекомендации по передовой практике трансплантации почки. Раздел IV: Долгосрочное ведение реципиента трансплантата. IV.10. Беременность у реципиентов почечного трансплантата. Трансплантация нефролового циферблата. 2002; 17 (Приложение 4): 50–5. [PubMed] [Академия Google]
24. Buckley LM, Bullaboy CA, Leichtman L, Marquez M. Множественные врожденные аномалии, связанные с еженедельным лечением матери низкими дозами метотрексата. Ревмирующий артрит. 1997;40:971–3. [PubMed] [Google Scholar]
Ревмирующий артрит. 1997;40:971–3. [PubMed] [Google Scholar]
25. Donnenfeld AE, Pastuszak A, Noah JS, Schick B, Rose NC, Koren G, et al. Воздействие метотрексата до и во время беременности. Тератология. 1994; 49: 79–81. [PubMed] [Google Scholar]
26. Вулгарис Э., Пентерудакис Г., Павлидис Н. Рак и беременность: всесторонний обзор. Сур Онкол. 2011;20:e175–85. [PubMed] [Академия Google]
27. Намба Т., Браун С.Б., Гроб Д. Неонатальная миастения гравис: отчет о двух случаях и обзор литературы. Педиатрия. 1970; 45: 488–504. [PubMed] [Google Scholar]
28. Heckmatt JZ, Placzek M, Thompson AH, Dubowitz V, Watson G. Необычный случай неонатальной миастении. J Чайлд Нейрол. 1987; 2: 63–6. [PubMed] [Google Scholar]
29. Папазян О. Транзиторная неонатальная миастения. J Чайлд Нейрол. 1992; 7: 135–41. [PubMed] [Google Scholar]
30. Bartoccioni E, Evoli A, Casali C, Scoppetta C, Tonali P, Provenzano C, et al. Неонатальная миастения гравис: клиническое и иммунологическое исследование семи матерей и их новорожденных.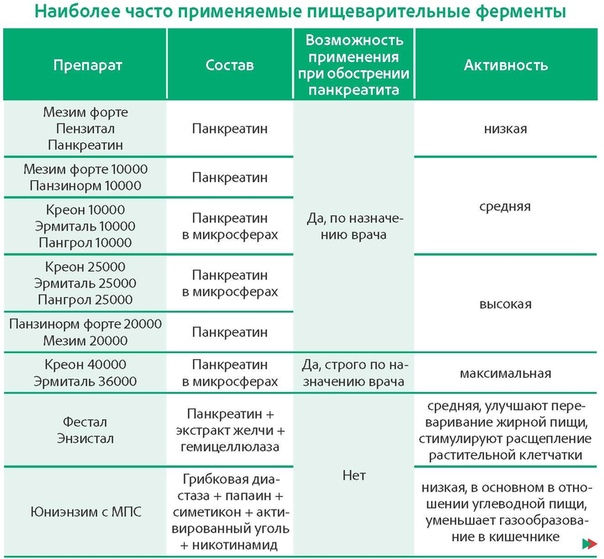 J Нейроиммунол. 1986;12:155–61. [PubMed] [Google Scholar]
J Нейроиммунол. 1986;12:155–61. [PubMed] [Google Scholar]
31. Riemersma S, Vincent A, Beeson D, Newland C, Hawke S, Vernet-der Garabedian B, et al. Ассоциация врожденного множественного артрогрипоза с материнскими антителами, ингибирующими функцию ацетилхолинового рецептора плода. Джей Клин Инвест. 1996; 98: 2358–63. [Бесплатная статья PMC] [PubMed] [Google Scholar]
32. Daskalakis GJ, Papageorgiou IS, Petrogiannis ND, Antsaklis AJ, Michalas SK. Миастения и беременность. Eur J Obstet Gynecol Reprod Biol. 2000;89: 201–4. [PubMed] [Google Scholar]
Миастения гравис во время беременности — PMC
Can Fam Physician. 2012 декабрь; 58 (12): 1346–1349.
Язык: английский | Французский
Информация об авторских правах и лицензии Отказ от ответственности
Вопрос Одна из моих пациенток, у которой диагностирована тяжелая миастения (МГ), планирует беременность. Ее MG контролируется с помощью лекарств. Может ли ее состояние или ее лекарства негативно повлиять на ее беременность?
Ответ Течение МГ во время беременности непредсказуемо, но нет данных о том, что МГ может неблагоприятно влиять на исходы беременности. Исследование большинства лекарств, используемых для контроля симптомов, пока дало обнадеживающие результаты. Тимэктомия до беременности может снизить потребность в лекарствах во время беременности. Новорожденный должен находиться под тщательным наблюдением на предмет признаков транзиторной миастении.
Исследование большинства лекарств, используемых для контроля симптомов, пока дало обнадеживающие результаты. Тимэктомия до беременности может снизить потребность в лекарствах во время беременности. Новорожденный должен находиться под тщательным наблюдением на предмет признаков транзиторной миастении.
Вопрос Индивидуальные пациенты для диагностики серьезной миастении (MG) и др. Planifie une Grosse. Sa MG контролируется фармакотерапией. Son état ou ses médicaments peuvent-ils avoir des effets défavorables sur sa Grossesse?
Réponse Эволюция MG во время грубых продаж является непредвидимой, но ее не существует, если вы не уверены, что MG может оказать влияние на влияние, отрицательное по отношению к MG. Les résultats des études sur la plupart des medicaments utilisés pour le control des symptômes sont jusqu’à présent rassurants. Une timectomie avant la Grossesse pourrait réduire la nécessité de prendre des médicaments durant la Grossesse. Il faudra surveiller внимательность le nouveau-né pour détecter tout signe de MG Transtoire.
Il faudra surveiller внимательность le nouveau-né pour détecter tout signe de MG Transtoire.
Миастения гравис (МГ) представляет собой аутоиммунное заболевание, поражающее почти 1 миллион человек во всем мире. 1 Заболевание в два раза чаще встречается у женщин, чем у мужчин, 2 диагностируется обычно во втором и третьем десятилетиях жизни. Миастения гравис характеризуется мышечной слабостью, вызванной нарушением функции ацетилхолиновых (АХ) рецепторов в нервно-мышечном синапсе 1 , 3 в результате действия аутоантител против рецепторов АХ. 3 , 4 Гиперплазия и опухоли вилочковой железы могут вызывать аномальную выработку этих аутоантител. 4 Диагноз миастении ставится после клинического и физикального обследования и подтверждается иммуноанализом сыворотки для измерения уровня аутоантител. 3 , 4
Из-за его высокой распространенности среди женщин детородного возраста и из-за того, что он не влияет на фертильность женщин, 5 нередко можно увидеть беременных женщин с миастенией. Влияние беременности на миастению значительно различается у женщин и даже между беременностями одной и той же женщины. 2 Во время беременности симптомы ухудшились у 41% женщин с миастенией, в то время как у 30% изменений не было, а у 29% наблюдалась ремиссия симптомов. 6 Улучшение симптомов во втором и третьем триместрах объясняется нормальными иммуносупрессивными изменениями на поздних сроках беременности. 3 Обострение симптомов наиболее вероятно в первом триместре или после родов. 6 Риск материнской смертности наиболее высок в течение первого года после постановки диагноза миастении, а риск минимален через 7 лет после постановки диагноза. 5 Таким образом, женщинам с МГ следует отложить беременность не менее чем на 2 года после начала заболевания. 5 , 6 Несмотря на эти соображения, беременность не оказывает отрицательного влияния на MG в долгосрочной перспективе.
Влияние беременности на миастению значительно различается у женщин и даже между беременностями одной и той же женщины. 2 Во время беременности симптомы ухудшились у 41% женщин с миастенией, в то время как у 30% изменений не было, а у 29% наблюдалась ремиссия симптомов. 6 Улучшение симптомов во втором и третьем триместрах объясняется нормальными иммуносупрессивными изменениями на поздних сроках беременности. 3 Обострение симптомов наиболее вероятно в первом триместре или после родов. 6 Риск материнской смертности наиболее высок в течение первого года после постановки диагноза миастении, а риск минимален через 7 лет после постановки диагноза. 5 Таким образом, женщинам с МГ следует отложить беременность не менее чем на 2 года после начала заболевания. 5 , 6 Несмотря на эти соображения, беременность не оказывает отрицательного влияния на MG в долгосрочной перспективе. 7
7
В целом МГ не оказывает серьезного неблагоприятного воздействия на течение беременности. 2 Отчеты не указывают на повышенный риск самопроизвольных абортов или преждевременных родов у женщин с миастенией. 6 , 8 Напротив, у младенцев возможно развитие транзиторной неонатальной миастении. Это происходит в 10–20% случаев вследствие плацентарного переноса антител иммуноглобулина G во втором и третьем триместрах беременности. 7 Симптомы у новорожденных обычно появляются через 2–4 дня после рождения, включая проблемы с дыханием, мышечную слабость, слабый плач, плохое сосание и птоз, что требует тщательного наблюдения. 3 , 5 , 7 Это состояние обычно проходит через 3 недели 5 без осложнений из-за деградации антител, полученных от матери. 3
Поскольку матка состоит из гладкой мускулатуры, на нее не влияет присутствие антител к рецептору АХ, поэтому женщинам с миастенией рекомендуются вагинальные роды. 3 , 7 На втором этапе может потребоваться помощь в виде щипцов или вакуум-экстракции, так как на этом этапе задействованы поперечнополосатые мышцы, на которые могут воздействовать антитела к рецептору АХ. 2 , 7 Кесарево сечение следует выполнять только по акушерским показаниям, так как операция может быть стрессовой для женщин с миастенией. 3 , 7 Во время родов рекомендуется эпидуральная анестезия 5 , 7 , потому что нервно-мышечные препараты и наркотики могут потенцировать действие антител к рецепторам АХ на нервно-мышечные узел.
3 , 7 На втором этапе может потребоваться помощь в виде щипцов или вакуум-экстракции, так как на этом этапе задействованы поперечнополосатые мышцы, на которые могут воздействовать антитела к рецептору АХ. 2 , 7 Кесарево сечение следует выполнять только по акушерским показаниям, так как операция может быть стрессовой для женщин с миастенией. 3 , 7 Во время родов рекомендуется эпидуральная анестезия 5 , 7 , потому что нервно-мышечные препараты и наркотики могут потенцировать действие антител к рецепторам АХ на нервно-мышечные узел.
Для оптимального ведения беременных с миастенией необходимо привлекать акушеров и неврологов. Почти у 15% людей с миастенией есть тимомы, 1 и от 60% до 80% имеют гиперплазию тимуса. 2 Тимэктомия стала стандартным протоколом лечения пациентов с миастенией и тимомами или гиперплазией тимуса. 1 , 2 Через пять лет после тимэктомии полная ремиссия миастении наблюдалась почти у 45% пациентов. 9 Во время беременности у женщин, не перенесших тимэктомию, частота обострений выше, чем у женщин, перенесших тимэктомию. 7 Кроме того, дети, рожденные от лиц, перенесших тимэктомию, имели меньший риск развития неонатальной миастении. 8 Таким образом, женщинам с миастенией, планирующим беременность, следует рекомендовать пройти тимэктомию до наступления беременности. 8
1 , 2 Через пять лет после тимэктомии полная ремиссия миастении наблюдалась почти у 45% пациентов. 9 Во время беременности у женщин, не перенесших тимэктомию, частота обострений выше, чем у женщин, перенесших тимэктомию. 7 Кроме того, дети, рожденные от лиц, перенесших тимэктомию, имели меньший риск развития неонатальной миастении. 8 Таким образом, женщинам с миастенией, планирующим беременность, следует рекомендовать пройти тимэктомию до наступления беременности. 8
Фармакологическое лечение миастении обычно направлено на повышение уровня АХ и снижение продукции аутоантител. Фармакологическое лечение не следует прекращать во время беременности; однако его может потребоваться изменить в зависимости от тяжести заболевания или обострений. 2
Ингибиторы ацетилхолинэстеразы, такие как пиридостигмин и неостигмин, часто используются при лечении миастении. 1 – 3 Хотя данные об использовании ингибиторов ацетилхолинэстеразы во время беременности ограничены, имеющиеся данные не указывают на повышенный риск пороков развития или других неблагоприятных исходов беременности. Сообщалось об одном случае микроцефалии, связанной с применением пиридостигмина. 10 Однако мать принимала дозы, в 4–8 раз превышающие рекомендуемую дозу. 10 Далее, в ответ на этот отчет, некоторые авторы предположили, что плацентарный перенос материнских антител, а не пиридостигмин, мог быть причиной аномалий развития плода. 11 Их утверждение подтверждается исследованиями, показавшими безопасное использование пиридостигмина женщинами с миастенией во время беременности. 5 , 8 , 10
1 – 3 Хотя данные об использовании ингибиторов ацетилхолинэстеразы во время беременности ограничены, имеющиеся данные не указывают на повышенный риск пороков развития или других неблагоприятных исходов беременности. Сообщалось об одном случае микроцефалии, связанной с применением пиридостигмина. 10 Однако мать принимала дозы, в 4–8 раз превышающие рекомендуемую дозу. 10 Далее, в ответ на этот отчет, некоторые авторы предположили, что плацентарный перенос материнских антител, а не пиридостигмин, мог быть причиной аномалий развития плода. 11 Их утверждение подтверждается исследованиями, показавшими безопасное использование пиридостигмина женщинами с миастенией во время беременности. 5 , 8 , 10
Кортикостероиды, такие как преднизолон и его биологически активное соединение преднизолон, обычно используются при миастении. 11 Метаанализ Motherisk определил повышенное отношение шансов (ОШ) расщелины полости рта при лечении кортикостероидами (ОШ = 3,69, 95% ДИ от 2,15 до 6,32). Хотя суммарное ОШ когортных исследований было незначительным (ОШ = 2,74, 95% ДИ от 0,96 до 7,82), когортные исследования показали кластеризацию расщелины неба по сравнению с контрольной группой. 12 , 13 Женщины с миастенией, которым прописаны кортикостероиды, должны быть проинформированы до зачатия о повышенном риске расщелин ротовой полости. Важно отметить, что формирование неба у плода завершается к 12 неделе.0099 14 Таким образом, одним из вариантов является начало терапии кортикостероидами после 12-й недели.
11 Метаанализ Motherisk определил повышенное отношение шансов (ОШ) расщелины полости рта при лечении кортикостероидами (ОШ = 3,69, 95% ДИ от 2,15 до 6,32). Хотя суммарное ОШ когортных исследований было незначительным (ОШ = 2,74, 95% ДИ от 0,96 до 7,82), когортные исследования показали кластеризацию расщелины неба по сравнению с контрольной группой. 12 , 13 Женщины с миастенией, которым прописаны кортикостероиды, должны быть проинформированы до зачатия о повышенном риске расщелин ротовой полости. Важно отметить, что формирование неба у плода завершается к 12 неделе.0099 14 Таким образом, одним из вариантов является начало терапии кортикостероидами после 12-й недели.
Применение азатиоприна (АЗА) не связано с повышением частоты врожденных аномалий. 15 Однако имеются данные о возможной задержке внутриутробного развития и малой массе тела при рождении, а также опасения по поводу иммунологических изменений. 15 , 16 Несмотря на эти сообщения, трудно определить, является ли АЗА единственной причиной этих неблагоприятных исходов или они связаны с основным заболеванием матери или с другими препаратами, используемыми в сочетании с АЗА для лечения мать. 17 Кроме того, первоначальные результаты продолжающегося исследования Motherisk по оценке развития нервной системы у детей, подвергшихся воздействию AZA внутриутробно, не предполагают значительного влияния на IQ по сравнению с детьми, не подвергавшимися воздействию. 18
15 , 16 Несмотря на эти сообщения, трудно определить, является ли АЗА единственной причиной этих неблагоприятных исходов или они связаны с основным заболеванием матери или с другими препаратами, используемыми в сочетании с АЗА для лечения мать. 17 Кроме того, первоначальные результаты продолжающегося исследования Motherisk по оценке развития нервной системы у детей, подвергшихся воздействию AZA внутриутробно, не предполагают значительного влияния на IQ по сравнению с детьми, не подвергавшимися воздействию. 18
Хотя было показано, что циклоспорин легко проникает через плаценту, нет доказательств того, что он связан с повышенным риском тяжелых осложнений или пороков развития. 3 , 11 Недавнее исследование Motherisk показало, что у пациентов с трансплантацией почки, которые получали терапию циклоспорином, была более высокая частота преждевременных родов, что было связано с более низкой массой тела при рождении у новорожденных этих женщин. 19 Однако оценка долгосрочных исходов развития нервной системы у детей, подвергшихся воздействию циклоспорина, не выявила каких-либо существенных различий по сравнению с детьми, не подвергавшимися воздействию. 19 Следовательно, терапию циклоспорином можно использовать во время беременности, при которой польза для матери превышает риск для плода. 20 , 21
19 Однако оценка долгосрочных исходов развития нервной системы у детей, подвергшихся воздействию циклоспорина, не выявила каких-либо существенных различий по сравнению с детьми, не подвергавшимися воздействию. 19 Следовательно, терапию циклоспорином можно использовать во время беременности, при которой польза для матери превышает риск для плода. 20 , 21
Ритуксимаб легко проникает через плаценту примерно на 16 неделе беременности. 21 На сегодняшний день не было сообщений о серьезных пороках развития, связанных с воздействием ритуксимаба. 22 Было несколько случаев снижения количества В-клеток у детей, рожденных от женщин, принимавших ритуксимаб, но это состояние разрешилось в течение 6 месяцев. 22
Микофенолата мофетил (МФМ) — препарат второго ряда для лечения легких форм миастении. 1 Недавно Управление по санитарному надзору за качеством пищевых продуктов и медикаментов реклассифицировало MFM как лекарство класса D, что указывает на наличие доказательств тератогенного действия на плод человека. 23 Это связано с выкидышем в первом триместре и структурными пороками развития ушей и челюсти, расщелиной губы и неба, а также гипоплазией пальцев рук и ногтей на ногах. 24 – 26
23 Это связано с выкидышем в первом триместре и структурными пороками развития ушей и челюсти, расщелиной губы и неба, а также гипоплазией пальцев рук и ногтей на ногах. 24 – 26
В дополнение к этим препаратам пациентам с МГ противопоказаны препараты, которые усугубляют симптомы МГ за счет потенцирования действия антител к рецепторам АХ. Эти препараты включают нервно-мышечные блокаторы (например, сульфат магния), антиаритмические препараты (например, хинидин) и местные анестетики (например, сложные эфиры), а также антибиотики из классов аминогликозидов, хинолонов и макролидов. 27
Нет никаких доказательств того, что МГ может неблагоприятно влиять на исходы беременности, и большинство лекарств, используемых для контроля симптомов, кажутся относительно безопасными во время беременности (за исключением MFM, используемого в качестве терапии второй линии). Тимэктомия до беременности может снизить потребность в лекарствах во время беременности. Новорожденный должен находиться под тщательным наблюдением на предмет признаков транзиторной миастении.
Новорожденный должен находиться под тщательным наблюдением на предмет признаков транзиторной миастении.
MOTHERISK
Вопросы Motherisk подготовлены группой Motherisk в Больнице для больных детей в Торонто, Онтарио. Д-р Чаудхри и Г-жа Виньяраджа являются членами, а д-р Корен является директором программы Motherisk и поддерживается Исследовательским руководством по улучшению фармакотерапии во время беременности и кормления грудью. Он возглавляет кафедру молекулярной токсикологии Айви на медицинском факультете Университета Западного Онтарио в Лондоне.
У вас есть вопросы о влиянии лекарств, химикатов, радиации или инфекций на беременных или кормящих женщин? Мы приглашаем вас отправить их в программу Motherisk по факсу 416 813–7562; они будут рассмотрены в будущих обновлениях Motherisk.
Опубликованные обновления Motherisk доступны на веб-сайте канадского семейного врача ( www. cfp.ca ), а также на веб-сайте Motherisk ( www.motherisk.org ).
cfp.ca ), а также на веб-сайте Motherisk ( www.motherisk.org ).
Конкурирующие интересы
Не заявлено
1. Gilhus NE, Owe JF, Hoff JM, Romi F, Skeie GO, Aarli JA. Миастения гравис: обзор доступных подходов к лечению. Аутоиммунный дис. 2011;2011:847393. Epub 2011 Oct 5. [Бесплатная статья PMC] [PubMed] [Google Scholar]
2. Ферреро С., Эспозито Ф., Биамонти М., Бентивольо Г., Рагни Н. Миастения во время беременности. Эксперт преподобный Нейротер. 2008;8(6):979–88. [PubMed] [Google Scholar]
3. Ferrero S, Pretta S, Nicoletti A, Petrera P, Ragni N. Myasthenia gravis: вопросы ведения во время беременности. Eur J Obstet Gynecol. 2005;121(2):129–38. [PubMed] [Google Scholar]
4. Buckley C, Douek D, Newsom-Davis J, Vincent A, Willcox N. Зрелые, долгоживущие CD4+ и CD8+ Т-клетки генерируются тимомой при миастении. Энн Нейрол. 2001;50(1):64–72. [PubMed] [Академия Google]
5. Джелмис Дж., Состарко М. , Майер Д., Иванишевич М. Миастения при беременности: отчет о 69 случаях. Eur J Obstet Gynecol Reprod Biol. 2002;104(1):21–5. [PubMed] [Google Scholar]
, Майер Д., Иванишевич М. Миастения при беременности: отчет о 69 случаях. Eur J Obstet Gynecol Reprod Biol. 2002;104(1):21–5. [PubMed] [Google Scholar]
6. Da Silva FC, do Cima LC, de Sá RAM. Миастения и беременность. В: Минагар А, редактор. Неврологические расстройства и беременность. Берлингтон, Массачусетс: Elsevier; 2011. С. 55–68. [Google Scholar]
7. Berlit S, Tuschy B, Spaich S, Sütterlin M, Schaffelder R. Миастения при беременности: клинический случай. Деловой представитель Акушер-гинеколог. 2012;2012:736024. Epub 2012, 26 января. [Бесплатная статья PMC] [PubMed] [Google Scholar]
8. Хофф Дж.М., Далтвейт А.К., Гилхус Н.Е. Миастения при беременности и родах: выявление факторов риска, оптимизация лечения. Евр Дж Нейрол. 2007;14(1):38–43. [PubMed] [Google Scholar]
9. Chieza JT, Fleming I, Parry N, Skelton VA. Миастения у матери, осложненная врожденным множественным артрогрипозом плода. Int J Obstet Анест. 2011;20(1):79–82. Epub 2010 Nov 26. [PubMed] [Google Scholar]
10. Dominovic-Kovacevic A, Ilic T, Vukojevic Z. Myasthenia gravis и беременность — клинический случай. Curr Top Neurol Psychiatr Relat Discip. 2010;18(4):40–3. [Академия Google]
Dominovic-Kovacevic A, Ilic T, Vukojevic Z. Myasthenia gravis и беременность — клинический случай. Curr Top Neurol Psychiatr Relat Discip. 2010;18(4):40–3. [Академия Google]
11. Бриггс Г., Фримен Р., Яффе С. Лекарственные препараты при беременности и кормлении грудью. Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уилкинс; 2008. [Google Scholar]
12. Park-Wyllie L, Mazzotta P, Pastuszak A, Moretti ME, Beique L, Hunnisett L, et al. Врожденные дефекты после воздействия кортикостероидов на мать: проспективное когортное исследование и метаанализ эпидемиологических исследований. Тератология. 2000;62(6):385–92. [PubMed] [Google Scholar]
13. Гур С., Диав-Цитрин О., Шехтман С., Арнон Дж., Орной А. Исход беременности после воздействия кортикостероидов в первом триместре: проспективное контролируемое исследование. Репрод Токсикол. 2004;18(1):93–101. [PubMed] [Google Scholar]
14. Ли С., Сайкс Дж. Расщелина губы и неба. В: Stucker FJ, de Souza C, Kenyon GS, Lian TS, Draf W, Schick B, редакторы. Ринология и пластическая хирургия лица. Нью-Йорк, штат Нью-Йорк: Спрингер; 2009. стр. 909–16. [Google Scholar]
Ринология и пластическая хирургия лица. Нью-Йорк, штат Нью-Йорк: Спрингер; 2009. стр. 909–16. [Google Scholar]
15. Гольдштейн Л.Х. Исход беременности у женщин, подвергшихся воздействию азатиоприна во время беременности. Врожденные дефекты Res A Clin Mol Teratol. 2007;79(10):696–701. [PubMed] [Google Scholar]
16. Маталон С.Т., Орной А., Лишнер М. Обзор потенциального воздействия трех часто используемых противоопухолевых и иммунодепрессивных препаратов (циклофосфамид, азатиоприн, доксорубицин на эмбрион и плаценту) Reprod Toxicol. 2004;18(2):219–30. [PubMed] [Google Scholar]
17. Полифка Ю.Е. Обновление тератогена: азатиоприн и 6-меркаптопурин. Тератология. 2002;65(5):240–6. [PubMed] [Google Scholar]
18. 51-е ежегодное собрание Общества тератологии, 25–29 июня 2011 г., Коронадо, Калифорния, США. Рефераты Врожденные дефекты Res A Clin Mol Teratol. 2011;91(5):305–420. [PubMed] [Google Scholar]
19. Нулман И., Сгро М., Баррера М., Читаят Д., Кэрни Дж. , Корен Г. Долгосрочное развитие нервной системы у детей, подвергнутых внутриутробному воздействию циклоспорина после пересадки почки матери. Педиатрические препараты. 2010;12(2):113–22. [PubMed] [Академия Google]
, Корен Г. Долгосрочное развитие нервной системы у детей, подвергнутых внутриутробному воздействию циклоспорина после пересадки почки матери. Педиатрические препараты. 2010;12(2):113–22. [PubMed] [Академия Google]
20. Бар Оз Б., Хэкман Р., Эйнарсон Т., Корен Г. Исход беременности после терапии циклоспорином во время беременности: метаанализ. Трансплантация. 2001;71(8):1051–5. [PubMed] [Google Scholar]
21. Østensen M, Lockshin M, Doria A, Valesini G, Meroni P, Gordon C, et al. Обновленная информация о безопасности биологических агентов и некоторых иммуносупрессивных противоревматических препаратов во время беременности. Ревматология. 2008;47(Приложение 3):iii28–31. [PubMed] [Google Scholar]
22. Вулгарис Э. Рак и беременность: всесторонний обзор. Сур Онкол. 2011;20(4):e175–85. Epub 2011 Jul 5. [PubMed] [Google Scholar]
23. Pisoni CN, D’Cruz DP. Безопасность микофенолата мофетила при беременности. Экспертное заключение Drug Safe. 2008;7(3):219–22. [PubMed] [Google Scholar]
24.
