Беременность и аденома гипофиза: Успешный исход беременности и родов после хирургического лечения аденомы гипофиза в I триместре (клиническое наблюдение) | Баракина О.В., Маркова Т.Н., Исмаилова С.Г., Годков И.М., Грабовский В.М., Козлов П.В.
Беременность при аденоме гипофиза со смешанной секрецией — Клинический разбор в акушерстве, гинекологии и репродуктологии №03-04 2022
Подписаться на новые номера
Автор:А.А. Гусова
ФГБУ «Федеральный научно-клинический центр спортивной медицины и реабилитации ФМБА России», Москва, Россия
Аннотация
Современные медицинские технологии позволяют сохранять беременность при разнообразных сопутствующих заболеваниях матери, в том числе имеется возможность проводить хирургические вмешательства прямо во время беременности, сохраняя здоровье матери и плода. В статье представлен клинический случай аденомы гипофиза, секретирующей гормон роста, пролактин и адренокортикотропный гормон. У пациентки наблюдался относительно мягкий вариант течения заболевания. При наличии сглаженной, но характерной клинической картины за прошедшие 10 лет по месту жительства врачи не установили гормональную активность аденомы гипофиза.
При наличии сглаженной, но характерной клинической картины за прошедшие 10 лет по месту жительства врачи не установили гормональную активность аденомы гипофиза.
За период существования опухоли у пациентки дважды наступала беременность. Оба раза беременность была прервана: в первый раз прервать беременность рекомендовал гинеколог, во второй раз это было решением пациентки на фоне манифестации акромегалии и гиперкортицизма. При обращении наблюдалось параселлярное распространение аденомы гипофиза с прорастанием ее в кавернозный синус. Было проведено оперативное лечение, удалена доступная часть опухоли с фрагментом аденогипофиза, далее была проведена лучевая терапия. Возможным последствием лечения являются развитие вторичного гипогонадизма и невозможность наступления спонтанной беременности. Учитывая намерение женщины родить ребенка, целесообразно было бы организовать коллегиальное ведение пациентки гинекологами, эндокринологами, хирургами и анестезиологами. Такое сотрудничество могло бы позволить пациентке реализовать свою репродуктивную функцию.
Ключевые слова: клинический случай, беременность, акромегалия, гиперкортицизм, аденома гипофиза, смешанная секреция.
Для цитирования: Гусова А.А. Беременность при аденоме гипофиза со смешанной секрецией. Клинический разбор в акушерстве, гинекологии и репродуктологии. 2022; 3–4: 22–27. DOI: 10.47407/kragr2022.2.34.000038
Pregnancy in patient with mixed secreting pituitary adenoma
Anna A. Gusova
Abstract
Contemporary medical technologies make it possible to maintain pregnancy in mothers with various concomitant disorders. Among other things it is possible to perform surgery right during pregnancy without disturbing pregnancy, and maintaining maternal and fetal health. The paper reports the clinical case of pituitary adenoma, secreting growth hormone, prolactin, and ACTH. The female patient had a rather mild course of the disease. Provided that the patient had vague but typical clinical manifestations, hormonal activity of pituitary adenoma has not been determined for ten years in the community clinic. During the period of the tumor existence two pregnancies occurred. Pregnancy was terminated both times: at the first time pregnancy termination was recommended by gynecologist, and at the second time it was the patient herself who made a decision due to the acromegaly and hypercortisolism manifestations. The patient presented with the extension of pituitary adenoma invading the cavernous sinus. Surgery was performed in order to remove the accessible part of the tumor together with a fragment of adenohypophysis, then the patient received radiation therapy. The development of secondary hypogonadism and impossibility of spontaneous pregnancy are the possible treatment effects. Thus, taking into account the woman’s intention to have a child, the team efforts of gynecologists of all levels, endocrinologists, surgeons and anesthesiologists, focused on maintaining pregnancy in women with pituitary adenomas would be appropriate. Such cooperation might allow the patient to implement her reproductive function.
During the period of the tumor existence two pregnancies occurred. Pregnancy was terminated both times: at the first time pregnancy termination was recommended by gynecologist, and at the second time it was the patient herself who made a decision due to the acromegaly and hypercortisolism manifestations. The patient presented with the extension of pituitary adenoma invading the cavernous sinus. Surgery was performed in order to remove the accessible part of the tumor together with a fragment of adenohypophysis, then the patient received radiation therapy. The development of secondary hypogonadism and impossibility of spontaneous pregnancy are the possible treatment effects. Thus, taking into account the woman’s intention to have a child, the team efforts of gynecologists of all levels, endocrinologists, surgeons and anesthesiologists, focused on maintaining pregnancy in women with pituitary adenomas would be appropriate. Such cooperation might allow the patient to implement her reproductive function.
Key words: clinical case, pregnancy, acromegaly, hypercortisolism, pituitary adenoma, mixed secretions.
For citation: Gusova A.A. Pregnancy in patient with mixed secreting pituitary adenoma. Clinical analysis in obstetrics, gynecology and reproductology. 2022; 3–4: 22–27. DOI: 10.47407/kragr2022.2.34.000038
Актуальность
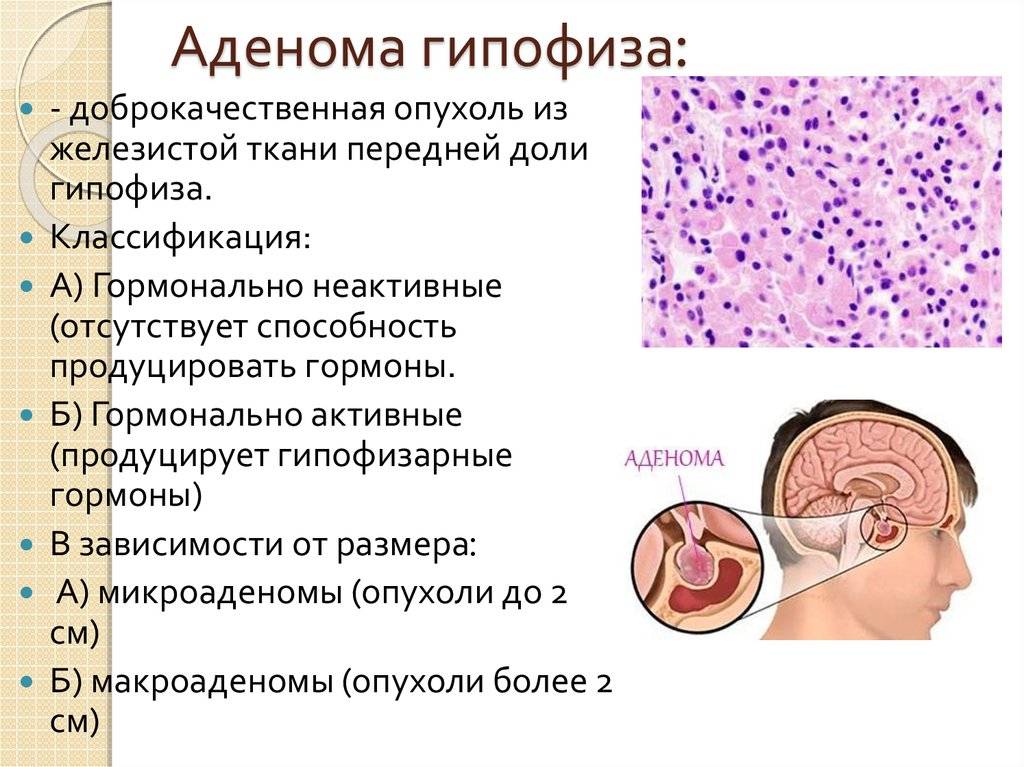
Аденомы гипофиза – нередкий вариант образований головного мозга. Популяционная частота аденом гипофиза по разным данным составляет около 20% [1]. Гормонально-активные аденомы гипофиза встречаются в популяции с частотой 0,1%, наиболее частым вариантом гормональной активности является гиперпролактинемия [1–3]. В последние десятилетия было показано, что опухоли, секретирующие пролактин, в большинстве случаев поддаются успешному медикаментозному лечению. При этом другие, более редкие варианты гормональной активности аденом гипофиза – гиперсекреция соматотропного гормона (СТГ) и адренокортикотропного гормона (АКТГ), вызывающие у взрослых соответственно акромегалию и болезнь Иценко–Кушинга (БИК), часто являются заболеваниями, в меньшей степени поддающимся медикаментозному воздействию. Эти патологии приводят к существенному ухудшению качества жизни и здоровья, инвалидизации пациентов [3–5].
Эти патологии приводят к существенному ухудшению качества жизни и здоровья, инвалидизации пациентов [3–5].
Особым вариантом аденом гипофиза являются опухоли со смешанной гормональной секрецией. Считается, что варианты сочетаний гормональной активности клеток аденомы связаны с источником опухолевых клеток и со степенью их дифференцировки. Наиболее частым вариантом смешанной гормональной активности аденом гипофиза является сочетание гиперпролактинемии и гиперсекреции СТГ, при этом любой вариант аденомы гипофиза со смешанной секрецией обладает более агрессивным ростом, чем аденома, секретирующая один гормон. Сочетание секреции аденомой СТГ и АКТГ наблюдается редко и характеризуется частыми рецидивами и неблагоприятным прогнозом [2–4].
Наступление беременности при гиперпролактинемиях на фоне медикаментозной терапии хорошо изучено и описано во многих руководствах [6–8]. Беременности при активных акромегалии и гиперкортицизме, наоборот, являются достаточно редкими и вызывают много вопросов и затруднений у гинекологов первичного звена.
Клинический случай
Пациентка З. 38 лет обратилась с жалобами на повышение артериального давления (АД) до 180/100 мм рт. ст., головные боли и изменение распределения жировой клетчатки – отложение жировой клетчатки в области живота, на спине, плечах и лице, похудение конечностей (рис. 1). Из анамнеза известно, что 16 лет назад впервые были выявлены эндоселлярная аденома гипофиза, гиперпролактинемия до 3053 мМЕ/л (при норме до 727) и снижение тиреотропного гормона (ТТГ) – 0,01 МЕ/л (норма 0,4–4,0) при отсутствии изменений при ультразвуковом исследовании (УЗИ) щитовидной железы (объем железы 14,4 мл). Был назначен бромокриптин 2,5 мг в день, на фоне лечения пролактин снизился до 1679 нмоль/л, терапию было рекомендовано продолжить, однако приверженность терапии была низкой.
Из представленной медицинской документации известно, что снижение ТТГ до 0,037–0,1 МЕ/л (норма от 0,4) при нормальном уровне тироксина свободного (Т4св) – 18,2–21,1 пмоль/л (норма 10–23,2) систематически выявлялось при обследовании 6 и 12 лет назад, рекомендовался прием тиреостатиков в дозе 5 мг/сут, пациентка препарат не принимала. За год до обращения при обследовании – эутиреоз, объем щитовидной железы 23 мл.
За год до обращения при обследовании – эутиреоз, объем щитовидной железы 23 мл.
С 2010 г. периодически выявлялось умеренное повышение кортизола – 742–1002 нмоль/л (норма до 690) при высоконормальном или повышенном АКТГ – 43,6–59,6 пг/мл (норма до 46). За год до обращения АКТГ 23,1 пг/мл (при норме до 58,2), кортизол 590 нмоль/л (при норме до 600), дальнейшее тестирование по поводу эндогенного гиперкортицизма не проводилось.
В возрасте 32 лет впервые выявлено нарушение толерантности к углеводам, которое через 2 года прогрессировало в сахарный диабет. На момент осмотра пациентка получала интенсифицированную инсулинотерапию препаратами гларгин и аспарт, диету не соблюдала, при самоконтроле гликемия натощак 7–8 ммоль/л, в течение дня до 11–12 ммоль/л, гликированный гемоглобин 8,8%.
С 34 лет отметила периодическое повышение АД до 130/80 мм рт. ст., в течение года до обращения – повышение АД до 180/100 мм рт. ст., при этом постоянной антигипертензивной терапии пациентка не получала. За 3 мес до обращения при обследовании – снижение ТТГ -0,04 МЕ/л при нормальном Т4св – 18,2 пмоль/л (норма 10,5–24,5), был назначен тиамазол 5–10 мг/сут. В связи с выявленной гормональной активностью аденомы гипофиза (повышение инсулиноподобного фактора роста 1 – ИФР-1 1104 нг/мл при норме до 307, СТГ 2,08 нг/мл при норме 0–8, кортизол 486 нмоль/л при норме до 600, АКТГ и пролактин в норме) в течение месяца принимала бромокриптин 2,5 мг на ночь. Менархе в 15 лет, цикл установился сразу, с 26 лет отметила нарушения менструального цикла по типу олигоопсоменореи. В течение 3 лет до обращения цикл относительно регулярный с периодическими задержками. Замужем, в течение длительного времени планировали деторождение. За 4 года до обращения во ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко» Мин-здрава России наступила беременность, однако в связи с повышенным уровнем пролактина по месту жительства было рекомендовано прервать беременность, что пациентка и сделала.
За 3 мес до обращения при обследовании – снижение ТТГ -0,04 МЕ/л при нормальном Т4св – 18,2 пмоль/л (норма 10,5–24,5), был назначен тиамазол 5–10 мг/сут. В связи с выявленной гормональной активностью аденомы гипофиза (повышение инсулиноподобного фактора роста 1 – ИФР-1 1104 нг/мл при норме до 307, СТГ 2,08 нг/мл при норме 0–8, кортизол 486 нмоль/л при норме до 600, АКТГ и пролактин в норме) в течение месяца принимала бромокриптин 2,5 мг на ночь. Менархе в 15 лет, цикл установился сразу, с 26 лет отметила нарушения менструального цикла по типу олигоопсоменореи. В течение 3 лет до обращения цикл относительно регулярный с периодическими задержками. Замужем, в течение длительного времени планировали деторождение. За 4 года до обращения во ФГАУ «Национальный медицинский исследовательский центр нейрохирургии им. акад. Н.Н. Бурденко» Мин-здрава России наступила беременность, однако в связи с повышенным уровнем пролактина по месту жительства было рекомендовано прервать беременность, что пациентка и сделала. Результаты физикального, лабораторного и инструментального обследования пациентки в ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко». При физикальном обследовании: пациентка повышенного питания, индекс массы тела 28,7 кг/м2. Кожные покровы умеренно гиперемированы, цианотичны, неравномерно пигментированы, ливедо (см. рис. 1). На коже живота обнаруживаются тонкие белесые полосы растяжения. Перераспределение подкожной жировой клетчатки с преимущественным отложением на животе и спине. Гирсутизм – избыточный рост волос на животе, лице, груди, бедрах. Незначительно выраженный экзофтальм, симптом Мебиуса положителен, остальные глазные симптомы отрицательные. При лабораторном обследовании: пролактин 218 мМЕ/л (норма 40–530), СТГ 4,73 нг/мл (до 8), ИФР-1 1023 нг/мл (до 307), ТТГ<0,01 мМЕ/л, Т4св 15,1 пмоль/л (11,5–22,7), кортизол 588 МЕд/л (норма до 690). Проведен ночной подавляющий тест с 1 мг дексаметазона. После приема дексаметазона проведены исследования: кортизол – 828 нмоль/л, АКТГ – 56,8 пг/мл (норма до 46).
Результаты физикального, лабораторного и инструментального обследования пациентки в ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко». При физикальном обследовании: пациентка повышенного питания, индекс массы тела 28,7 кг/м2. Кожные покровы умеренно гиперемированы, цианотичны, неравномерно пигментированы, ливедо (см. рис. 1). На коже живота обнаруживаются тонкие белесые полосы растяжения. Перераспределение подкожной жировой клетчатки с преимущественным отложением на животе и спине. Гирсутизм – избыточный рост волос на животе, лице, груди, бедрах. Незначительно выраженный экзофтальм, симптом Мебиуса положителен, остальные глазные симптомы отрицательные. При лабораторном обследовании: пролактин 218 мМЕ/л (норма 40–530), СТГ 4,73 нг/мл (до 8), ИФР-1 1023 нг/мл (до 307), ТТГ<0,01 мМЕ/л, Т4св 15,1 пмоль/л (11,5–22,7), кортизол 588 МЕд/л (норма до 690). Проведен ночной подавляющий тест с 1 мг дексаметазона. После приема дексаметазона проведены исследования: кортизол – 828 нмоль/л, АКТГ – 56,8 пг/мл (норма до 46). При УЗИ щитовидной железы: объем железы 38,6 мл, в левой доле анэхогенные образования 5 и 7 мм. По данным магнитно-резонансной томографии – эндолатеро(D)селлярная аденома гипофиза, супраселлярная цистерна свободна. При обследовании у офтальмолога с проведением компьютерной периметрии нарушений со стороны зрения не выявлено. На основании данных обследования установлен диагноз: аденома гипофиза смешанной секреции (СТГ-АКТГ-пролактинсекретирующая). БИК средней тяжести. Акромегалия, активная фаза. Сахарный диабет, ассоциированный с гиперкортицизмом и акромегалией. Назначен каберголин внутрь 3 мг/нед, внутрь кетоконазол 200 мг/сут, октреотид продленного действия 20 мг внутримышечно 1 раз в 28 дней, интенсифицированная инсулинотерапия терапия под контролем гликемии. Рекомендовано трансназальное транссфеноидальное нейрохирургическое лечение по поводу макроаденомы гипофиза. Незадолго до даты госпитализации пациентка обратилась с просьбой перенести госпитализацию в связи с наступлением у нее беременности и желанием прервать беременность по месту жительства согласно настоятельным рекомендациям гинекологов.
При УЗИ щитовидной железы: объем железы 38,6 мл, в левой доле анэхогенные образования 5 и 7 мм. По данным магнитно-резонансной томографии – эндолатеро(D)селлярная аденома гипофиза, супраселлярная цистерна свободна. При обследовании у офтальмолога с проведением компьютерной периметрии нарушений со стороны зрения не выявлено. На основании данных обследования установлен диагноз: аденома гипофиза смешанной секреции (СТГ-АКТГ-пролактинсекретирующая). БИК средней тяжести. Акромегалия, активная фаза. Сахарный диабет, ассоциированный с гиперкортицизмом и акромегалией. Назначен каберголин внутрь 3 мг/нед, внутрь кетоконазол 200 мг/сут, октреотид продленного действия 20 мг внутримышечно 1 раз в 28 дней, интенсифицированная инсулинотерапия терапия под контролем гликемии. Рекомендовано трансназальное транссфеноидальное нейрохирургическое лечение по поводу макроаденомы гипофиза. Незадолго до даты госпитализации пациентка обратилась с просьбой перенести госпитализацию в связи с наступлением у нее беременности и желанием прервать беременность по месту жительства согласно настоятельным рекомендациям гинекологов.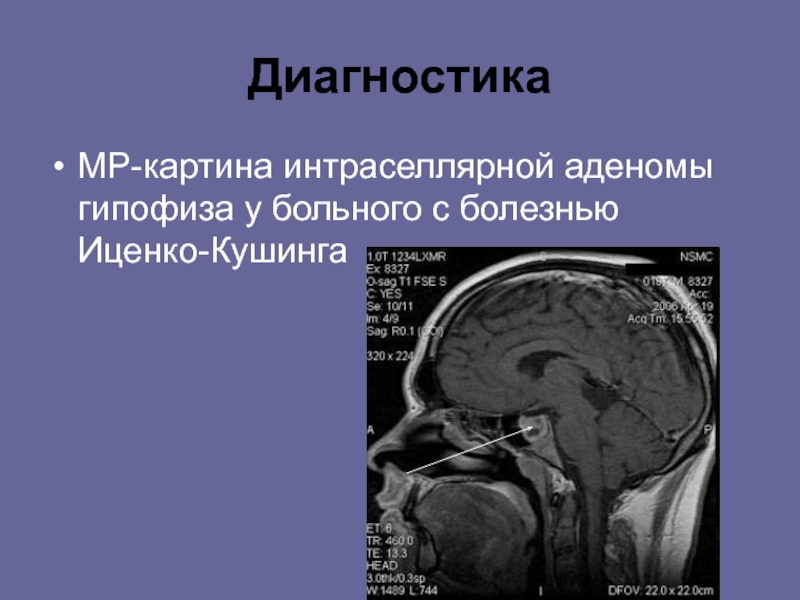 Несмотря на многочисленные беседы о возможности сохранения беременности и проведения операции по поводу аденомы гипофиза на фоне беременности с использованием методик и препаратов, разрешенных при беременности, а также разъяснения о возможном развитии вторичного гипогонадизма и потере фертильности как последствии проведения радикальной операции удаления макроаденомы гипофиза, пациентка прервала беременность на сроке 10 нед. Еще через 3 мес пациентка была госпитализирована в ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» для проведения оперативного лечения. При лабораторном контроле до операции на фоне консервативной терапии отмечалось некоторое снижение гормональной активности опухоли: СТГ 2,57 нг/мл, ИФР-1 629 нг/мл (норма до 284), АКТГ 21,5 пг/мл (до 46), кортизол 235 нмоль/л (119–618), пролактин 17 МЕ/мл (59–619). Лечение. Через полгода после первичного обращения, в возрасте 38 лет, в ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» была проведена операция эндоскопического эндоназального транссфеноидального частичного удаления эндолатеро(R)селлярной аденомы гипофиза.
Несмотря на многочисленные беседы о возможности сохранения беременности и проведения операции по поводу аденомы гипофиза на фоне беременности с использованием методик и препаратов, разрешенных при беременности, а также разъяснения о возможном развитии вторичного гипогонадизма и потере фертильности как последствии проведения радикальной операции удаления макроаденомы гипофиза, пациентка прервала беременность на сроке 10 нед. Еще через 3 мес пациентка была госпитализирована в ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» для проведения оперативного лечения. При лабораторном контроле до операции на фоне консервативной терапии отмечалось некоторое снижение гормональной активности опухоли: СТГ 2,57 нг/мл, ИФР-1 629 нг/мл (норма до 284), АКТГ 21,5 пг/мл (до 46), кортизол 235 нмоль/л (119–618), пролактин 17 МЕ/мл (59–619). Лечение. Через полгода после первичного обращения, в возрасте 38 лет, в ФГАУ «НМИЦ нейрохирургии им. акад. Н.Н. Бурденко» была проведена операция эндоскопического эндоназального транссфеноидального частичного удаления эндолатеро(R)селлярной аденомы гипофиза. Согласно протоколу оперативного вмешательства, опухоль была кремового цвета, плотной консистенции, занимала всю полость турецкого седла и распространялась в правый кавернозный синус. При операции удалена доступная часть опухоли. По данным патоморфологического исследования удаленной опухоли: аденома гипофиза с инфильтрацией капсулы и фрагмент аденогипофиза. После операции была отмечена нормализация гликемии, отменена сахароснижающая терапия. Через 3 мес после операции гормональная активность аденомы, согласно лабораторным данным, сохранялась, было рекомендовано проведение лучевой терапии. В течение года после операции пациентка не получала терапии, направленной на снижение гормональной активности аденомы гипофиза. Через год после операции, в 39 лет, при гормональном обследовании подтверждено сохранение гормональной активности опухоли: пролактин 178 мМЕ/л (норма 59–619), СТГ 3,17 нг/мл (до 8), ИФР-1 1023 нг/мл (до 307), ТТГ 0,02 мМЕ/л, Т4св 16,6 пмоль/л (11,5–22,7), кортизол 461 МЕд/л (до 618), в ночном подавляющем тесте с 1 мг дексаметазона кортизол 107 нмоль/л (<50), свободный кортизол в суточной моче 835 нмоль/сут (380–940), гликированный гемоглобин 6,2%.
Согласно протоколу оперативного вмешательства, опухоль была кремового цвета, плотной консистенции, занимала всю полость турецкого седла и распространялась в правый кавернозный синус. При операции удалена доступная часть опухоли. По данным патоморфологического исследования удаленной опухоли: аденома гипофиза с инфильтрацией капсулы и фрагмент аденогипофиза. После операции была отмечена нормализация гликемии, отменена сахароснижающая терапия. Через 3 мес после операции гормональная активность аденомы, согласно лабораторным данным, сохранялась, было рекомендовано проведение лучевой терапии. В течение года после операции пациентка не получала терапии, направленной на снижение гормональной активности аденомы гипофиза. Через год после операции, в 39 лет, при гормональном обследовании подтверждено сохранение гормональной активности опухоли: пролактин 178 мМЕ/л (норма 59–619), СТГ 3,17 нг/мл (до 8), ИФР-1 1023 нг/мл (до 307), ТТГ 0,02 мМЕ/л, Т4св 16,6 пмоль/л (11,5–22,7), кортизол 461 МЕд/л (до 618), в ночном подавляющем тесте с 1 мг дексаметазона кортизол 107 нмоль/л (<50), свободный кортизол в суточной моче 835 нмоль/сут (380–940), гликированный гемоглобин 6,2%. Менструальная функция у пациентки была сохранена, индекс массы тела 26,5 кг/м2. С учетом наличия остатков опухоли и ее гормональной активности было проведено лучевое лечение в ФГАУ «НМИЦ нейрохирургии им. акад.
Менструальная функция у пациентки была сохранена, индекс массы тела 26,5 кг/м2. С учетом наличия остатков опухоли и ее гормональной активности было проведено лучевое лечение в ФГАУ «НМИЦ нейрохирургии им. акад.
Н.Н. Бурденко». После лучевого лечения было рекомендовано возобновить терапию октреотидом продленного действия 20 мг внутримышечно 1 раз в 28 дней и каберголином внутрь 3 мг/нед, а также вновь назначен метформин 2000 мг/сут под контролем гормональных показателей и гликемии. Исход и результаты последующего наблюдения. Для оценки эффективности проведенного лечения необходима оценка гормонального статуса в отдаленном периоде, однако пациентка стала наблюдаться по месту жительства и не приехала для динамического контроля. С учетом проведения лучевого лечения у пациентки возможно развитие гипопитуитаризма, в том числе вторичного гипогонадизма. Может быть необходима терапия для снижения гормональной активности остаточной ткани опухоли. С учетом возраста пациентки это может помешать реализации ее репродуктивных планов. Что касается функции щитовидной железы, то в данном случае, очевидно, наблюдалось изолированное снижение ТТГ на фоне наличия активной БИК, что позволяет предположить нормализацию показателей при ликвидации эндогенного гиперкортицизма [9].
Что касается функции щитовидной железы, то в данном случае, очевидно, наблюдалось изолированное снижение ТТГ на фоне наличия активной БИК, что позволяет предположить нормализацию показателей при ликвидации эндогенного гиперкортицизма [9].
Обсуждение
Данный клинический случай представляет особый интерес, так как и при гиперпролактинемии, и при акромегалии, и при гиперкортицизме обычно наблюдается нарушение овуляторной функции и фертильность существенно снижается. А у описываемой пациентки на фоне плюригормональной гиперфункции гипофиза дважды самопроизвольно развилась беременность.
Основными эндокринными нарушениями, определяющими прогноз и тяжесть состояния пациентки, являлись эндогенный гиперкортицизм (БИК) и акромегалия, при этом гиперпролактинемия могла быть следствием масс-эффекта макроаденомы на ножку гипофиза.
В большинстве случаев у пациенток с акромегалией не наблюдается ухудшения течения заболевания при беременности. Считается, что беременность не стимулирует секрецию СТГ аденомой, продукция СТГ аденомой остается автономной. При этом в начале беременности под действием эстрогенов развивается относительная резистентность гепатоцитов к действию СТГ, что проявляется исходным снижением уровня ИФР-1 в крови с дальнейшим повышением его концентрации за счет плацентарного ИФР-1, однако обычно уровень ИФР-1 во время беременности не возрастает более чем на 50% [3, 10]. В сериях наблюдений у большинства пациенток с акромегалией при беременности размеры аденомы оставались неизменными даже без медикаментозного лечения [4, 8, 11, 12].
При этом в начале беременности под действием эстрогенов развивается относительная резистентность гепатоцитов к действию СТГ, что проявляется исходным снижением уровня ИФР-1 в крови с дальнейшим повышением его концентрации за счет плацентарного ИФР-1, однако обычно уровень ИФР-1 во время беременности не возрастает более чем на 50% [3, 10]. В сериях наблюдений у большинства пациенток с акромегалией при беременности размеры аденомы оставались неизменными даже без медикаментозного лечения [4, 8, 11, 12].
При наличии активного гиперкортицизма планирование беременности не рекомендуется. Более того, активные акромегалия и гиперкортицизм являются показаниями для искусственного прерывания беременности по медицинским показаниям [13]. Однако в настоящее время накоплен клинический опыт ведения беременности у таких пациенток, который позволяет сохранить жизнь и здоровье матери и ребенка. Ведение такой беременности рекомендуется проводить мультидисциплинарной командой врачей [8, 12, 14].
По данным С. А. Григорьянц и соавт. [15], у беременных женщин с БИК ремиссии удалось добиться в 69% случаев. У пациенток наблюдалась высокая частота осложнений беременности – 77–92%. Наиболее часто регистрировались внутриутробная задержка развития плода, преждевременные роды (более 50% случаев), перинатальная смертность (до 25%). Однако до 70% рожденных детей были практически здоровы, а выявленные отклонения – неспецифичны [3, 4, 15, 16].
А. Григорьянц и соавт. [15], у беременных женщин с БИК ремиссии удалось добиться в 69% случаев. У пациенток наблюдалась высокая частота осложнений беременности – 77–92%. Наиболее часто регистрировались внутриутробная задержка развития плода, преждевременные роды (более 50% случаев), перинатальная смертность (до 25%). Однако до 70% рожденных детей были практически здоровы, а выявленные отклонения – неспецифичны [3, 4, 15, 16].
Согласно данным зарубежных авторов, за историю существования PubMed до июня 2020 г. было описано 62 случая беременности при достоверно диагностированной БИК [12, 14, 17]. При этом более чем в 50% случаев беременность сопровождалась неблагоприятными материнскими или перинатальными исходами. На фоне хирургического и медикаментозного лечения, которое проводилось в 40% случаев, исходы беременности были лучше. Предпочтительным вариантом лечения является трассфеноидальное удаление аденомы гипофиза, при этом варианте наблюдалось более 85% благоприятных перинатальных исходов. Наилучшим временем для проведения операции считается начало II триместра беременности. Еще одним вариантом является медикаментозная терапия, которая назначается во время II и III триместров беременности [17]. При этом препаратом выбора при беременности является метирапон, в то время как кетоконазол обладает тератогенным эффектом и рекомендован только в крайнем случае при непереносимости метирапона [5].
Наилучшим временем для проведения операции считается начало II триместра беременности. Еще одним вариантом является медикаментозная терапия, которая назначается во время II и III триместров беременности [17]. При этом препаратом выбора при беременности является метирапон, в то время как кетоконазол обладает тератогенным эффектом и рекомендован только в крайнем случае при непереносимости метирапона [5].
Вне зависимости от гормональной активности опухоли женщинам с макроаденомами гипофиза (более
1 см) во время беременности рекомендована оценка полей зрения для своевременного выявления отрицательной динамики и проведения соответствующего лечения при необходимости [4, 8, 11, 12]. В нашем случае не наблюдалось супраселлярного роста аденомы гипофиза и риск развития хиазмального синдрома на фоне гиперплазии гипофиза во время беременности был минимальным.
Важнейшими параметрами, оказывающими основное влияние на течение беременности как при акромегалии, так и при гиперкортицизме, являются симптоматические нарушения – артериальная гипертензия и сахарный диабет [4, 8, 11, 12].
Динамика симптомов заболевания, а также изолированное снижение ТТГ в дебюте заболевания при небольшой эндоселлярной аденоме гипофиза позволяют предположить, что опухоль исходно продуцировала АКТГ [10]. При этом, исходя из клиники, выраженность гиперкортицизма была незначительной и обнаружить его можно было только при проведении диагностических проб, которые не были выполнены в течение первых 16 (!) лет после выявления аденомы гипофиза. Тем не менее с точки зрения осуществления репродуктивных планов первая беременность была наиболее благоприятной.
Заключение
Таким образом, за время от дебюта заболевания до операции удаления аденомы пациентка дважды беременела. И несмотря на наличие репродуктивных планов, оба раза было принято решение о прерывании беременности. При этом, согласно современным представлениям, наличие гиперпролактинемии и аденомы гипофиза не является противопоказанием для беременности. Более того, в большинстве случаев во время беременности не происходит прогрессирования пролактинсекретирующих опухолей гипофиза [7]. Наличие аденомы гипофиза, секретирующей гормон роста, а тем более АКТГ, является крайне неблагоприятным фоном для развития беременности, однако с учетом существующих способов лечения также не является абсолютным противопоказанием для беременности и родов. При сохранении нарушения функции тиреотрофов со снижением ТТГ на фоне гиперкортицизма при беременности вести пациентку следует исходя из принципов ведения беременных с вторичным гипотиреозом.
Наличие аденомы гипофиза, секретирующей гормон роста, а тем более АКТГ, является крайне неблагоприятным фоном для развития беременности, однако с учетом существующих способов лечения также не является абсолютным противопоказанием для беременности и родов. При сохранении нарушения функции тиреотрофов со снижением ТТГ на фоне гиперкортицизма при беременности вести пациентку следует исходя из принципов ведения беременных с вторичным гипотиреозом.
У данной пациентки наиболее благоприятным в отношении перинатальных исходов представляется сохранение первой беременности, в период минимальной выраженности артериальной гипертензии и сахарного диабета, ухудшающих прогноз.
Дополнительная информация
Согласие пациентки. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Сonflict of interests. The author declares that there is not conflict of interests.
The author declares that there is not conflict of interests.
Гусова Анна Аузбиевна – канд. мед. наук, ФГБУ ФНКЦСМ ФМБА России. E-mail: [email protected]
Anna A. Gusova – Cand. Sci. (Med.), Federal Research and Clinical Center of Sports Medicine and Rehabilitation of the Federal Medical Biological Agency of Russia. Е-mail: [email protected]
Список исп. литературыСкрыть список
1. Ezzat S, Asa SL, Couldwell WT et al. The prevalence of pituitary adenomas. Cancer 2004; 101 (3): 613–9.
2. Дзеранова Л.К., Абойшева Е.А., Федорова Н.С. и др. Сложности в диагностике аденом со смешанной секрецией соматотропного гормона и пролактина. Ожирение и метаболизм. 2020; 17 (3): 233–40.
[Dzeranova L.K., Aboisheva E.A., Fedorova N.S. et al. Slozhnosti v diagnostike adenom so smeshannoi sekretsiei somatotropnogo gormona i prolaktina. Ozhirenie i metabolizm. 2020; 17 (3): 233–40 (in Russian).]
3.Пронин В.С., Потешкин Ю.Е., Гитель Е.П. и др. Современная стратегия диагностики и лечения соматотропином. М.:
ГЭОТАР-Медиа, 2013.
[Pronin V.S., Poteshkin Yu.E., Gitel E.P. Modern strategy of diagnosis and treatment with somatotropin. Moscow: GEOTAR-Media, 2013 (in Russian).]
4. Общественная организация «Российская ассоциация эндокринологов». Клинические рекомендации. Акромегалия: клиника, диагностика, дифференциальная диагностика, методы лечения. М., 2014.
[Public organization «Russian Association of Endocrinologists». Clinical guidelines. Acromegaly: clinic, diagnosis, differential diagnosis, methods of treatment. Moscow, 2014 (in Russian).]
5. Общественная организация «Российская ассоциация эндокринологов». Проект клинических рекомендаций. Болезнь Иценко–Кушинга. М., 2021.
[Public organization «Russian Association of Endocrinologists». Draft clinical guidelines. Itsenko-Cushing’s disease. Moscow, 2021 (in Russian).]
6.Дзеранова Л.К., Быканова Н.С., Пигарова Е.А. Гиперпролактинемия и беременность: основные достижения и нерешенные вопросы. Вестн. репродуктивного здоровья. 2011; февраль: 16–21.
[Dzeranova L.K., Bykanova N.S., Pigarova E.A. Giperprolaktinemiia i beremennost’: osnovnye dostizheniia i nereshennye voprosy. Vestn. reproduktivnogo zdorov’ia. 2011; fevral’: 16–21 (in Russian).]
7. Общественная организация «Российская ассоциация эндокринологов». Клинические рекомендации по гиперпролактинемии: клиника, диагностика, дифференциальная диагностика и методы лечения. М., 2014.
[Public organization «Russian Association of Endocrinologists». Clinical guidelines for hyperprolactinemia: clinic, diagnosis, differential diagnosis and treatment methods. Moscow, 2014 (in Russian).]
8. Petersenn S, Christ-Crain M, Droste M et al. Pituitary Disease in Pregnancy: Special Aspects of Diagnosis and Treatment? Geburtshilfe und Frauenheilkunde 2019; 79 (4): 365–74.
9.Tamada D, Kitamura T, Takahara M et al. TSH ratio as a novel diagnostic method for Cushing’s syndrome. Endocrine J 2018; 65 (8): 841–8.
10. Laway BA. Pregnancy in acromegaly. Ther Adv Endocrinol Metab 2015; 6 (6): 267–72.
11. Chanson P, Vialon M, Caron P. An update on clinical care for pregnant women with acromegaly. Expert Rev Endocrinol Metab 2019; 14 (2): 85–96.
12. Luger A, Broersen LHA, Biermasz NR et al. ESE Clinical Practice Guideline on functioning and nonfunctioning pituitary adenomas in pregnancy. Eur J Endocrinol 2021; 185 (3): G1–G33.
13. Приказ Министерства здравоохранения и социального развития РФ от 3 декабря 2007 г. №736 «Об утверждении перечня медицинских показаний для искусственного прерывания беременности» с изменениями и дополнениями от 27 декабря
2011 г.
[Prikaz Ministerstva zdravookhraneniia i sotsial’nogo razvitiia RF ot 3 dekabria 2007 g. №736 «Ob utverzhdenii perechnia meditsinskikh pokazanii dlia iskusstvennogo preryvaniia beremennosti’ s izmeneniiami i dopolneniiami ot 27 dekabria 2011 g.]
14. Sridharan K, Sahoo J, Palui R et al. Diagnosis and treatment outcomes of Cushing’s disease during pregnancy. Pituitary 2021; 24 (5): 670–80.
15. Григорьянц С.А., Белая Ж.Е., Мельниченко Г.А. и др. Течение беременности и родов и их последствия у пациенток с болезнью Иценко–Кушинга (БИК). Проблемы эндокринологии. 2016; 62 (5): 35–6.
[Grigor’iants S.A., Belaia Zh.E., Mel’nichenko G.A. et al. Techenie beremennosti i rodov i ikh posledstviia u patsientok s bolezn’iu Itsenko–Kushinga (BIK). Problemy endokrinologii. 2016; 62 (5): 35–6 (in Russian).]
16. Репина М.А. Гиперкортицизм и беременность. Журнал акушерства и женских болезней. 2017; 66 (3): 116–23.
[Repina M.A. Giperkortitsizm i beremennost’. Zhurnal akusherstva i zhenskikh boleznei. 2017; 66 (3): 116–23 (in Russian).]
17. Benothman W, Saad G, Kacem M, Ach K. Three Successful Pregnancies in a Patient with Recurrent Cushing’s Disease. Case Rep Endocrinol 2021; 1: 1–5.
29 декабря 2022
Количество просмотров: 315
Предыдущая статьяСпецифические дерматозы беременности
Следующая статьяКлинический случай беременности у пациентки с зеркальным расположением органов
Вопрос задает – Наталия, 27, Иркутск по теме: Беременность
Здравствуйте, Мне 27 лет уже 2 года я не могу забеременеть. При обследовании на гормоны в 2013г. у меня обнаружили повышенный пролактин. В дальнейшем выяснилось что у меня микроаденома гипофиза. При дальнейшем обследовании выяснили, что все остальные гормоны такие как (ТТГ, Т4, ПРОГЕСТЕРОН, ТЕСТОСТЕРОН,ЛГ,ФСГ,ЭСТРАДИОЛ,ДГЭА-СУЛЬФАТ все в норме)сдавала в июле 2013г. Физически тоже здорова, трубы проходимы делала процедуру контраст водят в матку а потом ренгеном смотрят(Заключение: матка незначительно смещена в право размеры ее не изменены, контуры ровные, четкие. По форе матка похожа не седловидную, на всем протежении трубы извитые, правая подтянута вверх и на органе костей отмечается выход контраста в полость малого таза. Слева так же отмечается выход контраста.) процедура была в августе 2014г., муж здоров, здавал спепрмограмму. Но до сих пор у нас нет детей. С марта 2013 по 2014 не могли восстановить пролактин постоянно прыгал то вверх то вниз, меняла множество врачей, но все без толку. В итоге поехала в Иркутск к врачу к Сутуриной, которая после осмотра и всех моих бумажек отправила на лапароскопию и сказала: «Забыть про пролактин так как дело не в нем, и в снимке на проходимость я очень сомневаюсь».
При обследовании на гормоны в 2013г. у меня обнаружили повышенный пролактин. В дальнейшем выяснилось что у меня микроаденома гипофиза. При дальнейшем обследовании выяснили, что все остальные гормоны такие как (ТТГ, Т4, ПРОГЕСТЕРОН, ТЕСТОСТЕРОН,ЛГ,ФСГ,ЭСТРАДИОЛ,ДГЭА-СУЛЬФАТ все в норме)сдавала в июле 2013г. Физически тоже здорова, трубы проходимы делала процедуру контраст водят в матку а потом ренгеном смотрят(Заключение: матка незначительно смещена в право размеры ее не изменены, контуры ровные, четкие. По форе матка похожа не седловидную, на всем протежении трубы извитые, правая подтянута вверх и на органе костей отмечается выход контраста в полость малого таза. Слева так же отмечается выход контраста.) процедура была в августе 2014г., муж здоров, здавал спепрмограмму. Но до сих пор у нас нет детей. С марта 2013 по 2014 не могли восстановить пролактин постоянно прыгал то вверх то вниз, меняла множество врачей, но все без толку. В итоге поехала в Иркутск к врачу к Сутуриной, которая после осмотра и всех моих бумажек отправила на лапароскопию и сказала: «Забыть про пролактин так как дело не в нем, и в снимке на проходимость я очень сомневаюсь». Я так и сделала перестала пить достинекс, но на операцию не поехала т.к. в ЖД больнице Иркутска заведующая отделения сказала, что показаний не видит и посоветовала еще у кого- нибудь проконсультироваться. Вообщем вернулась я обратно ни с чем! И начала все заново. Уже у другого врача.
Я так и сделала перестала пить достинекс, но на операцию не поехала т.к. в ЖД больнице Иркутска заведующая отделения сказала, что показаний не видит и посоветовала еще у кого- нибудь проконсультироваться. Вообщем вернулась я обратно ни с чем! И начала все заново. Уже у другого врача.
При сдаче анализов на пролактин выяснилось, что пролактин опять взлетел выше нормы, начала опять пить агалатес. Ни на какие анализы меня больше не отправляли. Стала ходить на УЗИ каждый месяц и вести график базальной температуры. Месячные шли как попало до 10-и дней,первые 5-6 дней идет мазня потом 1-много кусков и крови, а потом еще несколько дней мазня. Спустя два месяца врач решил что у меня короткая вторая фаза, овуляция была и назначила мне дюфастон по 20мл. в день во вторую фазу(хотя прогестерон по анализам был в норме), следующий цикл оказался без овуляции, но цикл удлинился, я продолжала пить дюфастон.Четвертый цикл тоже без овуляции,а еще опять стал коротким. На пятый я узи не делала, а по графику овуляции не было. А вот в январе 2015г. произошло чудо, как я тогда думала, у меня пришли месячные и были без боли множества сгустков и шли всего 6 дней. Я пошла к своему врачу и она меня отправила к вам на лапароскопию, а потом делать ЭКО. т.к. не знает что ЕЩЕ со мной делать. Но вот на 13-й день цикла у меня пошла мазня, я позвонила к врачу, а она сказала, сделать узи и к ней, что у меня воспалительный. На УЗИ оказалось все хорошо и овуляция была. Мой врач после узи сказала продолжать пить дюфастон и ждать нормальных месячных, не назначила никаких анализов и даже не осмотрела меня,но мазня с кровью не останавливается и я даже не знаю, что делать. ПОСОВЕТУЙТЕ ЧТО-НИБУДЬ ПОЖАЛУЙСТА,хотя бы до того как я приеду к вам. Что мне делать с этой мазней? Пить дюфастон или нет?
А вот в январе 2015г. произошло чудо, как я тогда думала, у меня пришли месячные и были без боли множества сгустков и шли всего 6 дней. Я пошла к своему врачу и она меня отправила к вам на лапароскопию, а потом делать ЭКО. т.к. не знает что ЕЩЕ со мной делать. Но вот на 13-й день цикла у меня пошла мазня, я позвонила к врачу, а она сказала, сделать узи и к ней, что у меня воспалительный. На УЗИ оказалось все хорошо и овуляция была. Мой врач после узи сказала продолжать пить дюфастон и ждать нормальных месячных, не назначила никаких анализов и даже не осмотрела меня,но мазня с кровью не останавливается и я даже не знаю, что делать. ПОСОВЕТУЙТЕ ЧТО-НИБУДЬ ПОЖАЛУЙСТА,хотя бы до того как я приеду к вам. Что мне делать с этой мазней? Пить дюфастон или нет?
границ | Лечение пролактином во время беременности
Введение
Пролактиномы представляют собой аденомы, возникающие из лактотрофных клеток гипофиза, секретирующих пролактин, и считаются наиболее часто диагностируемым типом функционирующей опухоли гипофиза, на долю которого приходится около 40% всех аденом гипофиза (1).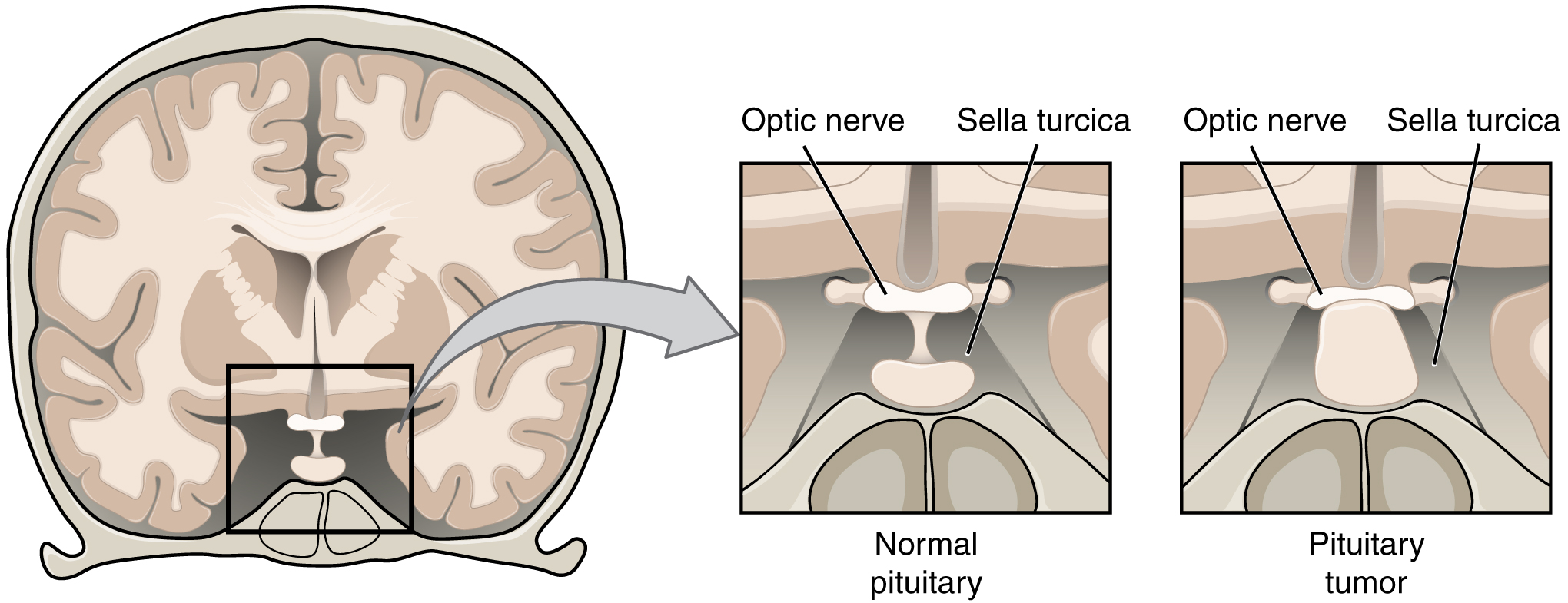 Производство и высвобождение пролактина опосредовано тоническим ингибированием дофамином, секретируемым гипоталамусом. Молочная железа является основной тканью-мишенью для пролактина, но рецепторы пролактина были обнаружены в нескольких тканях, включая печень, яичники, яички и предстательную железу (2). Основное действие пролактина заключается в инициации и поддержании лактации, но он может действовать как фактор роста, нейротрансмиттер или иммунорегулятор посредством аутокринных или паракринных механизмов (3).
Производство и высвобождение пролактина опосредовано тоническим ингибированием дофамином, секретируемым гипоталамусом. Молочная железа является основной тканью-мишенью для пролактина, но рецепторы пролактина были обнаружены в нескольких тканях, включая печень, яичники, яички и предстательную железу (2). Основное действие пролактина заключается в инициации и поддержании лактации, но он может действовать как фактор роста, нейротрансмиттер или иммунорегулятор посредством аутокринных или паракринных механизмов (3).
Пролактиномы являются одной из причин гиперпролактинемии, состояния, при котором 90% составляют межселлярные аденомы и 10% — макроаденомы (≥10 мм) (4). Пролактиномы встречаются с распространенностью 60–100 случаев на миллион (1). Чаще встречается у женщин, особенно в репродуктивном периоде. Самый высокий показатель заболеваемости был обнаружен у женщин в возрасте от 25 до 34 лет: 23,9/100 000 человеко-лет (4). У женщин пролактиномы обычно представляют собой микроаденомы (<10 мм) с высоким уровнем пролактина, что приводит к аменорее, галакторее и бесплодию. Мужчины с пролактиномами часто имеют симптомы масс-эффекта, такие как головная боль и потеря зрения, а иногда и гипогонадизм и бесплодие. Потеря костной массы может возникать как долгосрочное последствие гиперпролактинемии как у мужчин, так и у женщин.
Мужчины с пролактиномами часто имеют симптомы масс-эффекта, такие как головная боль и потеря зрения, а иногда и гипогонадизм и бесплодие. Потеря костной массы может возникать как долгосрочное последствие гиперпролактинемии как у мужчин, так и у женщин.
Агонисты дофамина (ДА) все чаще используются в качестве средств выбора для лечения пролактином, поскольку они нормализуют уровень пролактина и приводят к уменьшению размера опухоли. Хирургия в настоящее время зарезервирована для резистентности или непереносимости DA, в то время как лучевая терапия используется только в случаях хирургической неудачи или резистентности к DA.
Во время беременности гипофиз подвергается глобальной гиперплазии из-за прогрессирующего повышения уровня эстрогенов в сыворотке крови, что может привести к увеличению объема опухоли с потенциальным эффектом массы и потерей зрения, что представляет собой серьезную проблему для эндокринологов.
Пролактинома во время беременности
Опухолевые клетки у пациентов с пролактиномами экспрессируют рецепторы эстрогена; в результате повышенного уровня эстрогена во время беременности (5) может наблюдаться значительное увеличение объема пролактиномы с прогрессирующим повышением уровня пролактина в сыворотке вследствие гиперплазии лактотрофных клеток (6).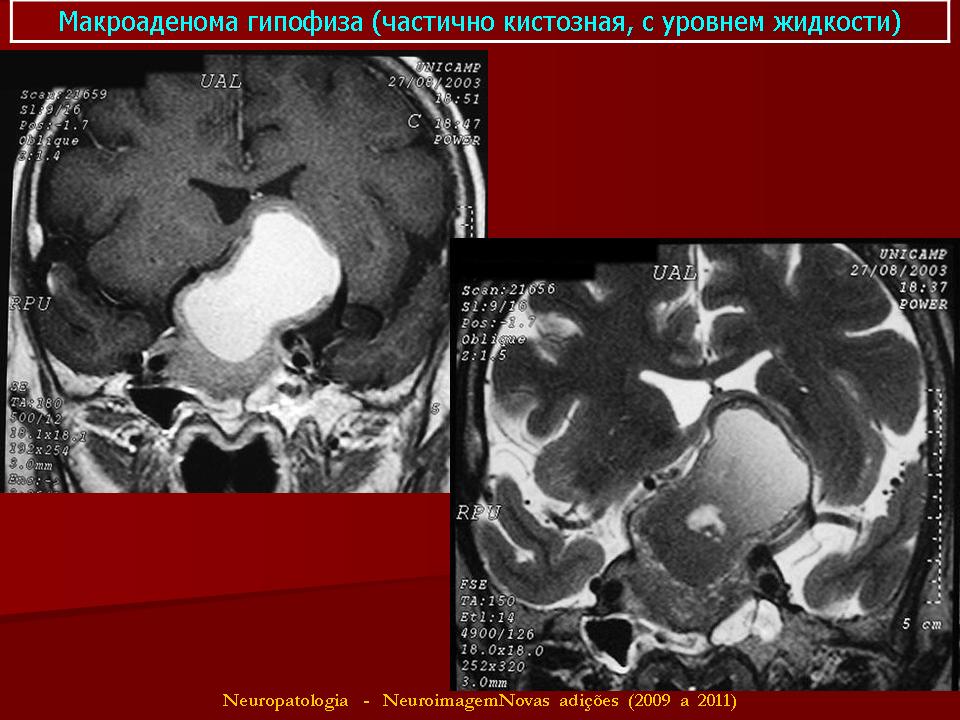 Основной проблемой является возможное увеличение опухоли во время беременности. Установлено, что риск увеличения опухоли во время беременности зависит от размера опухоли. Имеющиеся в литературе данные показывают, что, хотя увеличение опухоли составляет всего 3% для микропролактином, оно достигает 32% для макропролактином, которые ранее не оперировались (7).
Основной проблемой является возможное увеличение опухоли во время беременности. Установлено, что риск увеличения опухоли во время беременности зависит от размера опухоли. Имеющиеся в литературе данные показывают, что, хотя увеличение опухоли составляет всего 3% для микропролактином, оно достигает 32% для макропролактином, которые ранее не оперировались (7).
Перед зачатием следует провести магнитно-резонансную томографию (МРТ), чтобы задокументировать размер опухоли и использовать ее в качестве исходной точки для сравнения с МРТ, проведенной во время беременности. Кроме того, МРТ помогает отличить кровоизлияние в опухоль от простого увеличения опухоли во время беременности (8).
Хотя было обнаружено, что пролактиномы поддаются медикаментозному лечению во время беременности, особенно с помощью DA, таких как бромокриптин, недостаточно данных о безопасности, чтобы рекомендовать рутинное использование этих препаратов во время беременности. Клинические рекомендации общества эндокринологов по ведению и лечению пролактином рекомендуют прекращение приема DA вскоре после подтверждения беременности, за исключением женщин с инвазивными макропролактиномами (5).
Бромокриптин является производным эрголина, агонистом дофаминовых D2-рецепторов с агонистическими и антагонистическими свойствами в отношении D1-рецепторов. Обычно требуется многократный прием в течение дня из-за короткого периода полувыведения (9–11). У женщин, принимающих бромокриптин на ранних сроках беременности, частота абортов, внематочной беременности или врожденных пороков развития не выше, чем в общей популяции (12). В исследовании 2587 беременных женщин, из которых у 2437 был повышен риск самопроизвольного аборта, врожденных аномалий или многоплодной беременности и не влиял на постнатальное развитие (13). В других исследованиях среди 6329у пациенток, получавших бромокриптин в ранние сроки беременности, риск самопроизвольных абортов составил 9,9%, что не выше, чем в общей популяции (10,9%) (7, 14). Кроме того, длительное наблюдение до 9 лет детей, рожденных от матерей, принимавших бромокриптин, не вызывало неблагоприятного воздействия на исходы плода с точки зрения физического развития, а также не сообщалось о нарушениях психомоторного развития в течение 5,5 лет (1–20 лет) наблюдения (15).
Кроме того, оптимальный результат был обнаружен при непрерывном применении бромокриптина на протяжении всей беременности примерно в 100 случаях (16).
Каберголин является дофаминовым производным эрголина с более высокой аффинностью и селективностью в отношении дофаминовых рецепторов D2. Он имеет большую продолжительность действия, что позволяет применять его один или два раза в неделю с лучшей переносимостью и соблюдением пациентом режима лечения (17–20). Более того, частота наступления беременности у бесплодных женщин с пролактиномой выше при применении каберголина, чем при применении бромокриптина (21).
Те же результаты были получены у женщин, принимавших каберголин до и во время беременности (22, 23). В одном отчете было описано более 800 таких беременностей (24) (из которых примерно 350 были подвержены воздействию в течение первых недель беременности) без существенной разницы в частоте самопроизвольных абортов, преждевременных родов, многоплодной беременности или пороков развития новорожденных (25, 26).
В ретроспективном исследовании 103 беременностей у 90 женщин с гиперпролактинемией и последующем наблюдении за 61 ребенком не было выявлено значительных отклонений, связанных ни с дозами каберголина, ни со временем воздействия (27). Данные 12-летнего наблюдения за детьми, рожденными от матерей, получавших каберголин, не выявили влияния на их постнатальное развитие в виде физических проблем или задержке психомоторного развития (28). В соответствии с предыдущими исследованиями, результаты метаанализа не показали значительного увеличения риска выкидышей или пороков развития плода при использовании DA (29).).
Хинаголид – это DA, не являющийся спорыньей, с селективным агонистом рецептора допамина-2 и длительным эффектом снижения уровня пролактина. Его обычно принимают один раз в день, и он лучше переносится и имеет удобный график дозирования, чем бромокриптин (13, 30, 31). Он имеет ограниченную безопасность по сравнению с бромокриптином. В обзоре 176 беременностей, при которых использовался хинаголид (в среднем 37 дней), самопроизвольный аборт произошел в 14% случаев, 1 преждевременные роды и 1 внематочная беременность (13). В другом небольшом исследовании девяти беременностей было два случая лечения двумя хинаголидами без осложнений (31).
В другом небольшом исследовании девяти беременностей было два случая лечения двумя хинаголидами без осложнений (31).
Было зарегистрировано более 200 беременностей у женщин, принимавших хинаголид, при этом не было выявлено явных неблагоприятных эффектов на течение беременности или развитие плода (32).
Следовательно, каждая женщина с пролактиномой должна быть осведомлена о естественном течении пролактиномы и должна обсудить свои планы на зачатие со своим врачом, чтобы пройти тщательное обследование перед беременностью.
Выбор подходящего варианта лечения зависит от размера опухоли. Предлагаемый терапевтический подход показан на рисунке 1 (33). Исходы пролактином после беременности широко обсуждались с различными результатами. Недавнее исследование показало нормализацию уровня пролактина более чем на 40% без медикаментозного лечения при медиане наблюдения в течение 22 месяцев после родов и прекращения лактации (34).
Рисунок 1. Подход к лечению пролактином во время беременности .
Лечение микропролактином во время беременности
Микропролактиномы у небеременных женщин имеют тенденцию к доброкачественному течению. Риск значительного бессимптомного роста опухоли во время беременности составляет 4,5% (35), а симптоматического роста опухоли <2% (36). Риск развития новых неврологических осложнений (головные боли, сдавление зрительного нерва и др.) колеблется от 1,6 до 5,5% (37). Пролактин имеет тенденцию к увеличению во время беременности; следовательно, он не отражает достоверно увеличение размера опухоли и бесполезен для клинической оценки.
В связи с очень низким риском увеличения микропролактиномы во время беременности имеются убедительные данные, подтверждающие необходимость прекращения лечения DA после подтверждения беременности. Пациентке следует сообщить, что риск увеличения аденомы во время беременности очень мал, и при появлении симптомов медикаментозное лечение, скорее всего, будет эффективным.
В случае появления необычных симптомов, таких как сильная головная боль или нарушение зрения, пациенту следует обратиться для срочного обследования, чтобы исключить возможность увеличения опухоли. Серийное определение пролактина не требуется из-за высокой изменчивости пролактина во время беременности (38).
Серийное определение пролактина не требуется из-за высокой изменчивости пролактина во время беременности (38).
При постановке диагноза пациентке следует пройти базовое формальное исследование поля зрения, а во время беременности следует проводить клиническое наблюдение каждые 2–3 месяца (33), но серийные МРТ-исследования или исследование поля зрения во время беременности не требуются. Однако нет данных, подтверждающих вред для плода ни от МРТ, ни от гадолиния (8).
Если у пациента появляются симптомы нарушения зрения или прогрессирующие головные боли, следует провести МРТ без гадолиния (не КТ) для оценки изменений размера опухоли (39).
Если очевиден значительный рост опухоли, следует немедленно возобновить прием DA бромокриптина (36), так как в таких случаях он является препаратом первого выбора.
У женщин, у которых симптомы не проявляются на протяжении всей беременности, уровень пролактина в сыворотке следует измерять через 2 месяца после родов или прекращения кормления грудью, и, если он аналогичен значению до лечения, следует возобновить прием препарата (40).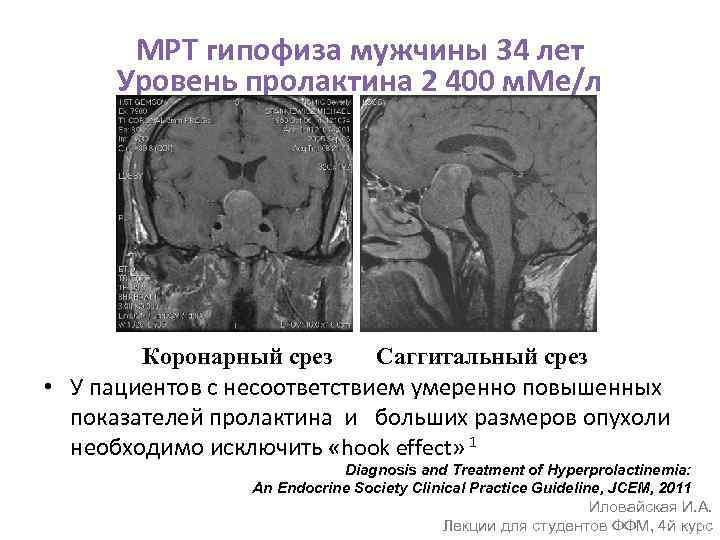 Точно так же женщинам, желающим кормить грудью, следует провести МРТ, чтобы убедиться в стабильности опухоли в течение 4–6 недель после родов (37), поскольку доп снижают уровень пролактина в сыворотке, что впоследствии ухудшает лактацию.
Точно так же женщинам, желающим кормить грудью, следует провести МРТ, чтобы убедиться в стабильности опухоли в течение 4–6 недель после родов (37), поскольку доп снижают уровень пролактина в сыворотке, что впоследствии ухудшает лактацию.
Лечение макропролактином во время беременности
У женщин макропролактиномы встречаются реже, чем микропролактиномы. При макропролактиноме симптоматическое увеличение опухоли наблюдается в 20–30% случаев (41). Сообщалось, что риск клинически значимого увеличения опухоли падает с более чем 30% до <5%, если пациентка лечится лучевой или хирургической операцией до беременности (25).
Беременные женщины с большими опухолями и женщины с экстраселлярным распространением, которые прекратили прием бромокриптина, подвержены риску роста опухоли, поэтому в каждом триместре необходимо проводить официальное исследование поля зрения. Так же, как и при микропролактиномах, нет необходимости измерять уровень пролактина в сыворотке на протяжении всей беременности, потому что уровни неравномерно увеличиваются во время беременности и не коррелируют с увеличением опухоли (8, 25). Кроме того, в этих случаях лечение должно быть индивидуализированным, так как данные, сравнивающие различные стратегии лечения, отсутствуют.
Кроме того, в этих случаях лечение должно быть индивидуализированным, так как данные, сравнивающие различные стратегии лечения, отсутствуют.
Пациентка должна быть проинформирована об относительно более высоком риске роста опухоли, необходимости нормализации уровня пролактина и важности лечения до зачатия.
В случае интраселлярных и небольших макропролактином, которые не прилегают к перекресту зрительных нервов, прием ДА следует прекратить при подтверждении беременности.
Пациент должен быть проинформирован о симптомах и необходимости срочного обследования при их появлении. В каждом триместре следует проводить тщательный клинический мониторинг с формальным исследованием поля зрения. Если пациент жалуется на головную боль или изменение зрения, следует провести МРТ. Если результаты МРТ подтверждают увеличение опухоли, женщине следует повторно назначить DA (5).
Бромокриптин считается препаратом первого выбора, и он обычно уменьшает размер аденомы и устраняет симптомы (42). Каберголин можно рассмотреть, если аденома не реагирует на бромокриптин (43).
Каберголин можно рассмотреть, если аденома не реагирует на бромокриптин (43).
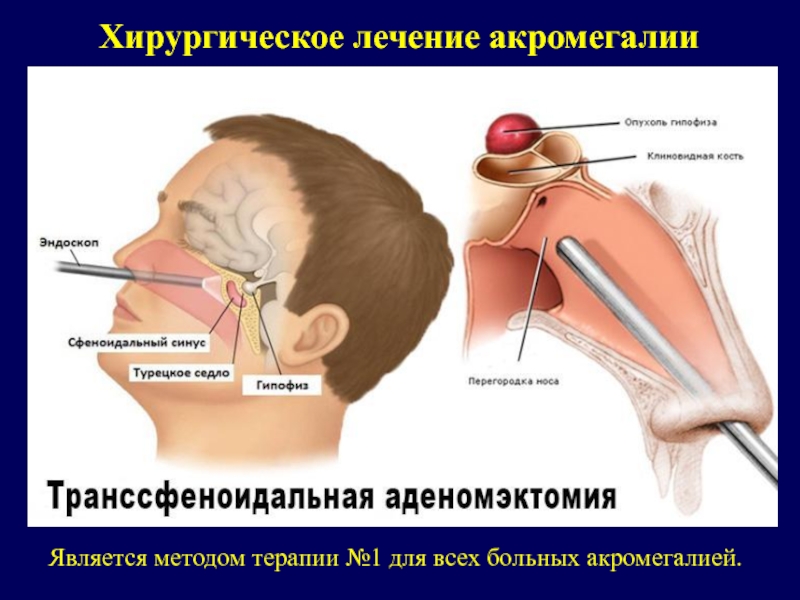
Если увеличенная опухоль не реагирует на терапию каберголином, альтернативы включают транссфеноидальную операцию во втором триместре или родоразрешение, если беременность находится на достаточном сроке (16, 25, 41).
Пациентам с большими макропролактиномами и пациентам с экстраселлярным распространением настоятельно не рекомендуется забеременеть до тех пор, пока не будет проведена радикальная терапия. Терапию с хирургическим уменьшением объема можно рассмотреть до беременности, поскольку было показано, что хирургическое вмешательство или лучевая терапия снижают риск симптоматического увеличения опухоли (25), но в этих случаях существует высокий риск гипопитуитаризма. Однако операция по удалению опухоли менее предпочтительна, поскольку медикаментозная терапия во время беременности, вероятно, менее вредна, чем операция (41). Женщины с пролактиномами, устойчивыми к DA, обычно бесплодны. Таким образом, беременность в этих случаях является неожиданной, если они не подвергаются стимуляции яичников гонадотропинами или ГнРГ. Кроме того, беременность не рекомендуется женщинам с резистентными к лекарственным препаратам большими макропролактиномами, и они не должны забеременеть, даже если опухоль является интраселлярной, до тех пор, пока размер не будет уменьшен с помощью транссфеноидальной хирургии.
Кроме того, беременность не рекомендуется женщинам с резистентными к лекарственным препаратам большими макропролактиномами, и они не должны забеременеть, даже если опухоль является интраселлярной, до тех пор, пока размер не будет уменьшен с помощью транссфеноидальной хирургии.
Хирургическое вмешательство возможно в случаях, когда опухоль не уменьшилась во время медикаментозного лечения DA или у тех, у кого развился рост опухоли во время предыдущей беременности (44).
Влияние беременности и грудного вскармливания на уровень пролактина, объем опухоли и частоту ремиссий
В современной литературе показано, что беременность вызывает ремиссию гиперпролактинемии у двух третей женщин после прекращения приема ДА. В одном исследовании было обнаружено, что беременность вызывает ремиссию в 76% случаев неопухолевой гиперпролактинемии (NTHP), в 70% случаев микропролактином и в 64% случаев макропролактином с более высокой частотой рецидивов среди пациентов с макропролактиномами и пациентов с микропролактиномами с видимой опухолью на МРТ на момент прекращения лечения (45).
В недавнем исследовании полная ремиссия была обнаружена у 100% пациентов с НТГП, у 66% пациентов с микропролактиномами и у 70% пациентов с макропролактиномами (46). Основные механизмы неясны, но обычно связывают с аутоинфарктом опухоли (46).
С другой стороны, нет данных, позволяющих предположить, что грудное вскармливание связано с повышенной выработкой пролактина или риском увеличения опухоли (28, 46). Таким образом, женщины могли нормально кормить грудью и возобновлять ДА после прекращения лактации.
Заключение
Лечение пролактиномы во время беременности является сложной задачей. Клинические испытания, подчеркивающие результаты медикаментозной терапии по сравнению с другими видами лечения, немногочисленны; поэтому пациент лечится на индивидуальной основе. Исход микроаденомы превосходный, что позволяет пациентам безопасно прекратить прием DA при тщательном клиническом наблюдении; с другой стороны, макроаденому необходимо лечить до зачатия, так как риск увеличения опухоли относительно высок.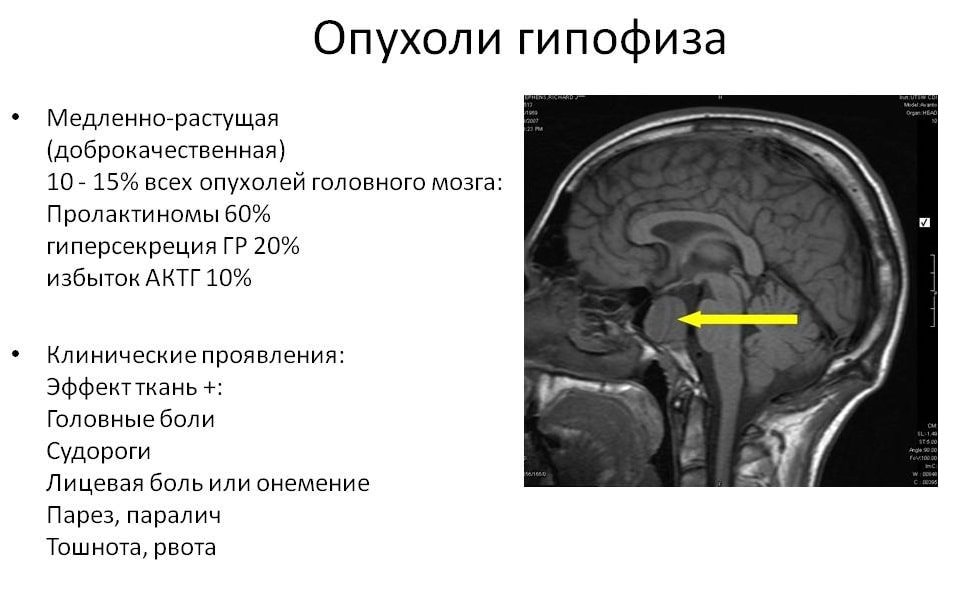
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Ссылки
1. Чиккарелли А., Дали А.Ф., Беккерс А. Эпидемиология пролактином. Гипофиз (2005) 8 (1):3–6. doi: 10.1007/s11102-005-5079-0
Полный текст перекрестной ссылки | Академия Google
2. Индер В.Дж. Гиперпролактинемия – дифференциальный диагноз, обследование и лечение. Eur Endocr Rev (2006): 76–1002.
Академия Google
3. Карс М., Деккерс О.М., Перейра А.М., Ромейн Я.А. Обновление в пролактиномах. Neth J Med (2010) 68 (3):104–12.
PubMed Резюме | Академия Google
4. Молич М.Е. пролактинома. Гипофиз . Кембридж, Индиана: Наука Блэквелла (1995). п. 433–77.
Академия Google
5. Мелмед С., Казануева Ф.Ф., Хоффман А.Р., Клейнберг Д.Л., Монтори В.М., Шлехте Дж.А. и соавт. Диагностика и лечение гиперпролактинемии: руководство по клинической практике эндокринологического общества. J Clin Endocrinol Metab (2011) 96 (2):273–88. doi:10.1210/jc.2010-1692
Мелмед С., Казануева Ф.Ф., Хоффман А.Р., Клейнберг Д.Л., Монтори В.М., Шлехте Дж.А. и соавт. Диагностика и лечение гиперпролактинемии: руководство по клинической практике эндокринологического общества. J Clin Endocrinol Metab (2011) 96 (2):273–88. doi:10.1210/jc.2010-1692
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
6. Пишон М.Ф., Брессион Д., Пейон Ф., Милгром Э. Рецепторы эстрогена в аденомах гипофиза человека. J Clin Endocrinol Metab (1980) 51 (4):897–902. doi:10.1210/jcem-51-4-897
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
7. Gillam MP, Molitch ME, Lombardi G, Colao A. Достижения в лечении пролактином. Endocr Rev (2006) 27 (5): 485–534. doi:10.1210/er.2005-9998
Полный текст перекрестной ссылки | Академия Google
8. Молич М.Е. Эндокринология при беременности: ведение беременной с пролактиномой. Eur J Endocrinol (2015) 172 (5):R205–13. дои: 10.1530/EJE-14-0848
Eur J Endocrinol (2015) 172 (5):R205–13. дои: 10.1530/EJE-14-0848
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
9. Mah PM, Webster J. Гиперпролактинемия: этиология, диагностика и лечение. Semin Reprod Med (2002) 20 (4):365–74. дои: 10.1055/s-2002-36709
Полный текст перекрестной ссылки | Академия Google
10. Биллер Б.М. Гиперпролактинемия. Int J Fertil Womens Med (1999) 44 (2):74–7.
PubMed Резюме | Академия Google
11. Банковский Б.Дж., Закур Х.А. Терапия агонистами допамина при гиперпролактинемии. Clin Obstet Gynecol (2003) 46 (2): 349–62. дои: 10.1097/00003081-200306000-00013
Полный текст перекрестной ссылки | Академия Google
12. Крупп П., Монка С. Бромокриптин при беременности: аспекты безопасности. Klin Wochenschr (1987) 65 (17):823–7. дои: 10.1007/BF01727477
дои: 10.1007/BF01727477
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
13. Webster J. Сравнительный обзор профилей переносимости агонистов дофамина при лечении гиперпролактинемии и торможении лактации. Безопасность лекарственных средств (1996) 14 (4): 228–38. дои: 10.2165/00002018-199614040-00003
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
14. Нюбо Андерсен А.М., Вольфарт Дж., Кристенс П., Олсен Дж., Мелбай М. Возраст матери и потеря плода: исследование связи регистров на основе популяции. BMJ (2000) 320 (7251): 1708–12. doi:10.1136/bmj.320.7251.1708
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
15. Шибли-Рахал А., Шлехте Дж. Гиперпролактинемия и бесплодие. Endocrinol Metab Clin North Am (2011) 40 (4):837–46. doi:10.1016/j.ecl.2011.08.008
Полный текст перекрестной ссылки | Академия Google
16. Chrisoulidou A., Boudina M., Karavitaki N., Bili E., Wass J. Гипофизарные нарушения во время беременности. Гормоны (2015) 14 (1):70–80. doi:10.14310/горм.2002.1575
Chrisoulidou A., Boudina M., Karavitaki N., Bili E., Wass J. Гипофизарные нарушения во время беременности. Гормоны (2015) 14 (1):70–80. doi:10.14310/горм.2002.1575
Полный текст перекрестной ссылки | Академия Google
17. Колао А., Ди Сарно А., Сарнаккиаро Ф., Фероне Д., Ди Ренцо Г., Мерола Б. и др. Пролактиномы, резистентные к стандартным агонистам дофамина, реагируют на длительное лечение каберголином. J Clin Endocrinol Metab (1997) 82 (3):876–83. doi:10.1210/jcem.82.8.4178-3
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
18. Verhelst J, Abs R, Maiter D, van den Bruel A, Vandeweghe M, Velkeniers B, et al. Каберголин в лечении гиперпролактинемии: исследование 455 пациентов. J Clin Endocrinol Metab (1999) 84 (7):2518–22. doi:10.1210/jcem.84.7.5810
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
19. Serri O, Chik CL, Ur E, Ezzat S. Диагностика и лечение гиперпролактинемии. CMAJ (2003) 169 (6): 575–81.
Serri O, Chik CL, Ur E, Ezzat S. Диагностика и лечение гиперпролактинемии. CMAJ (2003) 169 (6): 575–81.
PubMed Резюме | Академия Google
20. Лю Дж.К., Кэдвелл В.Т. Современное лечение пролактином. Нейрохирург Фокус (2004) 16 (4):E2. doi:10.3171/foc.2004.16.4.3
Полный текст перекрестной ссылки | Академия Google
21. Оно М., Мики Н., Амано К., Кавамата Т., Секи Т., Макино Р. и др. Индивидуальная терапия высокими дозами каберголина при гиперпролактинемическом бесплодии у женщин с микро- и макропролактиномами. J Clin Endocrinol Metab (2010) 95 (6):2672–9. doi:10.1210/jc.2009-2605
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
22. Ciccarelli E, Grottoli S, Razzore P, Gaia D, Bertagna A, Cirillo S, et al. Длительное лечение каберголином, новым производным эрголина длительного действия, при идиопатической или опухолевой гиперпролактинемии и исходах медикаментозной беременности. J Endocrinol Invest (1997) 20 (9):547–51. дои: 10.1007/BF03348017
J Endocrinol Invest (1997) 20 (9):547–51. дои: 10.1007/BF03348017
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
23. Джонс Дж., Башир Т., Олни Дж., Уитли Т. Лечение каберголином большой макропролактиномы во время беременности. J Obstet Gynaecol (1997) 17 (4):375–6. дои: 10.1080/01443619750112916
Полный текст перекрестной ссылки | Академия Google
24. Молич М.Е. Пролактинома при беременности. Best Pract Res Clin Endocrinol Metab (2011) 25 (6):885–96. doi:10.1016/j.beem.2011.05.011
Полный текст перекрестной ссылки | Академия Google
25. Мусолино Н.Р., Бронштейн М.Д. Пролактиномы и беременность . Издательство Kluwer Academic Publishers (2001). п. 91–108.
Академия Google
26. Риччи Э., Параццини Ф., Мотта Т., Феррари С.И., Колао А., Клавенна А. и др. Исход беременности после лечения каберголином в первые недели гестации. Reprod Toxicol (2002) 16 (6):791–3. дои: 10.1016/S0890-6238(02)00055-2
Reprod Toxicol (2002) 16 (6):791–3. дои: 10.1016/S0890-6238(02)00055-2
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
27. Сталлдекер Г., Маллеа-Гил М.С., Гуительман М., Альфьери А., Балларино М.С., Боэро Л. и соавт. Влияние каберголина на беременность и развитие эмбриона и плода: ретроспективное исследование 103 беременностей и обзор литературы. Гипофиз (2010) 13 (4):345–50. дои: 10.1007/s11102-010-0243-6
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
28. Леббе М., Хубинонт С., Бернард П., Майтер Д. Исход 100 беременностей, начавшихся на фоне лечения каберголином у женщин с гиперпролактинемией. Clin Endocrinol (2010) 73 (2):236–42. doi:10.1111/j.1365-2265.2010.03808.x
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
29. Ван А.Т., Муллан Р.Дж., Лейн М.А., Хазем А., Прасад С.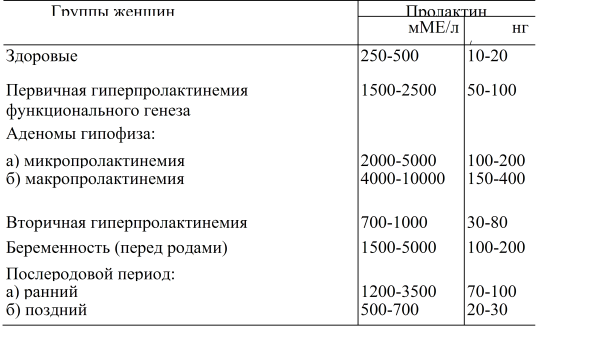 , Гатайя Н.В. и соавт. Лечение гиперпролактинемии: систематический обзор и метаанализ. Syst Rev (2012) 1 :33. дои: 10.1186/2046-4053-1-33
, Гатайя Н.В. и соавт. Лечение гиперпролактинемии: систематический обзор и метаанализ. Syst Rev (2012) 1 :33. дои: 10.1186/2046-4053-1-33
Полный текст перекрестной ссылки | Академия Google
30. Дюранто Л., Шансон П., Лавуанн А., Хорлейт С., Любецки Дж., Кун Дж.М. Влияние нового дофаминергического агониста CV 205-502 на уровни пролактина в плазме и размер опухоли при резистентных к бромокриптину пролактиномах. Clin Endocrinol (1991) 34 (1):25–9. doi:10.1111/j.1365-2265.1991.tb01731.x
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
31. Morange I, Barlier A, Pellegrini I, Brue T, Enjalbert A, Jaquet P. Пролактиномы, устойчивые к бромокриптину: долгосрочная эффективность хинаголида и исход беременности. Eur J Endocrinol (1996) 135 (4):413–20. doi:10.1530/eje.0.1350413
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
32. Webster J. Клиническое лечение пролактином. Baillieres Best Pract Res Clin Endocrinol Metab (1999) 13 (3):395–408. doi:10.1053/beem.1999.0030
Webster J. Клиническое лечение пролактином. Baillieres Best Pract Res Clin Endocrinol Metab (1999) 13 (3):395–408. doi:10.1053/beem.1999.0030
Полный текст перекрестной ссылки | Академия Google
33. Имран С.А., Ур Э., Кларк Д.Б. Лечение пролактинсекретирующих аденом во время беременности. Can Fam Physician (2007) 53 (4):653–8.
PubMed Резюме | Академия Google
34. Domingue ME, Devuyst F, Alexopoulou O, Corvilain B, Maiter D. Исход пролактиномы после беременности и кормления грудью: исследование 73 пациентов. Clin Endocrinol (2014) 80 (5):642–8. дои: 10.1111/сен.12370
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
35. Молич М.Е. Беременность и женщина с гиперпролактинемией. N Engl J Med (1985) 312 (21):1364–70. дои: 10.1056/NEJM198505233122106
Полный текст перекрестной ссылки | Академия Google
36. Куперсмит М.Дж., Розенберг С., Клейнберг Д. Потеря зрения у беременных с аденомами гипофиза. Ann Intern Med (1994) 121 (7):473–7. дои: 10.7326/0003-4819-121-7-199410010-00001
Куперсмит М.Дж., Розенберг С., Клейнберг Д. Потеря зрения у беременных с аденомами гипофиза. Ann Intern Med (1994) 121 (7):473–7. дои: 10.7326/0003-4819-121-7-199410010-00001
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
37. Гемзелл С., Ван С.Ф. Исход беременности у женщин с аденомой гипофиза. Fertil Steril (1979) 31 (4):363–72.
Академия Google
38. Шлехте Я.А. Клиническая практика. пролактинома. N Engl J Med (2003) 349 (21):2035–41. дои: 10.1056/NEJMcp025334
Полный текст перекрестной ссылки | Академия Google
39. Шлехте Я.А. Длительное лечение пролактином. J Clin Endocrinol Metab (2007) 92 (8):2861–5. doi:10.1210/jc.2007-0836
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
40. Лавай Б.А., Мир С.А. Беременность и гипофизарные заболевания: проблемы диагностики и лечения. Indian J Endocrinol Metab (2013) 17 (6):996–1004. дои: 10.4103/2230-8210.122608
Indian J Endocrinol Metab (2013) 17 (6):996–1004. дои: 10.4103/2230-8210.122608
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
41. Молич М.Е. Лечение пролактином во время беременности. J Reprod Med (1999) 44 (12 Дополнение): 1121–6.
Академия Google
42. ван Роон Э., ван дер Вийвер Дж. К., Герретсен Г., Хекстер Р. Е., Ваттендорф Р. А. Быстрая регрессия супраселлярной пролактиномы после лечения бромокриптином во время беременности. Fertil Steril (1981) 36 (2):173–7.
PubMed Резюме | Академия Google
43. Лю С., Тиррелл Дж. Б. Успешное лечение крупной макропролактиномы каберголином во время беременности. Гипофиз (2001) 4 (3):179–85. doi:10.1023/A:101531
80
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
44. Бронштейн М.Д., Сальгадо Л. Р., де Кастро Мусолино Н.Р. Медикаментозное лечение аденом гипофиза: частный случай ведения беременной. Гипофиз (2002) 5 (2):99–107. doi:10.1023/A:1022364514971
Р., де Кастро Мусолино Н.Р. Медикаментозное лечение аденом гипофиза: частный случай ведения беременной. Гипофиз (2002) 5 (2):99–107. doi:10.1023/A:1022364514971
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
45. Colao A, Di Sarno A, Cappabianca P, Di Somma C, Pivonello R, Lombardi G. Прекращение длительной терапии каберголином при опухолевой и неопухолевой гиперпролактинемии. N Engl J Med (2003) 349 (21):2023–33. дои: 10.1056/NEJMoa022657
PubMed Резюме | Полный текст перекрестной ссылки | Академия Google
46. Auriemma RS, Perone Y, Di Sarno A, Grasso LF, Guerra E, Gasperi M, et al. Результаты одноцентрового обсервационного 10-летнего обзорного исследования рецидивов гиперпролактинемии после беременности и лактации. J Clin Endocrinol Metab (2013) 98 (1):372–9. doi:10.1210/jc.2012-3039
PubMed Резюме | Полный текст перекрестной ссылки | Google Scholar
Опухоли гипофиза | ЮКОСС | NPEU
Ключевые моменты
- Опухоли гипофиза вырабатывают гормоны, которые могут оказывать пагубное влияние на течение беременности.
- Гипофиз увеличивается во время беременности; при наличии опухоли она может сдавливать окружающие структуры, включая зрительный нерв.
- Это будет первое национальное исследование по оценке материнской и внутриутробной смертности и заболеваемости опухолями гипофиза во время беременности.
- Эта информация будет использована для разработки рекомендаций по ведению женщин с опухолями гипофиза во время беременности.
Период эпиднадзора
Март 2010 г. – март 2013 г.
Справочная информация
Опухоли гипофиза встречаются редко и осложняют приблизительно 1 из 4500 беременностей в Великобритании. Эти опухоли часто выделяют гормоны, избыток которых может иметь разрушительные последствия для матери и будущего ребенка. Кроме того, многие опухоли гипофиза требуют лечения специфическими лекарствами или хирургического вмешательства, что также может привести к неблагоприятным исходам для плода или новорожденного.
Макропролактинома — это доброкачественная опухоль гипофиза диаметром 1 см и более, вырабатывающая гормон пролактин. Риск увеличения нелеченной макропролактиномы во время беременности составляет примерно 26% по сравнению с 3% у женщин, ранее получавших хирургическое лечение и/или лучевую терапию [1] . Препаратом выбора является каберголин, который использовался при более чем 350 беременностях [2] [3] , несмотря на указания, что его не следует использовать при беременности [4] . Руководство основано на исследованиях с участием небеременных пациентов, которые продемонстрировали повышенный сердечный фиброз. Тем не менее, не было документально подтверждено увеличение частоты врожденных аномалий или сердечного фиброза у матери или плода, связанное с применением низких доз каберголина во время беременности. Альтернативные лекарства не были широко использованы во время беременности.
Риск увеличения нелеченной макропролактиномы во время беременности составляет примерно 26% по сравнению с 3% у женщин, ранее получавших хирургическое лечение и/или лучевую терапию [1] . Препаратом выбора является каберголин, который использовался при более чем 350 беременностях [2] [3] , несмотря на указания, что его не следует использовать при беременности [4] . Руководство основано на исследованиях с участием небеременных пациентов, которые продемонстрировали повышенный сердечный фиброз. Тем не менее, не было документально подтверждено увеличение частоты врожденных аномалий или сердечного фиброза у матери или плода, связанное с применением низких доз каберголина во время беременности. Альтернативные лекарства не были широко использованы во время беременности.
Опухоли гипофиза, секретирующие избыточные гормоны, связаны с более высокой заболеваемостью и смертностью. Болезнь Кушинга и акромегалия связаны с повышенной частотой гипертонии (потенциально приводящей к преэклампсии), диабета и сердечной недостаточности [1] . Болезнь Кушинга связана с высокой заболеваемостью плода (самопроизвольный аборт 5%, мертворождение 6% и недоношенность 43%) [5] . Существует очень мало литературы по использованию лекарств для лечения этих состояний во время беременности.
Болезнь Кушинга и акромегалия связаны с повышенной частотой гипертонии (потенциально приводящей к преэклампсии), диабета и сердечной недостаточности [1] . Болезнь Кушинга связана с высокой заболеваемостью плода (самопроизвольный аборт 5%, мертворождение 6% и недоношенность 43%) [5] . Существует очень мало литературы по использованию лекарств для лечения этих состояний во время беременности.
После этого исследования мы сможем предоставить исчерпывающую информацию об исходах для матери и плода, связанных с лекарствами, используемыми для лечения опухолей гипофиза, и эта информация будет использована в качестве основы для разработки рекомендаций по клиническому ведению.
Цель
Использовать Систему акушерского наблюдения Соединенного Королевства для описания исходов для матери и плода у женщин с опухолями гипофиза во время беременности
Вопросы исследования
- Какая часть женщин с опухолями гипофиза имеет значительное увеличение опухоли во время беременности?
- Каковы текущие стратегии мониторинга и лечения женщин с опухолями гипофиза во время беременности?
- Каковы исходы беременности для матери и ребенка?
Определение случая
Все женщины в Великобритании с опухолью гипофиза во время беременности за исключением микропролактиномы (опухоль, секретирующая пролактин, диаметром менее 1,0 см).